宁夏枸杞幼苗叶片中抗氧化酶及游离氨基酸对镉胁迫的响应
2021-03-25梁昕昕辛亚平贾雪闫兴富魏玉清赵会君
梁昕昕,辛亚平,贾雪,闫兴富,魏玉清,赵会君
北方民族大学生物科学与工程学院国家民委生态系统建模及应用重点实验室,银川 750021
镉(cadmium, Cd)是一种毒性较强的重金属,通过农药化肥等农艺措施进入土壤,进而向植物体内迁移,不但影响植物的生长发育,而且可以通过食物链向人体迁移,影响人体健康。Cd在植物体内的累积会导致植物组织器官的形态改变[1-4],刘家豪[1]研究发现,随着Cd浓度的增加,水稻叶肉细胞细胞膜系统被破坏,出现质壁分离等现象;胡炎[2]发现Cd处理下的东南景天茎韧皮部细胞质壁分离,细胞器变形;韩盼盼[3]发现Cd胁迫严重破坏了龙葵叶肉细胞的结构,细胞壁断裂,细胞器受损;李仕友[4]发现Cd胁迫的万年青叶片组织明显被破坏。因此,研究Cd胁迫下植物叶片的形态组织变化,可以反映出植物对Cd的耐受适应性。Cd在植物体内的累积诱导产生并累积了大量的活性氧物质,打破了细胞内的氧化还原平衡机制,影响着植物体内的抗氧化酶即过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD)和超氧化物歧化酶(superoxide dismutase, SOD)的活性[5-7]。杨叶萍等[8]发现Cd胁迫下苎麻体内的SOD、POD与CAT活性增加与Cd的耐受性呈显著相关,因此研究Cd对植物抗氧化酶活性的影响,有助于揭示植物抗逆生理机制。
逆境环境下,氨基酸也参与了植物的抗逆反应[9-14],比如甘氨酸(glycine, Gly)能够增加植物对磷钾的吸收,提高植物的抗逆性,苏氨酸(threonine, Thr)和丙氨酸(alanine, Ala)能够抵抗植物根际病害,脯氨酸(proline, Pro)能调节植物水势,能引起渗透压下降,精氨酸(arginine, Arg)具有贮藏氮元素营养的功能[10-12]。近年来的研究发现,氨基酸也参与了植物耐受重金属的过程,如具有渗透调节能力和重金属螯合能力的脯氨酸、组氨酸(histidine, His)和植物螯合肽(phytochelatins),具有清除过氧化物质的谷胱甘肽(glutathione)等与重金属解毒有重要的关系,有研究表明Cd能够改变植物体内氨基酸的含量和种类[13-14],Cd会诱导植物体内脯氨酸大量累积而减轻毒害症状,脯氨酸的增加不但可以与重金属形成脯氨酸螯合物,而且可以保护葡萄糖-6-磷酸脱氢酶和硝酸还原酶的活性免受锌(Zn)、Cd的影响,组氨酸能与镍(Ni)和Zn螯合而降低毒性,还有研究发现组氨酸增加了酵母菌对重金属的耐受能力[15],铜(Cu)主要与天冬氨酸(aspartic acid, Asp)和苏氨酸络合在一起。半胱氨酸(cysteine, Cys)参与甲硫氨酸(methionine, Met)和谷胱甘肽/植物螯合肽的合成,Cd胁迫能提高拟南芥合成半胱氨酸的能力[16]。
枸杞是宁夏的特色资源植物,但近年来,由于农药化肥的过度使用以及土壤污染日益严重,屡有枸杞及枸杞加工产品中重金属Cd被检出或者超标的文献报道[17-20];枸杞是宁夏当地重要经济树种,也因其优异的抗逆性能,成为盐碱地及矿区修复的主栽先锋树种,因此研究枸杞Cd胁迫下的叶片解剖结构、抗氧化酶的活性变化和游离氨基酸的分配特征,挖掘氨基酸代谢及转运相关基因的功能,将有助于了解枸杞适应外源性Cd胁迫和对Cd解毒的作用机理。因此本文通过对Cd胁迫下枸杞叶片石蜡切片的观察、抗氧化酶活性的测定、游离氨基酸组成及分布的检测和氨基酸转运蛋白基因表达模式的分析,以期揭示枸杞对Cd耐受的生理及分子机制。
1 材料与方法(Materials and methods)
1.1 实验材料
选取生长健壮、大小基本一致的宁夏枸杞组培快繁苗,移栽在Hoagland营养液中,置于人工气候室培养,培养温度28 ℃,光照时间12 h,湿度60%,每5 d更换一次营养液。待苗子长至10 cm高时,进行后期实验处理。
1.2 实验方法1.2.1 枸杞幼苗的处理
经过前期预实验,以1个月内宁夏枸杞幼苗的生长及生理变化情况为例,100 μmol·L-1的Cd胁迫下,枸杞生理及形态变化明显而不出现严重致死表型,因此本实验选取生长健康、大小一致的枸杞幼苗54株,分别配制含0 μmol·L-1和100 μmol·L-1CdCl2的Hoagland营养液进行处理,每个处理9株,设置3个重复。
1.2.2 枸杞叶片组织石蜡切片、染色及观察
选取无Cd处理和Cd处理后第72小时、第144小时的枸杞幼苗的成熟叶片,于FAA固定液中固定过夜,固定后的材料依次置于75%、85%、95%、95%和100%的乙醇中脱水1 h,脱水后的材料经二甲苯溶液透明后浸蜡包埋。蜡块用石蜡切片机切成厚度约为8 μm的切片,采用番红-固绿进行二重染色,用中性树胶封片,具体步骤可参考Deng等[21]的植物石蜡切片技术。
将制成的石蜡切片放在光学显微镜下用20×目镜观察拍照,并测定叶片栅栏组织细胞长度、海绵组织细胞长度,为了体现实验的重复性,分别选取3株枸杞幼苗相同部位切片测量每项指标,计算平均值,用Graphpad软件进行显著性和方差分析。
1.2.3 枸杞苗叶片中SOD、POD和CAT酶活性的测定
选取长势均匀一致的水培枸杞苗,在Hoagland营养液中分别设置3种不同浓度梯度的CdCl2(0、100和200 μmol·L-1),每个处理重复3组,于处理第24小时、第48小时和第72小时取样,分别称取每个处理的新鲜成熟叶片各0.5 g,用加入5 mL酶提取液在冰浴研钵中研磨均浆,于4 ℃、11 400 r·min-1离心20 min,吸取的上清液即为酶粗提液。SOD、POD和CAT的活性参考Huang等[22]的方法测定,每个处理重复3次,得到的数据用Graphpad软件进行显著性和方差分析。
1.2.4 枸杞幼苗氨基酸含量的测定
枸杞幼苗经0 μmol·L-1和100 μmol·L-1Cd处理72 h后,分别取地上部茎、叶组织,每个处理重复取样3次,每次重复取3株苗,液氮速冻后用于组织中游离氨基酸含量的测定。
称取一定量的样品于EP管中,加入1 000 μL提取液(V(乙腈)∶V(甲醇)∶V(水)为2∶2∶1,含400 nmol·L-1内标混合液,-20 ℃),涡旋30 s混匀并研磨处理,4 ℃、12 000 r·min-1离心15 min后取80 μL上清液至LC进样瓶中,用于UHPLC-MS/MS分析,另取上清稀释10倍后4 ℃、12 000 r·min-1离心15 min;取80 μL上清液至LC进样瓶中,用于UHPLC-MS/MS分析,本项目使用Agilent 1290 Infinity Ⅱ series (Agilent Technologies)超高效液相色谱仪,通过Waters ACQUITY UPLC BEH Amide (100 mm×2.1 mm, 1.7 μm, Waters)液相色谱柱对目标化合物进行色谱分离,液相色谱A相为1%甲酸水溶液,B相为1%甲酸乙腈,柱温箱温度为35 ℃,样品盘设为4 ℃,进样体积为1 μL,流速0.2~0.4 mL·min-1。所有质谱数据采集及目标化合物定量分析工作,均通过Agilent MassHunter Work Station Software (B.08.00, Agilent Technologies)来完成。
1.2.5 转录组测序及氨基酸代谢、合成、转运相关基因的筛选
选取生长健康、大小一致的枸杞幼苗,以无Cd处理的幼苗为对照,经100 μmol·L-1的Cd处理12 h和48 h后,收集对照和各处理的叶片组织,液氮速冻后用干冰辅助保存运输到深圳华大公司进行转录组测序。所获得的数据利用GO(Gene Ontology)数据库和KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库进行注释,重点筛选参与氨基酸合成和转运、代谢相关的基因并进行实时荧光定量PCR验证。
1.2.6 实时荧光定量PCR技术分析基因的表达变化模式
1.2.6.1 枸杞组织中RNA的提取及cDNA的合成
取生长大小一致的枸杞幼苗,经100 μmol·L-1的CdCl2处理,于处理后的第0小时、第2小时、第8小时、第12小时、第24小时、第48小时和第72小时取成熟叶片组织,液氮速冻后用于RNA的提取。每0.1 g枸杞组织于液氮中充分研磨后,加入1 mL invitrogen trizol试剂,按照说明书操作步骤提取总RNA,用甲醛变性胶检测RNA的完整性,取1 μg总RNA经DNaseI (Thermo Fisher Scientific, USA)处理后,用逆转录试剂盒(北京全式金)逆转录合成cDNA,用于实时荧光定量PCR的模板。
1.2.6.2 实时荧光定量PCR检测基因表达
为进一步研究氨基酸转运、代谢相关基因在Cd胁迫下的表达变化情况,筛选了6个相关基因,引物采用primer express 3.0软件设计,采用美国MX3000pTMqPCR实时荧光定量PCR仪,以宁夏枸杞的β-actin基因作为内参基因[23],SYBR Green Universal Master mix kit (Toyobo, Osaka, Japan)为荧光染料,模板为稀释20倍的cDNA,反应体系为20 μL,反应条件为95 ℃、10 min,(95 ℃ 30 s,60 ℃ 30 s和72 ℃ 30 s),每个基因设置3组重复,45个循环,反应结束后进行溶解曲线分析,所需引物序列如表1所示。
2 结果与分析(Results and analysis)
2.1 Cd对枸杞幼苗叶片显微结构的影响
如图1所示,与对照相比,随着Cd处理时间的增加,枸杞叶片上表皮细胞逐渐致密,细胞变小。100 μmol·L-1Cd处理第72小时时,栅栏组织细胞的长度平均在70.93~85.59 μm左右,与对照相比差异达到显著水平(P<0.0001);处理第144小时时,栅栏组织细胞的长度平均在51.27~77.41 μm,与对照相比差异达到显著水平(P<0.0001)。此外,海绵组织的细胞也在变小,100 μmol·L-1Cd处理第72小时时,海绵组织细胞长度大约在64.25~71.88 μm,与对照相比差异不显著(P>0.05);处理第144 小时时海绵组织细胞的长度平均在52.92~60.78 μm,与对照相比差异达到显著水平(P<0.0001)。

表1 实时荧光定量PCR所用引物Table 1 The primers for qRT-PCR

图1 不同处理时间下镉(Cd)对枸杞叶解剖结构的影响注:E表示表皮细胞,P表示栅栏组织,S表示海绵组织;**、***、****表示与对照相比达到显著水平(P<0.01、P<0.001、P<0.0001); (a)未处理的叶片解剖结构图(×20),(b)Cd处理72 h的叶片解剖结构图(×20),(c)Cd处理144 h的叶片解剖结构图(×20), (d)Cd处理后叶片栅栏组织细胞长度,(e) Cd处理后叶片海绵组织细胞长度。Fig. 1 Effects of cadmium (Cd) on anatomical structure of Lycium barbarum L. leaves under different treatment timeNote: E represents epidermis; P represents palisade parenchyma; S represents spongy parenchyma; **denotes P<0.01, ***denotes P<0.001 and ****denotes P<0.0001, compared with the control (CK); (a) Anatomical structure of untreated leaves (×20 magnification); (b) Anatomical structure of leaves treated with Cd for 72 h (×20 magnification); (c) Anatomical structure of leaves treated with Cd for 144 h (×20 magnification); (d) Cell length of palisade tissue of leaves treated with Cd; (e) Cell length of spongy tissue of leaves treated with Cd.
2.2 抗氧化酶活性变化
如图2所示,随着Cd胁迫浓度的增加和处理时间的延长,CAT活性呈现上升—下降—上升的趋势,与对照相比,在第72小时达到显著水平(P<0.01);POD活性整体呈现上升趋势,在受200 μmol·L-1Cd处理的第48小时,与对照组差异已达到显著水平(P<0.01);SOD活性在第24小时随着Cd胁迫浓度的增加有下降的趋势,但并不显著,随着胁迫时间延长呈明显的上升趋势,与对照相比差异达到显著水平(P<0.01)。数据表明在Cd胁迫早期,CAT、POD和SOD参与了枸杞对逆境胁迫的响应。
2.3 Cd胁迫对枸杞不同组织中游离氨基酸含量的影响
如表2所示,与对照相比,经100 μmol·L-1的CdCl2处理72 h后,叶片和茎段中的氨基酸含量发生了一些改变,叶片中氨基丁酸、脯氨酸、谷氨酸、瓜氨酸和丙氨酸等含量上升,与对照相比,氨基丁酸和脯氨酸含量上升达到显著水平(P<0.05),瓜氨酸和丙氨酸含量上升达到显著水平(P<0.01),叶片中谷氨酸含量也上升,但不显著;而部分氨基酸的含量却显著下降,如缬氨酸下降达显著水平(P<0.05)、精氨酸与赖氨酸下降达显著水平(P<0.001)、丝氨酸下降达显著水平(P<0.01);在茎段中,苯丙氨酸、缬氨酸和组氨酸下降达到显著水平(P<0.01),甘氨酸、天门冬氨酸和精氨酸下降达到显著水平(P<0.05),苏氨酸和谷氨酰胺下降达到显著水平(P<0.001),而脯氨酸的含量却显著增加(P<0.01),在短期胁迫下枸杞不同组织中的氨基酸含量都发生了明显的改变,说明Cd胁迫影响了枸杞苗体内的氨基酸代谢与合成。
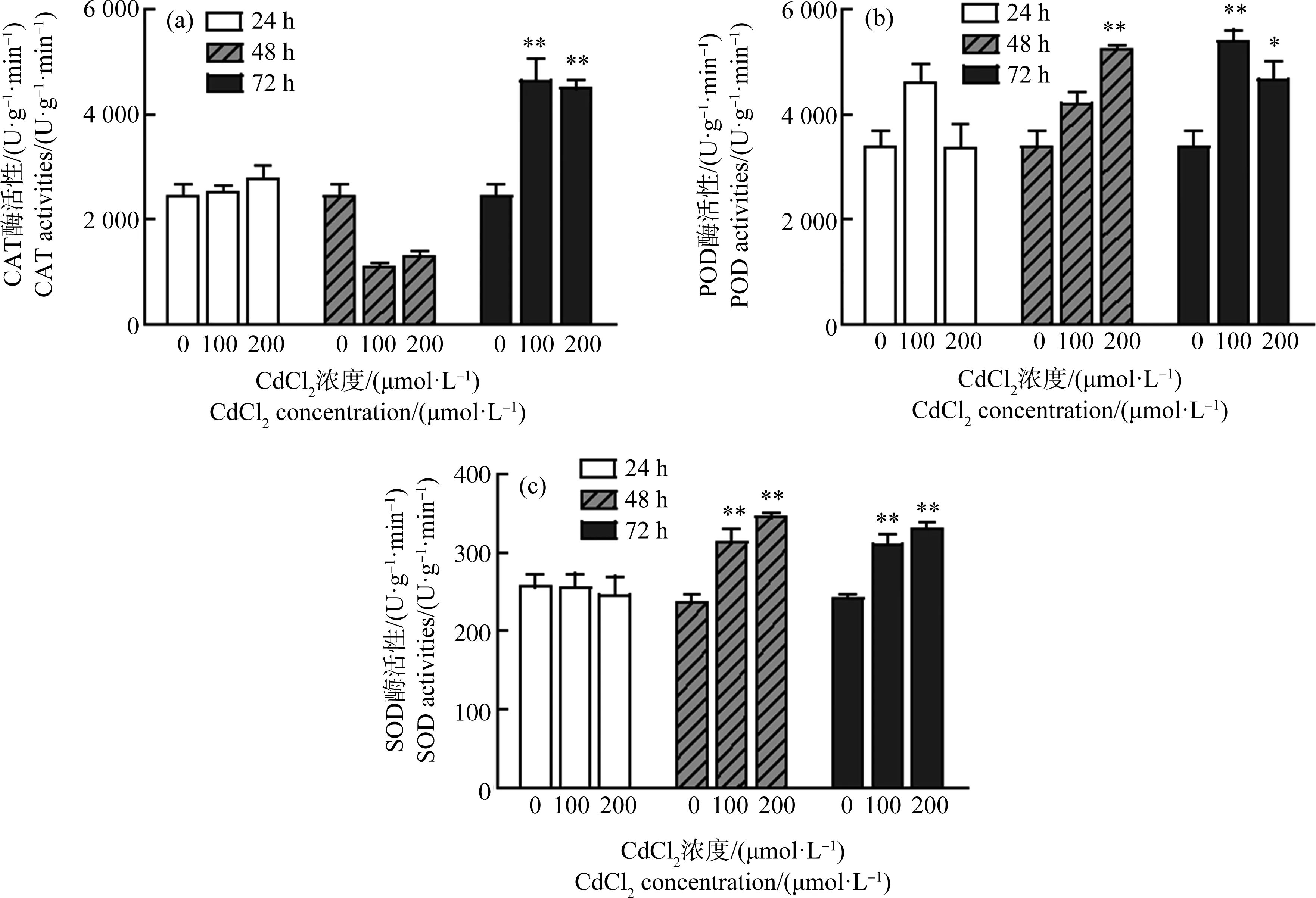
图2 不同处理时间、不同Cd浓度对枸杞酶活性的影响注:*、**表示与对照相比达到显著水平(P<0.05、P<0.01)。Fig. 2 Effects of different concentrations of Cd on the enzyme activity of Lycium barbarum L. under different treatment timeNote: *, **denote P<0.05, P<0.01, compared with the control (CK).
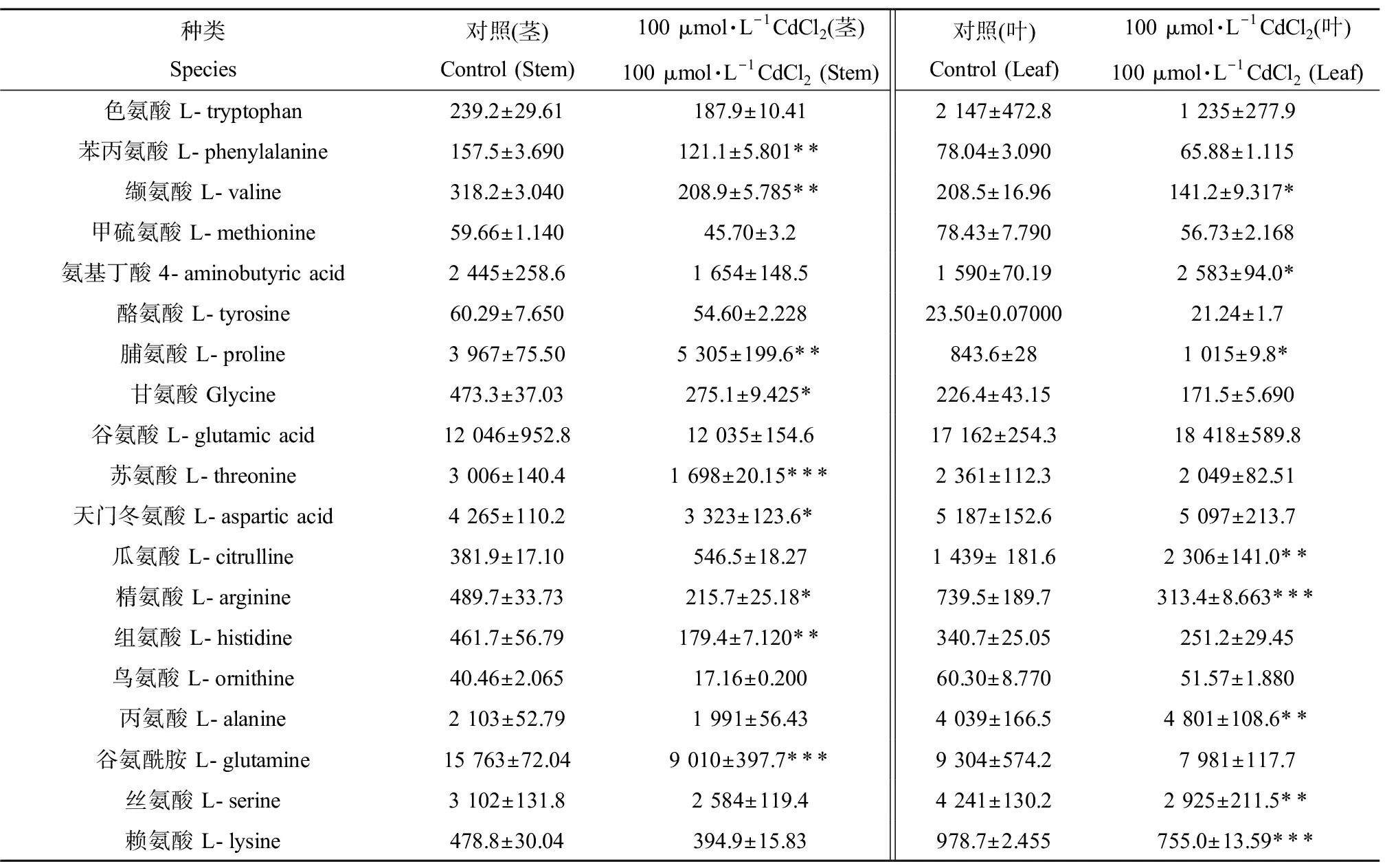
表2 氨基酸在茎叶中的含量Table 2 The amino acid contents in leaf and stem tissues (nmol·g-1)
2.4 转录组数据中氨基酸代谢、转运相关基因的筛选及其注释
以无Cd胁迫的幼苗转录组数据为对照,在Cd胁迫第12小时、第48小时的根系和叶片中,分别筛选到了一些参与氨基酸吸收、转运及合成代谢的相关基因,并利用Mev软件对这些基因进行了热图聚类分析,如图3、表3和表4所示。在叶片及根系中高效表达的基因主要有部分氨基酸转运蛋白、氨基酸通透酶、转氨酶等,而另外一些氨基酸转运蛋白、转氨酶和合成酶却呈现抑制状态,这可能受氨基酸种类的影响。
2.5 基因的表达模式分析
如图4所示,AMT基因在Cd胁迫下的第72小时表达量达到显著水平(P<0.01),是对照的2.6倍,BAD基因在胁迫第2、12、24和48小时表达倍数达到显著水平(P<0.05、P<0.01),GST基因在胁迫的第12小时表达倍数达为对照的40倍,达到显著水平(P<0.01);NAT基因表达也受Cd的诱导,在处理第12、48小时达到显著水平(P<0.001),分别是对照的10倍和15倍。而PAP基因在胁迫的第8小时为对照的4.5倍,达到显著水平(P<0.001),之后表达水平回落,TAT的表达在第8、12和24小时也有所上升,但是表达不显著。实时荧光定量PCR结果显示,这些参与氨基酸代谢、转运与合成的基因,都受到Cd的胁迫而上调表达,参与了Cd胁迫下氨基酸的代谢合成及转运。
3 讨论(Discussion)
近年来,关于植物在Cd胁迫下生长与代谢的研究已成为植物逆境生理学研究的热点之一。Cd是重金属,在植物体内的累积量越多,对植物的影响越大[24]。已有研究表明,为了降低胁迫对植物造成的损伤,减少植物体内水分的散失,提高植物的抗胁迫能力,叶片表皮细胞会致密化[25],叶肉组织细胞也会皱缩[26]。本研究发现随着Cd胁迫时间的延长,植物叶片的表皮细胞逐渐致密化,栅栏组织细胞与海绵组织细胞不断缩小,这一结果与刘来[27]的研究发现基本一致,因此我们推测枸杞叶片细胞的缩小与致密化可能会提高枸杞对Cd的耐受性。
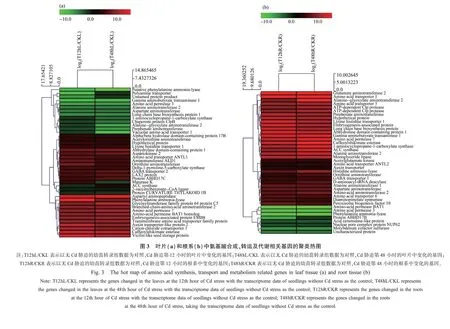

表3 叶片中筛选的氨基酸代谢转运相关基因Table 3 The genes related to amino acid metabolism and transport selected from leaf

表4 根系中筛选的氨基酸代谢转运相关基因Table 4 The genes related to amino acid metabolism and transport selected form root tissue
重金属会诱导植物生成大量的活性氧,而抗氧化酶则会清除活性氧,抵抗重金属对植物的毒害作用[28],因此在一定程度上抗氧化酶活性的高低可反映植物对重金属的耐受能力。本研究发现,枸杞中CAT和SOD酶活性在处理第48小时时呈现下降趋势,有文献报道,CAT和SOD是金属酶,Cd在一定程度上会替换金属酶的金属离子,导致酶活性下降[29],但是CAT、SOD和POD总体上呈现上升的趋势,这一研究结果与李仕友[4]的研究结果较一致,说明Cd胁迫早期,枸杞能保持较高的抗氧化酶活性,从而对Cd胁迫产生一定的耐受性。
有研究表明,严重的逆境胁迫会显著影响植物体内蛋白质的合成与水解系统,即蛋白质会趋向水解,而合成降低。降解后的游离小分子物质或氨基酸在渗透调节、结构保护和代谢调控方面的作用和意义也越来越受到重视[10]。已有大量文献报道脯氨酸是一种重要的渗透调节物质,植物体内脯氨酸含量的增加与重金属胁迫有显著的相关性[12-13],脯氨酸不但可以调控植物适应由于重金属胁迫造成的水分缺乏,清除氧化自由基,而且还可以通过调控气孔关闭来限制重金属离子的转移[26-32]。本研究发现,枸杞幼苗的茎叶在受到Cd胁迫后第72小时,脯氨酸均有显著累积趋势,暗示脯氨酸在Cd胁迫下可能起到重要的调控作用。根据已有文献报道可知,外源氨基丁酸的浸泡处理可以显著性提高植物种子萌发期POD和CAT的活性及发芽指数[33],也可以促进盐胁迫下白刺叶片的光合参数[34],表明氨基丁酸能显著性提高植物体内POD和CAT活性,增强植物对逆境的适应能力。本实验结果发现,与对照相比,Cd胁迫诱导了枸杞叶片中氨基丁酸含量显著增加(P<0.05),因此推测这可能与叶片对Cd的耐受性相关。丙氨酸在叶片中的含量显著增加(P<0.01),由于丙氨酸能增加叶绿素的合成,调节气孔开放,对逆境有一定的抵抗作用[11],因此,可能是Cd胁迫下枸杞叶片的一种保护措施。瓜氨酸具有通过一氧化氮合酶(NOS)催化精氨酸生成一氧化氮(NO)的功能,而NO具有减缓逆境胁迫对质膜的伤害,促进脯氨酸的累积,提高抗氧化活性等功能[35],因此推测叶片中瓜氨酸含量显著增加间接提高了植物对逆境的适应性,而游离状态的组氨酸却在茎秆中显著下降,究竟是由于组氨酸与重金属形成络合物而导致含量下降,还是其他的原因,需要进一步的研究。
逆境胁迫还会引起植物体内氨基酸的分配和转运,ATF(amino acid transporter family)和APC(amino acid polyamine and choline transporters)家族的基因是目前研究报道的植物氨基酸转运蛋白。本研究结果充分证实了部分氨基酸转运蛋白基因(如NAT、TAT、PTS和PAP)对Cd的响应,可能参与了Cd胁迫下相关氨基酸的转运和分配,氨基酸通透酶(amino acid permease, AAP)是位于细胞膜上与氨基酸转运有关的载体蛋白,将AAP基因转入玉米中后能显著增加玉米籽粒中游离氨基酸含量,提高植物对氮素的利用效率[36],AAP基因不但在茎叶中高效表达,而且还参与了茎和根的发育[37],本研究通过热图聚类发现,一些氨基酸通透酶的表达量显著增加,实时荧光定量PCR验证了PAP基因受Cd调控而上调表达,这些基因的表达,可能会提高Cd胁迫下枸杞对氮素的利用效率。
总之,由于Cd胁迫下枸杞叶片组织细胞的致密与缩小减少了水分子蒸发,保持着较强的抗氧化酶活性、同时在茎叶中大量累积参与Cd解毒和螯合作用的脯氨酸、氨基丁酸、瓜氨酸和丙氨酸等氨基酸来调节地上部对Cd的耐受性,在期间,一些氨基酸通透酶和转运蛋白,在氨基酸吸收及转运分配中起到重要作用,这些措施可能是枸杞Cd胁迫下的重要保护机制。
