胶质瘤干细胞外泌体通过PI3K/Akt信号通路促进胶质瘤U87细胞侵袭、迁移
2021-03-25任光辉李武雄齐利豪
任光辉 李武雄 齐利豪
胶质瘤是颅内最常见的原发性恶性肿瘤,病死率、致残率高[1,2]。外泌体(exosomes,exo)是细胞在生理、病理条件下释放到胞外的一种双层膜囊泡,能与靶细胞受体结合或水平转移内含物而发挥生物学功能[3]。研究发现,肿瘤细胞来源的exo 能通过不同机制影响肿瘤的侵袭、转移、血管生成等[4]。本研究探讨胶质瘤干细胞外泌体(glioma stem cells exosomes,GSCs-exo)对体外培养的胶质瘤U87细胞侵袭、迁移能力的影响。
1 材料与方法
1.1 细胞培养U87 胶质瘤细胞株(中国医学科学院基础医学研究所基础学细胞中心提供)置于含10%胎牛血清、1%青霉素-链霉素的DMEM培养基培养。
1.2 GSCs 分离、培养及鉴定 取对数生长期U87 细胞,消化重悬后,转移至干细胞培养液(上海索莱宝科技有限公司)培养至第3代细胞,转移至防脱载玻片,贴壁后以多聚甲醛固定,清洗后依次加入Nestin抗体、CD133 一抗(1∶200),4 ℃孵育过夜,清洗后加入FITC标记的二抗(1∶400;德国默克公司),室温下孵育1 h,避光处理,加入核衬染物DAPI,室温孵育10 min,荧光显微镜下观察。同时在有多聚左旋赖氨酸涂层的载波片上进行第3代GSCs 诱导分化,常规培养5 d后,进行GFAP荧光染色,2周后进行Neun染色,激光共聚焦显微镜下观察拍照。
1.3 GSCs-exo 的提取与鉴定 超速离心法提取exo。按照QIAAGEN GSCs-exo 提取试剂盒(上海李记生物科技有限公司)说明书,收集GSCs 上清细胞培养液,加入XWP、XE 缓冲液分别离心洗涤、洗脱,获得GSCs-exo 混合液固定,加入3%磷钨酸溶液负染,透射显微镜下观察GSCs-exo形态。RIPA裂解液(上海索莱宝科技有限公司)提取GSCs-exo 蛋白,10%SDS-PAGE电泳分离转移至PVDF膜,室温封闭2 h,加入CD63 一抗(1:500),4 ℃孵育过夜,加入HRP 标记的二抗(1:5 000),孵育2 h,ECL曝光拍照。
1.4 干预与分组 取50 μl GSCs-exo,经RIPA裂解液处理,BCA 试剂盒(上海纪宁生物科研试剂盒公司)测量蛋白浓度,以10% exo 血清培养液分别稀释至20、40、80 μg/ml。取对数生长期U87 细胞接种于6孔板中,密度调整为1×105/孔,随机分为4组:对照组和高、中、低GSCs-exo 浓度组(分别加入20、40、80 μg/ml的GSCs-exo),每组5个复孔。
1.5 Transwell 实验检测U87 细胞侵袭能力100 μl 50 mg/L的Matrigel基质胶1∶40稀释液包被底部膜上室面。收集对数生长期细胞,按照2×105个/孔移入Transwell 小室,下层加入10%胎牛血清的1640 培养基500 μl,对照组、GSCs-exo组小室上室分别加入无血清1640 培养基150 μl 和重悬外泌体150 μl,37 ℃培养24 h,甲醇室温固定10 min。侵袭置滤膜下表面的细胞以结晶紫染色,正置显微镜下随机选取5个视野拍照,计算穿膜细胞数,取平均值。
1.6 划痕实验检测U87 细胞迁移能力 对数生长期细胞以2×105个/孔接种于6孔板常规培养,细胞贴壁生长时,弃培养基,以50 μl 无菌移液枪头在培养板中间划线,后加入完全培养基继续培养24 h后拍照,计算细胞迁移率。迁移率(%)=(初始划痕宽度-24 h后划痕宽度)/初始划痕宽度×100%。
1.7 免疫印记法检测U87 细胞磷脂酰肌醇-3 激酶(phosphatidylinositol 3-kinase,PI3K)/蛋 白 激 酶B(protein kinase B,Akt)、L1CAM 收集各组细胞,RIPA 裂解液处理,BCA 定量蛋白,SDS-PAGE 法分离,转移至PVDF 膜,封闭液封闭,加入一抗(1:2 000),4 ℃封闭过夜,加入二抗(1:10 000;厦门慧嘉生物科技有限公司),室温孵育2 h,ECL 显影,分析目的条带灰度值。
1.8 统计学方法 采用SPSS 25.0进行处理;定量资料以±s表示,采用单因素方差分析和t检验;P<0.05为差异有统计学意义。
2 结果
2.1 GSCs 的鉴定结果 肿瘤细胞球由多个细胞组合而成,即GSCs(图1)。荧光染色可见CD133(图2a)与Nestin(图2b)呈阳性表达。诱导分化5 d 后GSCs分化成胶质细胞,GFAP 阳性表达(图2c),2 周后GSCs分化为神经元细胞,Neun阳性表达(图2d)。
2.2 GSCs-exo 鉴定结果GSCs-exo 为圆形或椭圆形囊泡结构,直径30~100 nm,双层膜包被(图3a)。提取的GSCs-exo 总蛋白显示表达相关标志蛋白CD63(图3b)。
2.3 GSCs-exo 对U87 细胞侵袭能力的影响 高浓度GSCs-exo 组侵袭细胞数量[(135.32±13.47)个]明显高于中浓度GSCs-exo 组[(108.36±11.35)个;P<0.05],而中浓度GSCs-exo 组明显高于低浓度GSCsexo 组[(88.45±8.23)个;P<0.05],低浓度GSCs-exo 组明显高于对照组[(65.32±6.35)个;P<0.05]。
2.4 GSCs-exo 对U87 细胞迁移能力的影响 高浓度GSCs-exo组细胞迁移率[(88.36±8.35)%]明显高于中浓度GSCs-exo组[(72.39±7.25)%;P<0.05],而中浓度GSCs-exo 组明显高于低浓度GSCs-exo 组[(46.35±6.89)%;P<0.05],低浓度GSCs-exo 组明显高于对照组[(23.56±5.12)%;P<0.05]。

图1 胶质瘤干细胞形态鉴定(×40
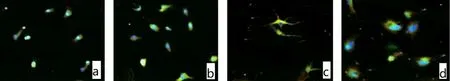
图2 胶质瘤干CD133、Nestin、GFAP、Neun免疫荧光染色鉴定(×40)
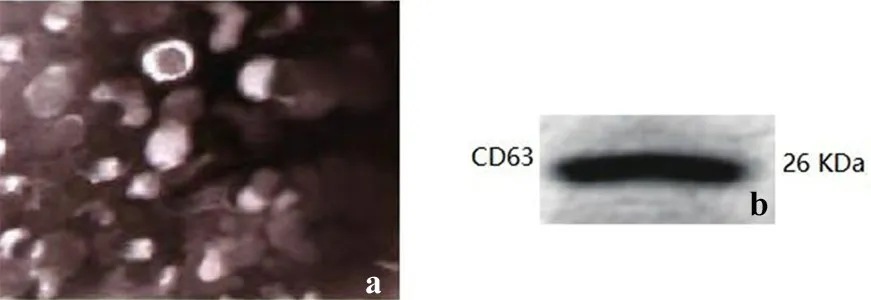
图3 胶质瘤干细胞外泌体鉴定

图4 免疫印迹法检测GSCs-exo 对U87 细胞L1CAM、PI3K、Akt、p-Akt蛋白表达的影响

表1 GSCs-exo对U87细胞L1CAM、PI3K、Akt、p-Akt蛋白表达的影响
2.5 GSCs-exo 对U87细胞PI3K/Akt信号通路蛋白表达的影响 与对照组比较,GSCs-exo组L1CAM、PI3K蛋白表达量及p-AKt/Akt比值明显增高(P<0.05),而且随GSCs-exo 浓度增加明显增高(P<0.05)。见表1、图4。
3 讨论
本研究结果显示,GSCs-exo 能促进胶质瘤U87细胞的侵袭和迁移,而且,GCSs-exo组L1CAM、PI3K与p-AKt/Akt 水平均明显升高;均呈浓度依赖性。这说明GSCs-exo 可上调L1CAM、PI3K 表达,促进Akt磷酸化,从而促进U87细胞侵袭和迁移。
GSCs可自我更新、多向分化、无限增殖,对胶质瘤的生长、转移、浸润、复发及治疗敏感性有决定性作用[4,5]。exo 在细胞间的物质和信息传递中有重要的转导作用,参与肿瘤生长、转移。肿瘤细胞来源的exo,因携带miRNA、DNA 片段、蛋白质、脂质等多种功能分子,能为肿瘤的侵袭和转移提供条件[6]。邹敏等[7]研究显示,缺氧环境下肝癌细胞分泌的exo,可促进肝癌细胞的增殖、迁移与侵。Gong 等[8]发现,GSCs-exo能促进血管内皮细胞的增殖和迁移。
L1CAM 是细胞黏附分子免疫球蛋白超家族的重要成员[9]。张媛[10]研究发现,L1CAM能直传递双向信号,影响细胞的结构、基因表达、细胞增殖和细胞分化等生物学行为,促进肿瘤细胞的侵袭与转移。另外,L1CAM 还可调控血管的生成,参与肿瘤的发展,并提高肿瘤细胞耐药性[11]。PI3K 是具有催化活性的胞内磷脂酰肌醇激酶,Akt 是PI3K 下游的靶向调节分子,Akt可在PI3K的磷化产物激活后发生质-膜转移而被激活,通过磷酸化作用影响胞浆内的生物学信号传递,调控细胞的增殖、侵袭、转移等过程[12,13]。
综上所述,GSCs-exo 可促进胶质瘤U87 细胞的侵袭与迁移,可能与上调L1CAM、PI3K 表达,促进Akt磷酸化有关。
