芪参益气滴丸联合骨髓间充质干细胞移植对心肌梗死小鼠血管新生及心功能的影响研究
2021-03-24何贵新秦伟彬莫霄云张清伟吴成强申永艳玉黎燕冯雨菲
何贵新,肖 婷,秦伟彬,林 琳,莫霄云,张清伟,吴成强,申永艳,玉黎燕,冯雨菲
(1.广西中医药大学第一附属医院心血管内科二区,广西 南宁530022;2.广西中医药大学,广西 南宁530299)
近年来,随着当代社会人口老龄化加剧,以及现代生活水平的提高造成饮食习惯、工作压力等改变,急性心肌梗死(acute myocardial infarction,AMI)的发病率也不断攀升,据相关调查显示[1],中国每年AMI 新发病例至少为50 万例,已严重威胁到人类生命健康,加重家庭经济负担。心肌组织再生能力弱,一旦细胞凋亡、坏死等发生受损,心肌组织将被纤维瘢痕组织所取代,导致心室顺应性下降,最终影响心脏功能。近年来,通过胚胎干细胞、诱导多能干细胞、间充质干细胞、骨骼干细胞、内源性心脏干细胞等多种类型的干细胞移植的细胞治疗方法,以修复坏死心肌,减缓心脏重塑,改善心脏收缩和舒张功能,防治心功能不全,是近年来的热点研究方向[2,3]。目前临床上多采用药物溶栓、手术介入以解决血管堵塞的问题,该治疗方法具有恢复心肌缺血再灌注的作用,但无法很好地修复或逆转已受损的心肌细胞,因此无法从根本上改善心脏功能。骨髓间充质干细胞(bone marrow mesenchy-mal stem cells,BMSCs)在组织损伤修复中发挥着重要角色,目前研究学者也趋向进行受损心肌的干细胞移植研究,认为是另外一种较有前景的心肌梗死治疗方法[4]。现代药理学研究发现[5,6],中药复方芪参益气滴丸在减少炎症反应、改善心肌代谢、保护受损心肌等方面,具有明显的积极意义。另外,尽管目前有较多关于BMSCs 治疗心肌梗死的动物实验和临床前研究,但迄今未见BMSCs 联合应用芪参益气滴丸干预心肌梗死小鼠的治疗研究。因此,本研究采用体外细胞分子生物学实验,旨在观察芪参益气滴丸联合BMSCs 移植对心肌梗死小鼠血管再生及心功能的影响,以期为心肌梗死与心梗后缺血再灌注损伤的防治提供理论基础和实验依据。
1 材料与方法
1.1 实验动物
C57BL/6J 雄性健康清洁级小鼠68 只:6~8 周龄,体重25~34 g。其中8 只小鼠提取骨髓间充质干细胞备用。全部小鼠经普通饲料适应性喂养,昼夜各半明暗环境交替。实验动物均购自广西大学动物实验中心。实验流程严格遵循美国卫生机构发布的《实验动物保护和应用指南》,同时实验操作均严格遵守广西中医药大学动物实验管理委员会的相关规定。
1.2 药物、试剂与主要仪器
芪参益气滴丸作为实验药物,其主要由中药丹参、黄芪、三七、降香组成,由天士力医药集团股份有限公司生产,国药准字Z20030139,规格为每袋0.5 g,用蒸馏水将芪参益气滴丸制备为3.9 mg/mL浓度的药液,保存备用。15% 胎牛血清(Gibco 公司),0.25% 胰蛋白酶消化液(Gibco 公司),明胶(Sunshine 公司),DAPI(Invitrogen 公司),成纤维细胞生长因子4(Sigma 公司),一抗Rat anti-mouse CD31、CD105、CD45、CD117、CD90.2(BioLegend公司),荧光二抗APC conjugate Goat anti-Rat IgG二抗(ThermoScientific 公司),流式染色缓冲液(eBioscience 公司),TUNEL 试剂盒(Roche 公司)。细胞摄像及成像系统及荧光显微镜(日本Olympus公司),小动物呼吸机(上海玉研科学仪器有限公司),小动物超声心动图机(加拿大VisualSonics Ve⁃vo 2100);可拍照光学显微镜(Olympus 公司)。
1.3 实验分组及给药
将60 只小鼠按随机数字法分为心肌梗死组(MI+PBS 组)、心肌梗死+间充质干细胞移植组(MI+MSCs 组)和心肌梗死+间充质干细胞移植+芪参益气滴组(MI+MSCs+QSYQ 组),每组20 只。BMSCs 移植组运用30 G 进样针抽取20 μL干细胞悬液,在心肌梗死小鼠模型梗死区取4 个点均匀注射5 μL 的BMSCs 细胞悬液,MI+PBS 组则在相同心肌区域注入等量的PBS。干细胞移植术后,将备置好的3.9 mg/mL 浓度的芪参益气滴丸药液按动物体表面积给予MI+MSCs+QSYQ 组小鼠相应剂量灌胃,另外两组按等量PBS 灌胃,每天1次,连续14 d。
1.4 制备小鼠心肌梗死模型
制备MI 模型前,小鼠需禁食12 h,不禁水,称重,以10% 水合氯醛腹腔注射充分麻醉,小鼠仰卧位固定于恒温动物解剖台上,剔除小鼠胸前毛发,充分消毒后颈正中纵向切开颈部皮肤,分离气管,行气管插管后予接入小动物呼吸机(频率110 bpm,吸呼比1∶1.2,潮气量1.8 mL),进行5%异氟烷气体麻醉,2%的浓度维持,连接心电监护及心电导联进行生命征监测。以左第4、5 肋骨为手术位置,打开胸腔,剪开心包膜,暴露心脏,用无菌6-0 丝线于左心耳下1~2 mm 处结扎冠状动脉前降支,以Ⅱ导联心电图J 点呈弓背抬高趋势,T 波出现异常,同时心肌颜色发绀等表现提示心肌缺血形成,同时说明MI动物模型制备成功。
1.5 BMSCs 的制备、培养和鉴定
采用全骨髓贴壁法联合密度梯度离心法进行骨髓干细胞的分离、培养。将8 只小鼠脱颈处死后,收集胫骨、腓骨中骨髓腔中的细胞,加入含有15%胎牛血清的完全培养液中培养,用2 mL 注射器吸取完全培养基,冲洗骨髓腔,收集冲洗液。混合均匀,进行离心,离心后重悬,转移至25 cm2培养瓶,同时在37℃、5%CO2细胞培养箱中培养,细胞密度为2.5×107cell/mL。多次反复换液,第14 天,每瓶细胞加入0.5 mL 0.25%胰酶进行消化,2 min 后加入1.5 mL 完全培养基进行中和,收集所有悬浮细胞,贴壁细胞弃去,收集的细胞再次离心重悬后,进行传代,传代比例为1∶1,第21 天时,收集所有悬浮细胞,获得BMSCs。接种至24 孔板,37℃、5%CO2环境下进行培养,24 h 后加入4%多聚甲醛4℃固定15 min,弃去固定液,PBS 清洗3 次,分别在每孔中加入anti-CD90.2、anti-CD45、anti-CD31、anti-CD117、an⁃ti-Ly6A 一抗(1∶100),室温、避光孵育30 min,PBS反复清洗3 次,加入荧光二抗,30 min 后加入DAPI工作液,10 min 后PBS 清洗3 次,用荧光显微镜仔细观察并拍照。
1.6 心功能检测
干细胞移植21 d 后,分别进行麻醉状态下彩色多普勒超声心动图检测各组小鼠心功能指标:左室舒张末内径(LVDd)、左室收缩末内径(LVSd),左室射血分数(LVEF)和左室缩短分数(LVFS)。采用Vevo2100 小动物彩色超声仪,切面选择心尖四腔心及二腔心切面、胸骨旁左室长轴切面,测定值取3 个连续心动周期平均值为标准,在M 超下测定以上参数。
1.7 免疫组化染色和微血管密度的测定
脱蜡,10 mmol/L pH 6.0 的柠檬酸盐缓冲液中使玻片维持在95~99 ℃10 min 加热,进行热抗原修复,冷切、孵育;每个切片上加稀释的一抗(anti-CD31 和anti-Ki67),4℃孵育过夜;滴加二抗,DAB显色,在显微镜下观察染色进展,一旦切片染色成功,立刻将玻片浸入水中终止显色、复染、冲洗、封闭。通过图像采集仪采集相片,应用Image Pro Plus 6.0(IPP 6.0)图像分析软件进行对阳性表达微血管面积所占选择区域面积的百分比计算。
1.8 统计学处理
应用SPSS 21.0 统计学软件对数据进行分析,计量资料以均数±标准差(±s)表示,组间比较采用t 检验,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 最终实验动物数量统计
无中途脱落实验动物,60 只小鼠均可纳入实验结果并分析。
2.2 心梗小鼠骨髓间充质干细胞的形态学观察及鉴定
在光学显微镜下观察骨髓间充质干细胞呈现形态大小不均一的类圆形,见图1A~D;72 h 后开始可见纺锤样贴壁细胞,仍杂有类圆形细胞,部分细胞呈集落生长;第7 天时,细胞生长良好,绝大部分为纺锤样贴壁细胞,明显呈集落生长,类圆形细胞极少;第14 天骨髓间充质干细胞生长越来越密集,虽然大部分仍呈纺锤样,但部分干细胞已呈现不规则多角形。通过免疫荧光染色,干细胞表面特异性标志物CD90.2 和Ly6A 呈高表达,CD31 和CD117几乎不表达。见图2A~D。

图1 骨髓间充质干细胞形态学观察与鉴定(荧光显微镜,×200)Fig 1 Morphological observation and identification of bone marrow mesenchymal stem cells(fluorescence microscope,× 200)
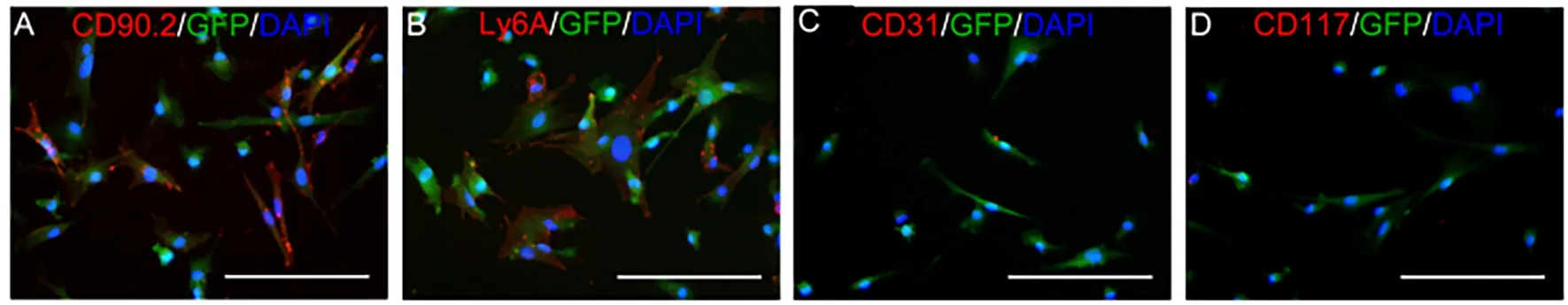
图2 骨髓间充质干细胞的免疫荧光染色图(免疫荧光染色,×200)Fig 2 Immunofluorescence staining map of bone marrow mesenchymal stem cells(immunofluorescence staining,× 200)
2.3 各组心脏超声诊断结果比较
细胞移植后第21 天,与MI+PBS 组比较,MI+MSCs 组和MI+MSCs+QSYQ 组的心功能指标LVDd、LVSd 均明显减小,LVEF、LVFS 均明显 升 高(P<0.05);与MI+MSCs 组 比 较,MI+MSCs+QSYQ 组LVEF 値增加,差异具有统计学意义(P<0.05)。见表1、图3。
表1 各组BMSCs 移植21 d 心功能指标的比较(n=20,±s)Tab 1 Comparison of cardiac function indexes in each group on the 21st day after BMSCs transplantation(n=20,±s)

表1 各组BMSCs 移植21 d 心功能指标的比较(n=20,±s)Tab 1 Comparison of cardiac function indexes in each group on the 21st day after BMSCs transplantation(n=20,±s)
注:与MI+PBS 组比较,*P<0.05;与MI+MSCs 组比较,#P<0.05。
组别LVFS(%)LVDd(mm)LVSd(mm)LVEF(%)MI+ PBS 组MI+ MSCs 组MI+MSCs+QSYQ 组4.66 ± 0.143.67 ± 0.1943.58 ± 3.4021.66 ± 1.89 4.36 ± 0.11*3.32 ± 0.11*47.92 ± 1.61*23.96 ± 0.96*4.08 ± 0.05*3.03 ± 0.06*52.12 ± 0.75*#26.93 ± 0.59*4.285<0.05 FP 18.061<0.05 21.204<0.05 1.973<0.05
2.4 各组梗死区域新生血管形成情况比较

图3 BMSCs 移植21 d 后检测LVDd、LVSd、LVEF、LVFS 表达的心脏超声图像Fig 3 Echocardiographic images of LVDd,LVSd,LVEF and LVFS expression detected 21 days after BMSCs transplantation
采用免疫组织化学染色,各组梗死区域微血管显示黄棕色,见图4。各组梗死区域微血管密度定量分析结果:MI+PBS 组梗死区的微血管密度为(10.13±0.26)%;MI+MSCs 组为(19.46±0.74)%;MI+MSCs+QSYQ 组 为(23.63±1.11)%。 与MI+PBS 组 相 比,MI+MSCs 组 和MI+MSCs+QSYQ 组微血管密度增加(见红色箭头处),差异有统计学意义(P<0.05),见表2。因此也说明移植MSCs 对心肌梗死区域周边血管的新生具有明显的促进作用。

图4 各组心肌梗死区域微血管形成情况(免疫组织化学染色,×400)Fig 4 Microangiogenesis in the infarcted area of each group(immunohistochemical staining,× 400)
表2 各组梗死区域微血管密度定量分析(±s)Tab 2 Quantitative analysis of microvessel density in infarct⁃ed area in each group(±s)

表2 各组梗死区域微血管密度定量分析(±s)Tab 2 Quantitative analysis of microvessel density in infarct⁃ed area in each group(±s)
注:与MI+PBS 组比较,*P<0.05。
组别MI+ PBS 组MI+MSCs 组MI+ MSCs + QSYQ 组微血管密度(%)10.13±0.26 19.46±0.74*23.63±1.11*15.082<0.05 FP
3 讨论
随着当前社会急救观念的加强,各省各院胸痛中心工作的高效运转,PCI 手术治疗以及再灌注时间的充分掌握,急性心梗患者死亡率显著降低,但心肌梗死后再灌注会进一步导致心肌细胞坏死并引发继发性炎症反应,使心肌中Ⅲ型与I 型胶原的比值增高,相应地心肌细胞弹性出现降低,甚至瘢痕形成,引起心室重构、心律失常和心功能下降,是心功能衰竭和恶性心律失常发生的主要原因,给家庭和社会带来巨大的精神压力和沉重的经济负担。Bergmann 等[7]发现人类左心室包含心肌细胞大约20~40 亿,正常成人心肌细胞平均每年仅更新1%,这仅能维持水平极低的日常代谢更新的需要,无法在心肌梗死后进行补充和修复,更不可能通过心肌细胞自身增殖或迁移而使得受损心肌细胞自愈[8]。所以,干细胞移植有促进心肌细胞再生作用,使受损或凋亡的心肌细胞、血管重新增殖分化,对有功能的心肌细胞进行补充,从而恢复心脏收缩功能,减轻AMI 后的心室结构重建,无疑是将来治疗心血管疾病的重要手段。
MSCs 是具有自我增殖、更新和多向分化能力的生物特性,可从脐带、牙髓、骨髓和脂肪组织等多种孤立的组织中获得,具有取材方便、易于分离培养、且具有免疫排斥性低等特点[9],已成为AMI 后再生治疗的热点种子细胞。有研究发现,移植的MSCs,通过自分泌[10]和旁分泌[11]作用方式,释放胰岛素样生长因子-1、血管内皮生长因子和白细胞介素-6 等各类生长因子和细胞因子,间接刺激内源性心脏祖细胞的迁移、增殖和分化,从而使基因表达上调以抑制心肌细胞凋亡,具有促炎[12]、组织修复[13]、促进心肌再生[14]和血管新生[15]等多种生物学作用。但是,在心肌梗死缺血缺氧的微环境条件下,经移植后的MSCs 存活率不乐观,随着当代对中医药的不断深入研究及探索,在干细胞增殖、分化微环境中传统中医药具有提高存活率、协同增效的作用,中西并重,共同发展,这也给干细胞移植治疗心肌梗死提供了新的研究思路。
本研究采用芪参益气滴丸为主要干预药物,为中药复方,主要组成是丹参、黄芪、三七、降香,具有人参皂苷Rg1、黄芪甲苷、丹参酮等主要活性化学成分。现代药理研究发现,黄芪甲苷具有扩冠、改善心肌微循环、清除氧自由基、改善心功能等作用[16];人参皂苷Rg1 有降低心肌耗氧、营养心肌的功效[17];丹参酮为丹参的主要成分,其在增强心肌收缩力、改善微循环等方面具有促进作用[18]。本研究团队在实验研究中亦发现芪参益气滴丸可以扩张冠状动脉、改善心肌能量代谢、抗血小板聚集,保护受损心肌的作用[19,20]。
本实验为获得较高纯度的BMSCs,采用全骨髓贴壁法联合密度梯度离心法进行干细胞对的分离和培养。实验发现,BMSCs 具有强大的自我更新和增殖能力,在干细胞移植72 h 内贴壁并成集落生长,且与培养时间延长成正相关。另外,本实验选择结扎冠状动脉前降支超急性期进行BMSCs 细胞移植,这一点更符合临床实际。本实验研究显示,经细胞移植组的心功能指标更优于模型对照组,并且在梗死区微血管密度定量分析中,骨髓间充质干细胞在毛细血管壁结构生成和微血管数量方面发挥重要作用,说明移植MSCs 能明显促进心肌梗死预期的血管新生情况,同时中药复方芪参益气滴丸能够很好地保护心肌,有利于弥补干细胞移植存活率低的不足。
综上所述,随着细胞治疗技术的发展,芪参益气滴丸联合骨髓间充质干细胞移植技术能使受损心脏组织修复、提高移植疗效,在心肌梗死小鼠血管新生和改善心功能方面起促进作用。该研究结果对临床推广BMSCs 移植治疗AMI 应用提供了实验佐证,但目前,如何更好地避免外源性细胞与宿主细胞的免疫排斥反应、BMSCs 转入机体后保持基因高表达及基因特异性的安全性、心肌细胞再生及转化的详细机制等问题,还需进一步研究。
