基因编辑技术研究进展与挑战*
2021-03-24陈云伟周海晨张志强
陈云伟 陶 诚 周海晨 张志强**,
(1.中国科学院成都文献情报中心科学计量与科技评价研究中心,成都610041;2.中国科学院大学经济与管理学院图书情报与档案管理系,北京100190;3.中国科学院发展规划局,北京100864;4.南京农业大学信息管理学院,南京210095)
基因编辑技术是指对基因进行靶向修饰(敲除、插入、替换等)而获得新的特征或功能的技术,自2012年CRISPR/Cas被用作基因编辑工具以来,基因编辑技术在全球范围呈现出蓬勃发展的态势。几年来研究人员不断对CRISPR/Cas系统进行优化和扩展,新技术、新成果、新应用层出不穷,并在生物技术产品开发、医疗、农业、能源、材料与环境等领域不断拓展应用,为人体细胞或组织及其他生命体的遗传改造提供了前所未有的有力工具,应用前景广阔。2020年10月7日,瑞典皇家科学院将2020年诺贝尔化学奖授予在基因编辑技术方面做出卓越贡献的法国科学家埃曼纽尔·卡彭蒂耶(Emmanuelle Charpentier)和美国科学家詹妮弗·杜德纳(Jennifer A.Doudna)。她们的成果从2012年率先发表到2020年获得诺奖,仅用了8年的时间,远低于过去诺贝尔科学奖平均20年左右的获奖时滞,凸显出基因编辑技术的重要价值、强劲的发展势头及应用前景,为一些复杂疾病的治疗提供潜力,为合成生物学提供工具;另一方面,这项技术仍然面临脱靶、免疫原性、副作用、生物选择性等不确定性所带来的风险,针对人体的基因编辑操作也带来了伦理道德与生物安全等争议。如何支持基因编辑技术的研发与应用并进行有效监管,是国际生命科学界面临的伦理挑战,也是摆在我国科技管理部门面前的一项重要任务。
本文重点梳理基因编辑技术的关键进展,结合文献计量分析,揭示研发格局,并着重对国内外代表性科研机构进行比较,以期为我国出台促进基因编辑这一重要技术的发展政策和举措提供参考借鉴。
1 CRISPR技术掀起基因编辑研发热潮
1.1 新研究进展层出不穷
截至2020年10月,基因编辑技术可分为三代:第一代是“锌指核酸酶”技术(ZFNs)[1,2];第二代是“类转录激活因子效应物核酸酶”(TALENs);第三代是 CRISPR/Cas系统,始于2012年两位诺奖得主的工作[3]。此外,2016年的单碱基基因编辑技术(Base Editor,BE,有研究组将其称为3.5代或第四代基因编辑技术)和2019年引导编辑技术(Prime Editors,PE)的问世更是将基因编辑技术推向了新高潮。
以Web of Science中SCI-EXPANDED数据库作为数据源,共检索到1985—2019年全球有关基因编辑技术的 WOS论文30168篇,其中大部分论文发表于2012年以后(图1);2016—2019年间2万篇,占过去全部论文总数近70%。数据采集时间为2020年6月。基于文献[4]并适当完善确定检索策略:TS=(((Genome OR Gene OR Genetic OR DNA OR RNA)NEAR/2 Editing)OR "base editing" OR Meganuclease*OR "Homing Endonuclease*" OR "Zinc Finger Nuclease*" OR ZFN*OR(Transcription*Activator*Like Effector Nuclease*)OR((Genome OR Gene OR Genetic OR DNA OR RNA)AND(TALEN*OR(TALE*AND "Transcription Activator*")))OR "Clustered Regularly Interspaced Short Palindromic Repeat*" OR CRISPR*)AND PY=1985-2019。数据清洗和统计分析工具:使用Tableau 2019软件开展论文统计分析、利用VOSviewer1.6对科研机构进行合作网络分析。

图1 基因编辑SCI论文数年度发展趋势Fig.1 Trends in Gene Editing SCIPapers
2012年以后,绝大多数基因编辑论文都是基于 CRISPR/Cas9系统的研究成果(图 2)。CRISPR/Cas9最早在2012年开始被两位诺奖得主率先用作基因编辑系统[3],该论文在WOS平台截至2020年10月12日已被引用5555次。2013年被成功用于哺乳动物真核细胞后,由于大大简化了基因编辑操作,从此正式开启了基因编辑的研发热潮,代表性的工作来自麻省理工学院张锋[5]、哈佛大学 George Church[6]等团队。2013年,中科院遗传与发育所高彩霞团队率先利用基因编辑系统CRISPR/Cas对水稻和小麦的多个基因进行编辑,并且获得了世界上第一株CRISPR编辑的植物[7]。
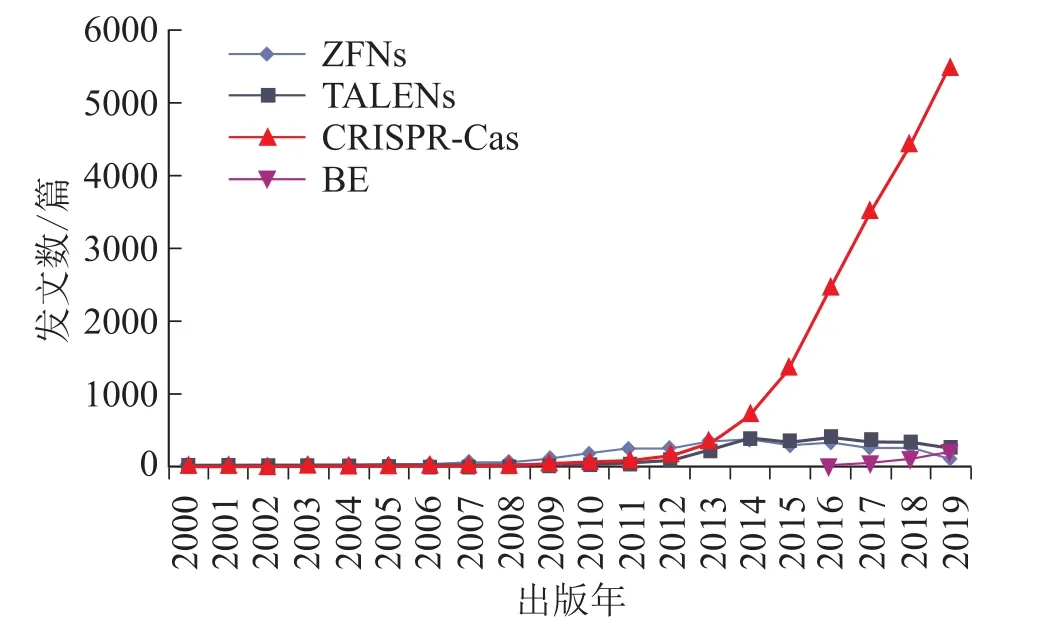
图2 基因编辑技术论文数量发展趋势图Fig.2 Trends in Gene Editing Technology Papers
与此同时,CRISPR/Cas的新系统不断被发掘,基因编辑技术也在不断改进和衍化,具有代表性的改进包括:张锋团队在2015年提出CRISPR/Cas12a系统,其优点在于体积小、基因插入和替代更容易,脱靶率更低[8]。但是CRISPR/Cas12a对温度有更为苛刻的要求,低温条件下效率下降。中科院动物研究所李伟团队在2018年率先发现了 CRISPR/Cas12b[9],张锋团队也在2019年发布了相关研究成果[10],其特点是显著提高靶向范围,极大地降低了脱靶效应,尺寸更小,稳定性和特异性更高,更适用于临床基因治疗。
哈佛大学David R.Liu研究组在2016年率先提出单碱基基因编辑技术BE3[11],其不引起双链DNA断裂,也是建立在CRISPR/Cas系统基础之上一种基于脱氨酶与CRISPR/Cas9系统融合的技术。他们直接将胞嘧啶C转变为尿嘧啶U,再通过DNA复制实现胞嘧啶C到胸腺嘧啶T或鸟嘌呤G到腺嘌呤A的转换,属于胞嘧啶碱基编辑技术CBE。该团队2017年又实现了A·T到G·C的转换,即腺嘌呤碱基编辑技术ABE,提升了编辑效率,用于纠正与疾病相关的点突变,可为治疗多种遗传疾病提供编辑工具[12]。除了David R.Liu研究组,开展单碱基基因编辑系统研究的代表性研究工作还包括:日本神户大学Akihiko Kondo课题组[13]2016年开发了 dCas9-PmCDA1-UGI和Cas9n-PmCDA1-UGI系统;上海交通大学的常兴课题组2016年[14]开发了dCas9-AIDx碱基编辑系统并用于肿瘤疾病治疗研究;韩国首尔国立大学Jin-Soo Kim课题组在2019年发现ABE还可在特定编辑窗口和序列中将胞嘧啶转换为鸟嘌呤或胸腺嘧啶,可用于特定的胞嘧啶编辑[15];David R.Liu研究组在2019年对CBE加以改进,提出了一种称为BE-PACE的技术,可用于高效开发碱基编辑器[16]。中科院脑智卓越中心杨辉团队与高彩霞团队在2019年3月各发表研究论文,首次发现单碱基编辑系统存在严重脱靶效应[17,18]。2020年高彩霞团队开发出新型高精度、高编辑活性的胞嘧啶碱基编辑工具,为基因治疗和植物分子设计育种提供了强有力的工具支撑[19]。
与此同时,新技术也不断涌现。哈佛大学David Liu团队在2019年10月开发出了全新的精准基因编辑工具——引导编辑技术PE,无需额外的DNA模板便可有效实现所有12种单碱基的自由转换,而且还能有效实现多碱基的精准插入与删除,为在植物中进行碱基自由编辑提供了新的方向和思路[20]。国内多个团队围绕引导编辑技术开展了优化研究,例如,高彩霞团队在2020年5月开发出用于水稻和小麦的植物基因组引导编辑技术[21],在植物育种和功能基因组学研究方面具有重大潜力。
2020年David Liu团队又进一步开发出了线粒体基因编辑技术,能够对与疾病相关的线粒体DNA突变进行建模,从而更好地理解与癌症、衰老等相关的基因变化[22]。
最近几年,RNA编辑技术也获得了高度关注。RNA编辑系统的最大优势在于其不会改变DNA信息,减少了遗传安全和伦理问题,安全性更高,通过修复RNA来阻断DNA的错误信息的表达,而且具备在所有细胞中修复蛋白质功能的潜力,将为基础研究和临床治疗提供一个新的工具,为治疗多种疾病提供了可能。张锋团队先后在 2016年[23]、2017年[24]和 2018年[25]发现了RNA编辑技术,依次命名为 Cas13a、Cas13b、Cas13c和Cas13d。目前有关RNA编辑技术的研究相对较少。
综合分析可以发现,基因编辑技术的进步主要体现在:1)效率提高;2)靶向性增强;3)对细胞的扰动降低。在可以预见的未来,基因编辑技术仍将在这三个方向上进一步优化和发展。此外,随着基因编辑技术的不断进步,以及其与合成生物学、蛋白质机器等领域的研究成果的结合有望可以实现基因组的高通量、自动化编辑。
1.2 应用前景广阔
基因编辑技术已展现出巨大的应用潜力,包括:生物技术产品研发与科研服务,疾病筛查、诊断、药物研发等,农业作物育种,能源与材料开发、环境等领域。其中最引人关注的应用是用于癌症、心血管疾病、遗传性疾病等的治疗。
1.2.1 疾病治疗
从技术手段角度,基因编辑技术用于疾病治疗的手段包括编辑胚胎、编辑干细胞和编辑成体细胞。早在2013年,中科院原上海生科院李劲松团队就利用CRISPR/Cas9技术在小鼠受精卵中纠正了小鼠白内障显性基因突变[26],完成了遗传疾病的校正性治疗实验研究。中山大学黄军就团队在2015年首次成功修改人类胚胎的DNA,为治疗地中海贫血症这一遗传疾病提供了可能[27]。干细胞基因编辑通常是将病人的干细胞在体外编辑后再输回病人体内,进而用于治疗如β珠蛋白生成障碍性贫血[28]等疾病。体细胞编辑也可用于治疗特定疾病,如酪氨酸血症[29]、乙肝[30]等。
从动物模型角度,目前用于人类疾病研究的基因编辑动物模型主要有小鼠、大鼠为代表的啮齿类动物模型,以猪为代表的大动物模型[31],以及食蟹猴、猕猴等灵长类动物模型。2018年,暨南大学李晓江团队、中科院广州生物医药与健康研究院赖良学团队和美国埃默里大学李世华团队等联合首次利用CRISPR/Cas9基因编辑技术培育出世界首例亨廷顿舞蹈病基因敲入猪,作为准确模拟神经退行性疾病的动物模型[32]。2018年,中科院脑科学与智能技术卓越创新中心杨辉团队和孙强团队[33]、昆明理工大学季维智院士团队、上海科技大学黄行许团队与南京医科大学郭雪江团队[34],同时报道了世界上首次获得的基因敲入的食蟹猴。
从疾病类型角度,当前基因编辑技术在疾病诊疗中的应用主要包括癌症、心血管疾病(如冠状动脉疾病[35])、遗传性疾病(如血友病[36,37])、神经退行性疾病[32]、艾滋病和白血病[38]、染色体疾病(如唐氏综合征[39,40])等的治疗。癌症治疗是基因编辑技术在疾病治疗领域的首要应用对象,主要构建用于癌基因、药物靶标和肿瘤抗性临床前验证的疾病模型[41]。例如,张锋团队早在2014年就成功利用CRISPR/Cas9技术构建了模拟癌症突变的小鼠模型[42];2016年,四川大学华西医院卢铀团队正式启动了全球首例用于人体的基因编辑技术试验,用于治疗肺癌[43],2020年4月公布的研究结果显示CRISPR-Cas9基因编辑的T细胞的临床应用通常安全、可行[44]。宾夕法尼亚大学Stadtmauer等2020年首次在人类I期临床试验中通过测试3名难治性癌症患者进行初步试验表明,使用CRISPR-Cas9进行多重人类基因组工程改造T细胞是安全可行的,对Cas9的预先存在的免疫反应似乎并未为实施这一有前途的技术带来障碍,通过对人类T细胞进行高效的DNA修饰,为增强癌症治疗效果带来了巨大的希望[45]。美国麻省理工Broad研究所和哈佛大学将CRISPR/Cas9和CRISPR/Cas12a靶向特定心血管靶点的技术许可给Verve Therapeutics公司,该公司将利用基因编辑技术开发降低患冠状动脉疾病风险的创新疗法[35]。日本自治医科大学Ohmori等在2017年利用CRISPR/Cas9基因编辑技术成功治疗了实验鼠的血友病[38]。2019年,北京大学-清华大学生命科学联合中心邓宏魁团队、解放军总医院第五医学中心陈虎团队及首都医科大学附属北京佑安医院吴昊团队合作首次利用CRISPR/Cas9技术对人造血干细胞进行基因编辑,并在动物模型中实现重建造血系统,产生了抵御艾滋病和白血病的能力[38]。利用基因编辑技术有望从染色体水平上使异常的三倍体细胞(21号染色体)恢复至正常的二倍体细胞,进而实现治疗唐氏综合征[39]。2017年,杨辉团队和北京大学-清华大学生命科学联合中心胡家志团队通过CRISPR/Cas9-SgRNA靶向染色体上的重复序列对小鼠胚胎进行染色体编辑,成功将染色体删除[40],该研究为删除唐氏综合征患者多余的1条21号染色体提供了可能,不过还需要解决靶向特异性的问题。
需要指出的是,基因编辑技术在疾病治疗领域虽然开展的研究最多,但大部分工作尚处于动物实验阶段,受限于基因编辑技术本身还待解决的脱靶、安全性等关键问题,疾病治疗临床研究还在初期阶段。
1.2.2 作物育种
基因编辑技术已经用于小麦、水稻、玉米、大豆、拟南芥、西红柿、烟草、马铃薯的基因功能和性状改良等育种研究中,其优势在于可筛选优势性状、设计和改造品种、提高产量和品质等[46,47]。重要进展主要有水稻无融合生殖、单倍体育种、抗白粉病小麦等等。例如,高彩霞团队利用基因编辑技术首次在六倍体小麦中对MLO基因的3个拷贝同时制造突变,使小麦对白粉病具有了广谱抗性[48],该成果入选《麻省理工科技评论》2016年十大技术突破;中国水稻研究所王克剑团队在2019年利用基因编辑技术在杂交水稻中建立了水稻无融合生殖体系,得到了杂交稻的克隆种子[49]等;美国密苏里大学和德国马普植物育种研究所的两个课题组同期通过修饰水稻中多个Os-SWEET基因启动子培育了广谱抗白叶枯病水稻[50-52];中国水稻研究所钱前团队在2020年利用CRISPR/Cas9技术创制出茎秆变粗而且抗折力增强的水稻新种质[53]。美国明尼苏达学和西班牙国家研究理事会可持续农业研究所(IAS-CSIC)的科学家利用CRISPR/Cas9技术抑制小麦醇溶蛋白的表达,培育出了非转基因的低麸小麦[54];美国科迪华农业技术公司2020年宣布利用CRISPR/Cas9技术创制出高产糯玉米品种,且已经过三年田间试验验证了产量的提升[55];中科院遗传与发育生物学研究所高彩霞团队和许操团队合作在2018年利用CRISPR/Cas9技术对天然耐盐碱和抗细菌疮痂病的野生番茄进行了人工驯化,在保留其对盐碱和疮痂病天然抗性的前提下,将产量和品质性状精准地导入了野生番茄[56]。这些研究表明,基因编辑技术在保障和改良禾谷类粮食作物产量品质中具有重大的应用前景。
1.2.3 工业微生物设计
基因编辑技术为工业微生物的改造与模式微生物设计提供了高效的工具,为生物燃料、化学品、新材料、医药产品、环境修复微生物等研发提供了新的选择。2015年,丹麦技术大学Jochen Forster团队就利用CRISPR/Cas9技术对单倍体酵母菌株和二倍体酵母菌株两类重要工业酵母的基因完成了高效编辑[57];加州大学伯克利分校Keasling团队在2018年利用CRISPR/Cas9技术对酿酒酵母进行改造,使用改造后的酿酒酵母生产的啤酒酒花风味更浓烈[58]。中科院微生物研究所温廷益团队在2018年发展了一种CRISPR/Cas9辅助多重基因组编辑方法,包括多重基因敲除、多位点和多拷贝整合方法,为酵母的基因工程和合成生物学研究提供了一个有效的工具[59]。
1.2.4 病毒核酸检测
2018年,科学家首次证明了基于CRISPR的基因编辑技术在病毒核酸检测方面的重大应用潜力,两项代表性工作都来自麻省理工学院张锋团队,一项是利用CRISPR/Cas12a系统可以准确地识别人源样本中不同类型的HPV病毒[60];一项是利用基于CRISPR/Cas13a的SHERLOCK系统检测人源样本中的寨卡病毒,登革热病毒以及其他有害细菌[61]。在2020年该团队又开发出了利用基于CRISPR/Cas13的SHERLOCK系统快速检测新型冠状病毒。
除上面归纳的主要新应用外,随着基因编辑研究的爆发式发展,新应用也不断拓展。例如,哈佛大学医学院Pier Paolo Pandolfi团队在2020年利用CRISPR/Cas13d基因编辑技术清除新型冠状病毒且可以有效应对病毒可能出现的变异,具备治疗和预防包括新冠肺炎在内的多种RNA病毒感染疾病的潜力[62]。加州大学圣地亚哥分校Omar Akbari团队通过利用CRISPR基因编辑技术精确地同时破坏果蝇模型雌性生存能力和雄性繁殖能力关键基因,进而实现精确遗传控制害虫的目标[63]。中科院上海分子植物科学卓越创新中心谭安江团队借助基因编辑技术用基因定点替换的方法在家蚕丝腺和蚕茧中大量表达蜘蛛丝蛋白[64]。
2 全球基因编辑研发格局
从国家/地区发文量(图3)以及主要国家/地区间的合作网络(图4)来看,中美两国在基因编辑领域保持最紧密的合作,处于全球引领地位。美国的基因编辑论文数量遥遥领先,占全球发文总量的46.7%,且处于合作网络的中心;中国发表了超过5000篇论文,排名第二,与英国、德国、日本、澳大利亚等国家具有较多合作关系。排名3~7位的是德国、日本、英国、法国、加拿大,论文数量均在1000篇以上。
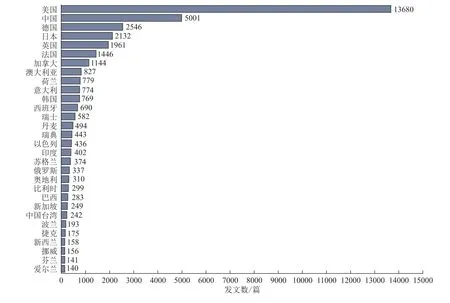
图3 基因编辑SCI发文数前30国家/地区Fig.3 Number of Gene Editing SCIPapers in the Top 30 Countries or Regions

图4 基因编辑SCI发文数前20国家或地区合作网络(合作频次≥10)Fig.4 Collaboration Network of the Top20 Countries or Regions for Gene Editing SCI Papers(Frequency≥10)
3 代表性机构竞争力比较
在论文数最多的前10机构中,美国6家,分别是哈佛大学、霍华德休斯医学研究所、麻省理工学院、美国国立卫生研究院、斯坦福大学、加州大学伯克利分校;法国2家;中国、德国各1家。其中,哈佛大学以1417篇论文数位居全球第一,中国科学院以1077篇位列全球第二(表1)。

表1 基因编辑SCI论文数前10机构Tab.1 Top 10 Institutions for Number of Gene Editing SCIPapers
综合考虑机构发文量与机构所属国家/地区,本文选取哈佛大学、中国科学院、法国国家科学研究中心以及德国赫姆霍兹联合会(简称四机构)进行比较研究,观察各机构在发展态势、研究影响力、科研合作关系、基金来源、研究主题等方面的异同。
3.1 发展态势
四机构发展趋势(图5)与总体发文趋势(图1)一致,但在发文量与增长速度方面不尽相同。在2012年以前的前两代基因编辑技术研发期间,法国国家科学研究中心贡献了超过47%的研究成果。随着第三代基因编辑技术研究进入爆发阶段(2013—2019年),哈佛大学(163篇/年)与中国科学院(125篇/年)后来居上,且领先优势愈发突出。德国赫姆霍兹联合会则长期处于缓慢增长阶段,与其余三机构尚有较大差距。中国科学院的论文总量与哈佛大学仍存在差距,但近几年增势强劲,差距不断缩小。

图5 四机构年度发文数发展趋势Fig.5 Trends in the Numbers of Publications from Four Research Institutions
3.2 科研影响力
在各被引频次区间(图6),哈佛大学均具有明显优势,高被引区间(100~200、200以上)发文数是其余机构的2.65~16倍。George Church、David R.Liu等领军学者都来自哈佛大学。与哈佛大学相比,中国科学院在高被引频次区间(被引频次100次以上)的论文相对比较少,但在各被引频次区间的论文数均高于法国国家科学研究中心和德国赫姆霍兹联合会。

图6 四机构SCI论文被引频次分布Fig.6 Citation Frequency Distribution of SCI Papers from Four Research Institutions
哈佛大学在发文数第一的情况下仍然保持了最高的论文篇均被引频次与H指数(表2);中国科学院H指数与发文数排名一致(排名第二),但篇均被引频次为四机构中最低水平。同时,四机构均拥有高被引论文(引用数领域前1%),但只有哈佛大学与中国科学院拥有热点论文(近两年引用数领域前0.1%)。数据表明,中国科学院与哈佛大学在基因编辑研究领域的论文质量在世界范围内处于较高水平,具有较高学术影响力,在行业内优势比较突出,优于其他2个科研机构。但中科院与哈佛大学的学术影响力相比仍有差距,具体表现为论文质量参差不齐,高被引论文较少且整体被引频次偏低。
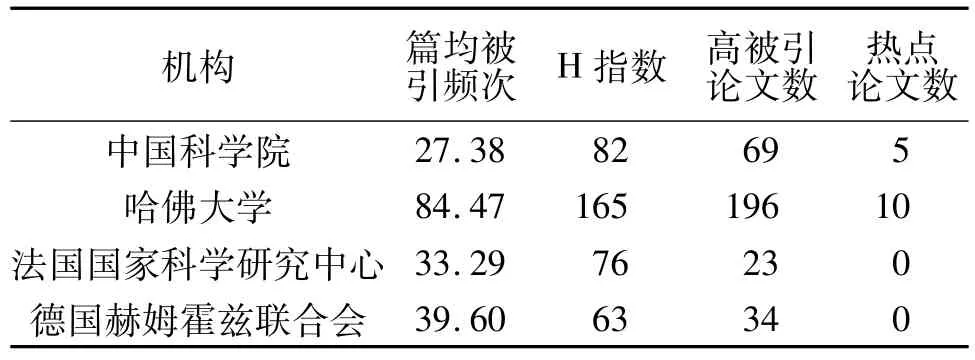
表2 四机构篇均被引次数与H指数对比Tab.2 The Number of Average Citations and the H-index from Four Research Institutions
3.3 研究主题
通过基于关键词的论文研究主题抽取分析发现(图7),各机构研究范围都十分广泛,且高度重合,其中热点词汇反映了以下几个主题:基因编辑采用的主流技术(CRISPR/Cas9、锌指核酸酶、核酸酶等),基因工程包含的主要内容(基因敲除、双链断裂、同源重组、修复等),实验涉及的对象及物质(老鼠、斑马鱼、DNA、RNA)以及特定研究主题(特异性免疫、基因表达等)。

图7 四机构的科研主题分析Fig.7 Analysis of Research Subjects from Four Research Institutions
3.4 国际资助
比较四机构的主要资助来源(表3)发现,各机构的基金资助主要都来自于本国,体现出各国对基因编辑研究的重视程度。同时,在欧美国家跨国资助更为频繁,如法国国家科学研究中心的第三大资助机构为美国国立卫生研究院,德国赫姆霍兹联合会的第三大资助机构为欧洲研究理事会。
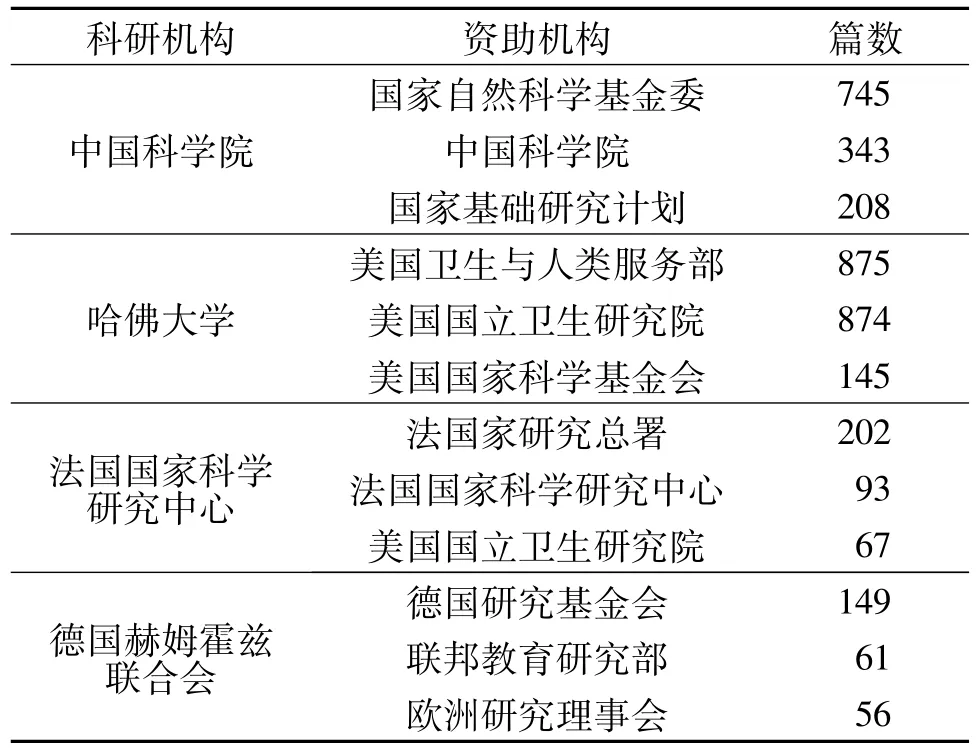
表3 四机构的前3资助机构统计Tab.3 Statistics of the Top 3 Funding Agencies from Four Research Institutes
4 讨论与展望
4.1 问题与争议
基因编辑技术的临床前验证研究多是在动物模型进行基因治疗,真正用于临床治疗还需要克服脱靶、效率和安全性等问题。这些亟待解决的问题也为基因编辑技术的发展带来了诸多争议。
1)脱靶问题。脱靶问题成为限制基因编辑技术走向临床应用的最大瓶颈。任何一个基因的变化,哪怕仅仅是一个碱基的改变,都可能带来功能的变异或导致疾病。因此,开发安全高效的基因编辑工具仍然是该领域的研究重点。
2)伦理问题。基因编辑技术在为人类各种疑难和重大疾病治疗带来潜在的革命性影响的同时,也蕴含着威胁人类基因谱系安全与侵犯个人权利的伦理风险。如果基因编辑技术将人的遗传物质进行了永久性的改变,在当前的科学认知情况下,尚无法判断将来对人类后代产生的潜在影响。
3)基因污染。随着基因编辑技术的不断进步,其应用领域将不可避免地由修复突变基因向增强原有基因功能扩展。这样的新基因引入在整个生物界的扩散速度如何控制及其对于整个生物界的影响是难以评估的也是难以控制的。
4)物种保护。对动物的基因编辑操作,有可能导致动物进化方向发生永久性的不可逆转折。主张者支持通过基因编辑技术再造已经灭绝的动物,或保护濒危动物;而反对者则担心操纵自然可能会带来更多的伤害,可能会创造出威胁人类生存的“新”物种。
5)生物安全。基因编辑技术很容易被掌握生物技术专业知识的生物黑客非法利用,在缺乏严格监管的情况下,会带来极大的生物安全风险。基因编辑技术还存在被恶性用于编辑各类病原菌从而人工创造出危害性未知的生物武器,对人类社会带来极大的安全挑战。
4.2 发展展望
尽管基因编辑技术的发展还面临上述风险与争议,但其在疾病治疗、作物育种、工业微生物设计等领域展现出的巨大应用潜力和实用价值仍引起极大关注。2020年诺贝尔化学奖的颁发,也是对基因编辑技术重要价值的肯定。国际上的普遍态度是在相关监管规范和法规的约束前提下谨慎开展相关基础研究与应用研发工作,既要持续地支持基因编辑技术研发,促进技术进步和优化,也要进行严格有效监管,保护该技术的发展。
以下提出我国大力支持基因编辑技术发展的几点建议。
1)强化规划引领,高度重视加强基因编辑基础理论与方法研究。基因编辑技术是生命科学领域的颠覆性技术方向,技术本身还需在准确率等方面不断改进和完善。唯有加强基因编辑技术前沿方向研究,占领技术制高点,才能为国家生物安全、人口安全保障提供基础保障。要重点开发新的基因编辑工具,克服脱靶、效率、免疫原性和安全性等问题,排除导致细胞和组织病变、癌变等潜在风险。
虽然基因编辑技术原创不在我国,但我国在该技术的优化以及应用上走在全球前列。我国在基因编辑研究方面与国际同行几乎共同起跑,当前在研究成果与影响力方面总体处于并跑和局部领跑地位,涌现出了多个国际顶尖团队和多项国际领先成果,如:首株基因编辑植物,率先发现单碱基编辑系统脱靶现象,首次开展白内障、亨廷顿舞蹈病等基因编辑研究,以及抗白粉病小麦、基因编辑猴等等。我国已经具备了在基因编辑相关应用领域突破重大科技前沿问题、抢占全球竞争引领地位的基础和实力,务必及时、定向向重点团队加大支持力度。
2)强化规范监管,科学引导重视基因编辑应用。基因编辑技术在应用方面,尤其是在医学应用方面,现在还处于初期阶段,未来应用潜力与潜在价值尚无法估量。不过可以预见的是,随着人们对生命基础知识认识的不断加深、基因编辑技术本身的不断改进、以及监管框架的日益完善,基因编辑技术或将对生物医药、疾病诊疗、作物育种、生物制造等广泛领域带来革命性的影响。我国在基因编辑技术的优化以及应用、特别是在植物基因组编辑领域已走在世界前列,在动物及医学方面也有很多工作走在世界最前沿。建议我国在不断规范监管体系的情况下,要加大对基因编辑领域应用研究的引导和支持力度,应对未来基因编辑技术在生物经济社会中广泛应用及关键支撑作用,占领未来相关生物医药科技产业制高点,摆脱核心生物医药技术、疗法和药物受制于人的局面,支撑科技强国建设。
对基因编辑技术的监管应当与对人类遗传资源的管理(如:《中华人民共和国人类遗传资源管理条例》)密切衔接,尤其应当禁止我国人类遗传资源通过不同渠道流入境外;对基因编辑技术的监管还应当与对病原微生物相关遗传信息的管理结合起来,尤其应当禁止病原微生物相关遗传信息的不当扩散。
3)强化伦理规范研究,完善基因编辑监管法律政策体系。新技术发展的颠覆性要求科技治理体系和治理能力现代化。建议我国需要全面审视生物科技安全治理状况,加强生物安全立法研究,完善生物安全管控机制,明确支持研究边界框架下的基因编辑基础研究与应用研究,确保生物安全和科技创新之间的适度平衡。加强基因编辑技术发展有关监管与立法,规范基因编辑技术应用的伦理行为。对我国而言,特别需要重视对众多科研团队的监管,支持在符合当前政策和法律的前提下开展相关应用研究,避免产生生物安全和伦理事件及重大舆情,以免给我国基因编辑研究带来负面影响,阻碍向世界科技前沿迈进的步伐。
4)大力支持作物基因编辑产品研发。首先,动物基因编辑存在基因脱靶风险,但是脱靶效应并不是基因编辑作物的障碍。植物研究的一大特点在于其最终使用的是后代材料,意味着即使当代有脱靶,在数量充足的后代分离中可以把脱靶位点分离出去,找到没有脱靶的材料。从这个角度讲,“脱靶”并不是那么重要,有时候甚至有研究需要利用“脱靶”这一特点获得更多的突变体。其次,与转基因作物相比,基因编辑作物并没有导入外源抗性基因,具有更高的生物安全性。基因编辑作物多数情况下是模拟一些天然突变体,如因一个基因发生突变带来的东北大米稻花香,研究人员可以在其他水稻品种里模拟这个天然突变,把相同的基因定点敲除,而且完全不留下任何外源基因,和天然突变体情况一样。因此,基因编辑技术将可能比转基因技术走得更远,对于植物、农作物、畜牧业产品,也可能进行相当的改造,会产生很大的经济价值。目前亟需制定相关政策,许可一些基因编辑作物的设计。第三,我国在植物基因编辑研究走在世界前列,超过一半的专利及文章来自我国。全国约有20个专门从事作物基因编辑研究团队,最近几年涌现出大量国际前沿成果。特别是中国科学院等机构拥有从事作物基因编辑研究的国际领先团队,在某些方面也取得了国际领先或引领性成果。例如,第一株基因编辑植物、抗白粉病小麦等。我国已经具备了在作物基因编辑领域占据世界领先地位、引领创新前沿方向的基础和条件,亟需进一步加大经费支持力度,配套更加积极主动的政策。
致谢本文撰写过程中得到高彩霞(中国科学院遗传与发育生物学研究所)、王佳伟(中国科学院分子植物科学卓越创新中心)、许璟(中国科学院分子植物科学卓越创新中心)、郑辉(中国科学院广州生物医药与健康研究院)、赖良学(中国科学院广州生物医药与健康研究院)等专家的指导,特此致谢。
