基于适体修饰的金纳米粒子分光光度法测定牛奶中妥布霉素的残留量
2021-03-24周化岚梁营芳施沁怡
王 燕,周化岚,梁营芳,王 锋,施沁怡
(上海理工大学医疗器械与食品学院,上海 200093)
妥布霉素是一种氨基糖苷类抗生素,主要用于治疗人和兽的细菌感染,妥布霉素过量使用会对人体造成严重的不可逆副作用,如肾毒性、神经肌肉阻滞和超敏反应等[1]。由于妥布霉素价格较低,目前其已经被广泛用于畜牧业,这极大导致了牛奶、鸡蛋和肉类等动物源性食品中可能的潜在抗生素残留。食品中抗生素残留量测定主要依靠仪器分析法,如薄层色谱法、气相色谱法、离子色谱法和高效液相色谱法以及色谱-质谱法等[2],然而这些方法存在样品前处理复杂、耗时、需要训练有素的技术人员等缺点,难以实现快速、简捷、高通量及现场测定,靠实验室测定方法很难及时、快速而全面地从源头监控食品安全状况[3]。
适体主要是寡核苷酸,即单链脱氧核糖核酸(DNA)或核糖核酸(RNA),其具有合成简单、标记容易、稳定性好、适用性广等优点[4]。由于寡核苷酸与目标分子的高度亲和力和特异性,其被广泛用于分子识别,成为食品分析、疾病诊断、新药筛选等领域非常有前途的识别探针[5-6]。
金纳米粒子(Au NPs)由于具有较好的稳定性、良好的生物相容性和独特的光学性质,在免疫分析、生物学标记及测定技术中得到了广泛的应用[7],目前以金纳米粒子为载体的测定平台主要有光度法、荧光法、光谱法和电化学法[8]。
本工作以适体修饰的Au NPs为测定手段,开发一种简单、快速的测定妥布霉素的比色传感器,希望为相关部门提供一种便捷的抗生素现场测定工具,以提高食品安全水平。
1 试验部分
1.1 仪器与试剂
UV-1200 型紫外-可见分光光度计;TU-1901型双光束紫外-可见分光光度计;81-2型恒温磁力搅拌器;XW-80A 型微型涡旋混合器;Sigmal-14型高速离心机;Spinplus-6 型低速离心机;PHS-3C 型p H 计;JEOL JEM-2100F型透射电子显微镜。
妥布霉素标准储备溶液:0.1 mmol·L-1,以水为溶剂。
妥布霉素标准溶液:1 000 nmol·L-1,移取适量的0.1 mmol·L-1妥布霉素标准储备溶液用水稀释而成,使用时用水稀释至所需浓度。
适体Hp:AAAAAAGACTAGGCACTAGTCAAAAAACCCCGATCCTAGT CTTTCCC[9]。
盐酸、硝酸、氯金酸、柠檬酸钠、氯化钠、三氯乙酸、妥布霉素、链霉素、四环素、氟苯尼考均为分析纯;牛血清白蛋白为分子生物级;试验用水为纯水。
1.2 测定妥布霉素的原理
Au NPs比色传感器主要依赖于纳米粒子间距离相关的表面等离子体共振,Au NPs在溶液中的不同状态将表现出不同的颜色[10]。溶液中分散良好的Au NPs在波长约520 nm 处具有最大吸收,呈红色;当Au NPs聚集时,表面等离子体带从可见区域向近红外区域移动,溶液颜色由红色变为蓝色。比色传感器测定妥布霉素(TOB)的原理图见图1。
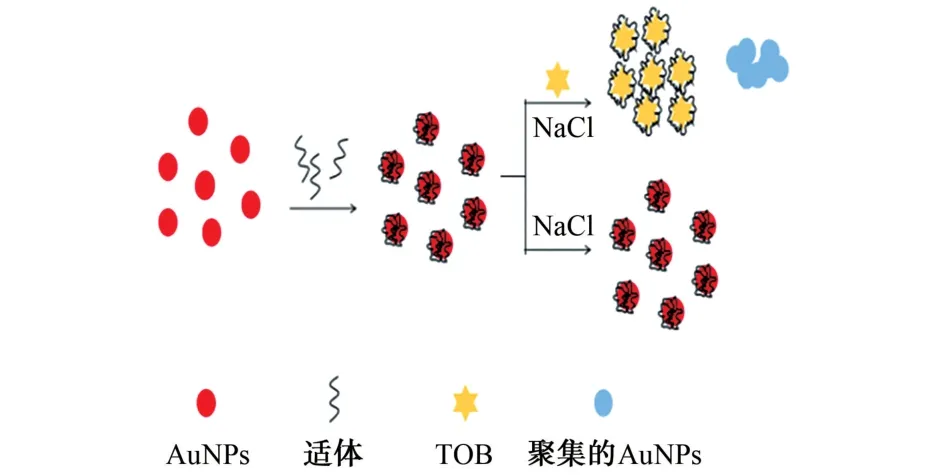
图1 比色传感器测定妥布霉素的原理图Fig.1 Schematic diagram of TOB determination by colorimetric sensor
无规则卷曲的单链DNA 适体可以通过碱基的氮或氧与Au NPs之间的电荷吸引力、范德华力以及疏水相互作用吸附在Au NPs表面[11]。DNA 和Au NPs之间的静电排斥增强了Au NPs抗盐诱导聚集的稳定性,使得溶液在一定含量的盐中保持红色。因此,试验采用一种基于单链DNA 适体修饰的Au NPs测定妥布霉素。在没有妥布霉素的情况下,适体吸附在Au NPs表面,在适当含量的盐中保持Au NPs在溶液中均匀分布;而在妥布霉素的存在下,由于妥布霉素和适体之间的高度亲和性,妥布霉素与适体结合,适体的构象从卷曲结构转变为折叠刚性结构并从Au NPs表面脱离,使得Au NPs表面裸露在高盐环境中从而发生聚集,并导致溶液发生从红色到蓝紫色的颜色变化。
1.3 试验方法
1.3.1 Au NPs的制备
将玻璃器皿用盐酸与硝酸以体积比3∶1组成的混合液浸泡24 h,再用水浸泡1 h后,洗涤烘干。采用Frens法通过柠檬酸钠还原氯金酸反应制备直径约为13 nm 的Au NPs[12]。移取100 mL 的1 mmol·L-1氯金酸溶液,在剧烈搅拌下加热回流,沸腾后迅速加入10 mL的38.8 mmol·L-1柠檬酸钠溶液,在5 min内混合液颜色从淡黄色变为黑色,最后变为酒红色,继续回流15 min后,在搅拌下缓慢冷却至室温,即得到Au NPs溶液,于4 ℃保存。
1.3.2 Au NPs的表征
利用紫外-可见分光光度计测量Au NPs溶液的吸收光谱。将1 mL 制得的Au NPs溶液稀释3倍后置于光程为1 cm 的比色皿中进行紫外吸收扫描,根据朗伯-比尔定律,即公式(1)计算Au NPs 的浓度:

式中:A为吸光度;ε为摩尔吸光系数,L·mol-1·cm-1;b为光程,1 cm;c为Au NPs的浓度,mol·L-1。直径约为13 nm 的Au NPs在波长520 nm 处的ε为2.7×108L·mol-1·cm-1[13]。
将Au NPs溶液均匀分散在覆有碳膜的铜网上,自然干燥后利用透射电子显微镜观察Au NPs的微观形貌,加速电压为200 k V,选取代表性部位进行拍照分析。
1.3.3 妥布霉素的测定
在0.5 mL 的Au NPs溶液中加入0.25 mL 的1.5μmol·L-1适体Hp溶液,混合振荡30 s,室温孵育15 min后,调节p H 为7。加入0.25 mL 已去除蛋白质和脂质的牛奶样品溶液或妥布霉素标准溶液,混合振荡30 s,室温孵育15 min,加入0.1 mL的1.5 mol·L-1氯化钠溶液并用水稀释至2.5 mL。平衡5 min后使用紫外-可见分光光度计在室温下测量上述溶液在波长520,620 nm 处的吸光度,分别记为A520,A620,计算A620/A520。
2 结果与讨论
2.1 金纳米粒子的表征
Au NPs溶液的紫外-可见光谱可以反映其分散程度,与不同物质(氯化钠、适体Hp、TOB)混合的Au NPs溶液的吸收光谱见图2。
由图2 可知:分散的Au NPs 溶液在波长520 nm 处具有强吸光度(曲线1,曲线2);聚集的Au NPs溶液在波长520 nm 处的吸光度显著降低(曲线3,曲线4),在波长620 nm 处出现一个新的宽峰。因此,试验以A620/A520作为Au NPs分散状态的表征指标,A620/A520随Au NPs 聚集的增强而增大。
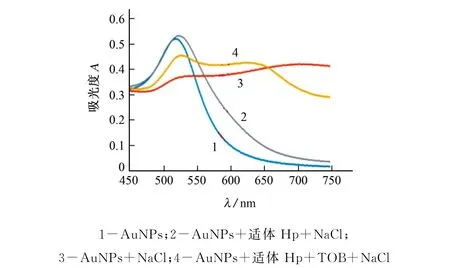
图2 与不同物质混合的Au NPs溶液的吸收光谱Fig.2 Absorption spectra of Au NPs solutions mixed with different substances
利用透射电子显微镜对Au NPs的聚集进行了表征,与不同物质(氯化钠、适体Hp、TOB)混合的Au NPs溶液的透射电子显微镜图像见图3。

图3 与不同物质混合的Au NPs溶液的透射电子显微镜图像Fig.3 Transmission electron microscope images of Au NPs solutions mixed with different substances
由图3 可知:均匀分散的Au NPs具有光滑的球形形貌(a);氯化钠的加入使Au NPs完全聚集,Au NPs的形状发生明显变化(b);在Au NPs溶液中加入适体Hp后,Au NPs表面被DNA 包覆,可以有效防止盐诱导的聚集,因此在这种情况下,Au NPs随着氯化钠的加入而略微聚集(c);妥布霉素的加入使得吸附的适体Hp 从Au NPs 分离,并导致Au NPs在氯化钠存在下发生聚集(d)。
2.2 适体比色传感器影响因素的选择
2.2.1 适体孵育时间和妥布霉素孵育时间
在适体比色传感器中,孵育时间是影响其效果的最重要因素之一。适体Hp孵育时间对反应体系A620/A520的影响见图4;妥布霉素孵育时间对反应体系A620/A520的影响见图5。
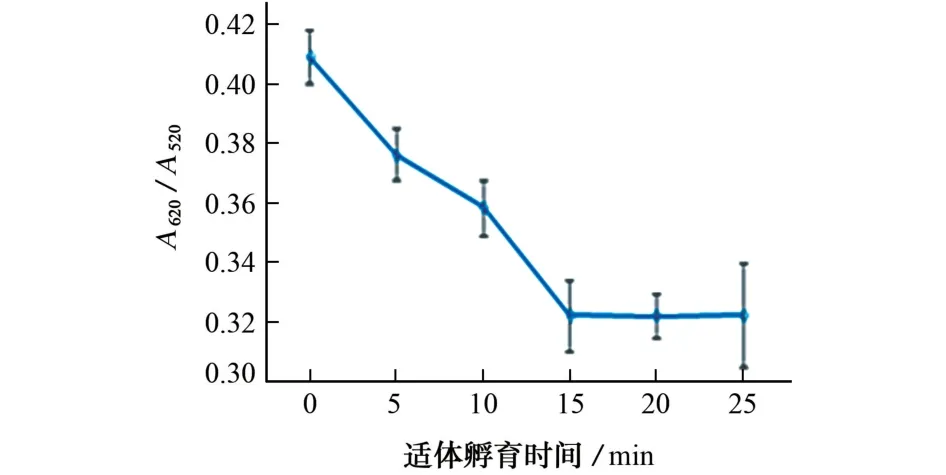
图4 适体Hp孵育时间对反应体系A620/A520的影响Fig.4 Effect of incubation time of aptamer Hp on A620/A520of the reaction system
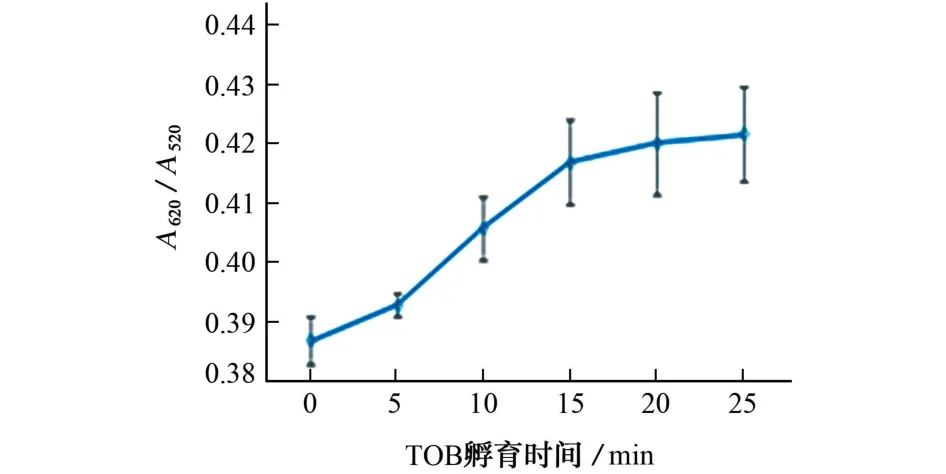
图5 妥布霉素孵育时间对反应体系A620/A520的影响Fig.5 Effect of incubation time of TOB on A620/A520of the reaction system
由图4 可知:随着适体Hp 孵育时间的延长,A620/A520明显降低;当适体Hp 孵育时间大于15 min时,A620/A520趋于平稳。由图5 可知:随着妥布霉素孵育时间的延长,A620/A520明显增加;当妥布霉素孵育时间大于15 min时,A620/A520趋于平稳。试验选择适体孵育时间和妥布霉素孵育时间均为15 min。
2.2.2 反应体系的酸度
根据文献[14]报道,反应体系的酸度可能影响DNA 的吸附。试验考察了反应体系的酸度(p H 依次为6,7,8)对A620/A520的影响,结果见图6。
由图6可知:p H 依次为6,7,8时,A620/A520与妥布霉素的浓度均呈线性关系;当p H 为7 时,A620/A520随妥布霉素浓度变化最显著。试验选择反应体系的p H 为7。
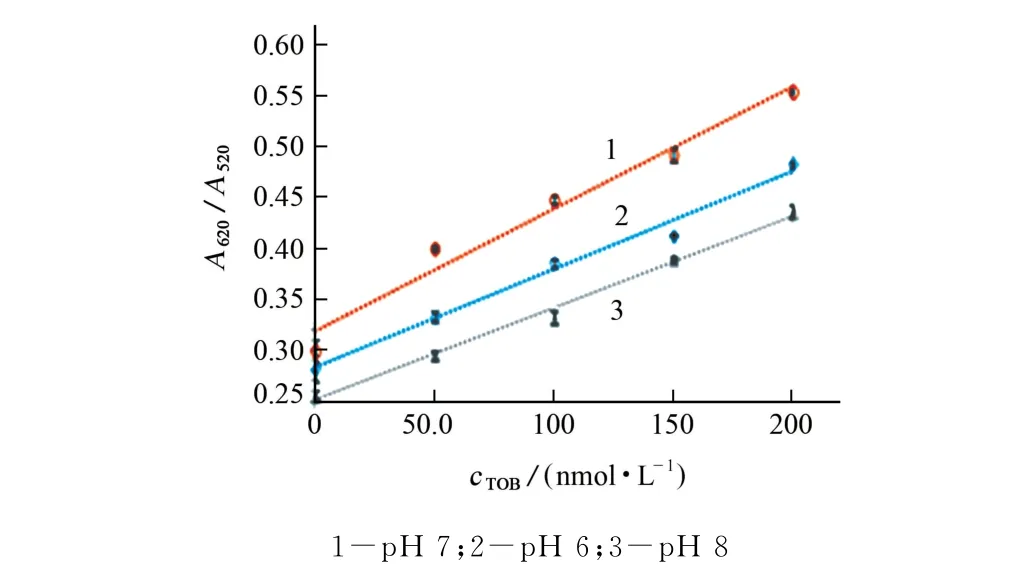
图6 反应体系酸度对A620/A520的影响Fig.6 Effect of acidity of the reaction system on A620/A520
2.2.3 适体浓度和妥布霉素浓度
按试验方法考察了适体Hp 的浓度(0,0.25,0.50,1.0,1.5,2.0μmol·L-1)和氯化钠浓度(0,0.50,1.0,1.5,2.0,2.5 mol·L-1)对反应体系A620/A520的影响,结果见图7。
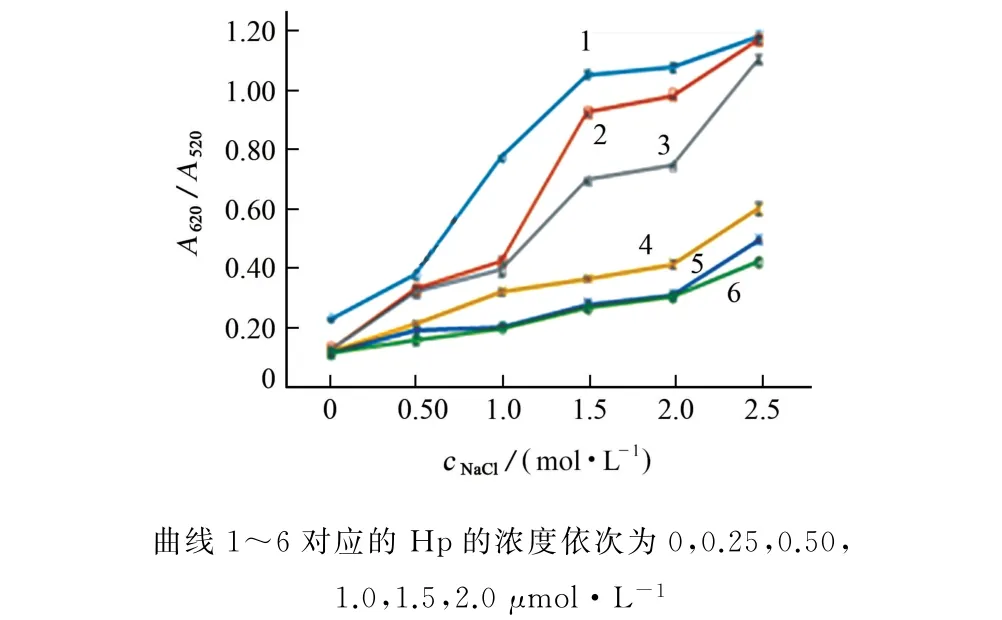
图7 适体Hp的浓度和氯化钠浓度对反应体系A620/A520的影响Fig.7 Effect of concentrations of aptamer Hp and sodium chloride on A620/A520of the reaction system
由图7可知:当适体Hp浓度大于1.0μmol·L-1时,适体Hp 可有效阻止盐诱导的聚集;在0.50 mol·L-1氯化钠溶液中,适体Hp 修饰的Au NPs几乎都不聚集;在2.5 mol·L-1氯化钠溶液中,适体Hp不能有效阻止盐诱导的聚集。基于节省试剂的原则,试验选择适体 Hp 的浓度为1.5μmol·L-1,氯化钠的浓度为1.5 mol·L-1。
2.3 标准曲线和检出限
按试验方法对妥布霉素标准溶液系列进行测定,以妥布霉素的浓度为横坐标,对应的A620/A520为纵坐标绘制标准曲线。结果表明:妥布霉素的浓度在40.0~175 nmol·L-1内与其对应的A620/A520呈线性关系,线性回归方程为y=9.000×10-4x+3.579×10-1,相关系数为0.995 9。
根据3倍标准偏差除以标准曲线斜率计算方法的检出限(3s/k),结果为13.3 nmol·L-1。所研制的适体比色传感器可用于牛奶中妥布霉素的灵敏测定。
2.4 适体比色传感器对妥布霉素测定的选择性
将500 nmol·L-1的链霉素(STR)、四环素(TET)、氟苯尼考(FF)等抗生素,以及500 nmol·L-1的甘氨酸(Gly)、精氨酸(Arg)、牛血清白蛋白(BSA)按试验方法引入适体Hp修饰的Au NPs溶液中,并与500 nmol·L-1妥布霉素进行比较,考察了该适体比色传感器的选择性。结果表明:除STR外,A620/A520没有明显变化;STR 和妥布霉素同属于氨基糖苷类抗生素,结构有部分相似,因此适体比色传感器对STR 略有响应。
2.5 样品分析
为了评价适体比色传感器的应用价值,采用适体修饰的Au NPs作为探针,对牛奶样品进行分析。根据文献[15]中方法对牛奶样品进行前处理以去除蛋白质和脂质,即在牛奶样品中加入20 g·L-1三氯乙酸溶液,超声30 min,再以4 500 r·min-1转速离心30 min,上清液使用0.22μm 的聚偏二氟乙烯膜过滤,滤液于4 ℃保存。制得的样品溶液稀释100倍后制备成妥布霉素加标样品,按试验方法对空白牛奶加标样品进行分析,计算回收率和测定值的相对标准偏差(RSD),结果见表1。
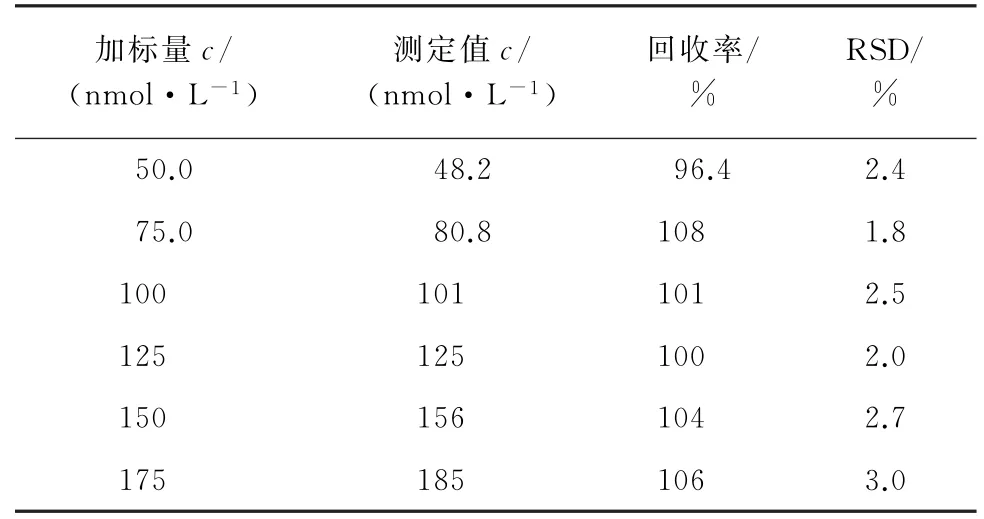
表1 样品分析结果(n=6)Tab.1 Analytical results of the samples(n=6)
由表1可知:回收率为96.4%~108%,RSD 为1.8%~3.0%。
本工作建立了一种基于核酸适体修饰的Au NPs快速测定妥布霉素的分光光度法。在没有目标物妥布霉素的情况下,DNA 适体包覆在Au NPs表面,有效地防止盐诱导的聚集;而在妥布霉素存在的情况下,适体与妥布霉素结合并从Au NPs表面脱离,导致Au NPs在适当含量的盐中发生聚集,反应体系颜色由红色变为蓝紫色。该核酸适体比色传感器操作简便、灵敏度高、选择性好,能成功地应用于牛奶中妥布霉素的测定。
