转化生长影响因子过表达对人乳腺癌MCF-7细胞迁移和侵袭的影响
2021-03-24李江敏王海玉王亚东
李 立,李江敏,王海玉,王亚东
(河南省疾病预防控制中心毒理室,河南 郑州 450016)
乳腺癌是女性最常见的恶性肿瘤,其发病率和病死率均位居女性恶性肿瘤之首。2018年,全世界约有208万例新发女性乳腺癌患者,约62万例女性肿瘤患者因乳腺癌而死亡[1]。转化生长影响因子(transforming growth-interacting factor,TGIF)是一种转录抑制因子,参与视黄酸信号通路、转化生长因子β(transforming growth factor-β,TGF-β)信号通路及Wnt/β-连环蛋白(β-catenin)信号通路。既往研究表明,TGIF与白血病、肺癌、尿路上皮细胞癌和胃肠道肿瘤等多种肿瘤的发生、发展及预后有关[2-8]。研究发现,TGIF表达异常与乳腺癌的发生有关,TGIF过表达与三阴性乳腺癌患者不良结局明显相关,敲除TGIF基因可抑制小鼠乳腺肿瘤病毒(mouse mammary tumor virus,MMTV)-Wnt-1转基因小鼠乳腺癌的发生[9]。沉默TGIF基因能够抑制三阴性乳腺癌细胞的体外侵袭和迁移能力,并抑制该细胞在裸鼠体内的肺转移[10-11],说明TGIF与乳腺癌的侵袭和转移有关。为进一步了解TGIF在乳腺癌侵袭和迁移中的生物学作用,本研究选取侵袭潜能相对较低的雌激素受体阳性人乳腺癌MCF-7细胞为模型,构建TGIF过表达细胞株,探讨TGIF过表达对人乳腺癌细胞侵袭和迁移能力的影响。
1 材料与方法
1.1 实验细胞人乳腺癌MCF-7细胞由中国科学院典型培养物保藏委员会细胞库提供,液氮冷冻保存。
1.2 主要试剂与仪器达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、胎牛血清、胰蛋白酶和遗传霉素(geneticin,G418)购自美国Gibco公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗购自北京中杉金桥生物技术有限公司,Anti-Flag-HRP抗体购自美国Sigma公司,β-catenin抗体、β-肌动蛋白(β-actin)抗体、上皮型钙黏附蛋白(E-cadherin)抗体和神经型钙黏附蛋白(N-cadherin)抗体购自美国Santa Cruz Biotechnology公司,蛋白裂解液、蛋白酶抑制剂和蛋白定量试剂盒购自美国Thermo Scientific公司,电化学发光(electro-chemi-luminescence,ECL)显色试剂盒购自美国BIO RAD公司,Lipofectamine 2000购自美国Invitrogen公司,Matrigel基质胶、细胞培养板购自美国BD Biosciences公司,Transwell小室试剂盒购自美国Novus Biologicals公司,TGIF真核表达质粒、空质粒(empty vector,EV)由本实验室克隆构建保存;CO2培养箱购自美国Revco公司,电泳仪、半干转膜仪、Chemi DocTMXRS+化学发光成像系统购自美国Bio-Rad公司,酶标仪购自芬兰雷勃公司,倒置显微镜购自德国Leica公司。
1.3 细胞培养、分组及转染(1)细胞培养:取复苏的MCF-7细胞,置于含体积分数10%胎牛血清的DMEM中,于37 ℃、含体积分数5%CO2的培养箱中饱和湿度培养,2~3 d换1次培养基,细胞密度达80%~90%时,用胰蛋白酶消化,传代培养。(2)MCF-7细胞分组及转染:取对数生长期MCF-7细胞,按每孔5×105个细胞接种于加有DMEM的6孔培养板中,分为MCF-7-TGIF组和MCF-7-EV组,第2天将2组细胞的培养基更换为无血清DMEM;将100 μL无血清DMEM、7.5 μL Lipofectamine 2000加入1.5 mL离心管,混匀,室温放置5 min,加入 5 μLTGIF质粒(0.5 g·L-1)混匀,室温放置 20 min后,将混合液加入MCF-7-TGIF组细胞中;另取100 μL无血清DMEM、7.5 μL Lipofectamine 2000加入1.5 mL 离心管,混匀,室温放置 5 min,加入5 μL空质粒(0.5 g·L-1)混匀,室温放置20 min后将混合液加入MCF-7-EV组细胞中;2组细胞转染5 h后更换无血清DMEM,继续培养至转染48 h,加入G418(500 mg·L-1)进行阳性克隆筛选,每3~4 d更换含有G418的无血清DMEM,得到阳性克隆后,传代细胞,加G418筛选培养至21 d获得稳定表达的细胞株。
1.4 Western blot法检测MCF-7细胞中Anti-Flag蛋白表达取转染后的MCF-7-TGIF组和MCF-7-EV组细胞,分别接种于60 mm培养皿中,当细胞生长至80%~90%融合时,收集细胞,用预冷的磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3次,每组加入750 μL蛋白裂解液,于冰上裂解15 min,移至1.5 mL 离心管中,4 ℃ 下14 000×g离心15 min,收集上清液,应用蛋白定量试剂盒测定蛋白含量,计算并调整2组细胞间总蛋白浓度均等。取30 μL蛋白样品上样,经聚丙烯酰胺凝胶电泳、半干转膜仪转膜后,以脱脂奶粉室温封闭1 h,加入Anti-Flag-HRP抗体(11 000)和β-actin抗体(11 000)孵育,4 ℃ 过夜后进行洗膜,加入HRP标记的二抗(15 000),室温孵育1 h。ECL显色液避光反应1 min,用 Chemi DocTMXRS+化学发光成像系统采集图像。因TGIF质粒带有Flag标签,所以根据MCF-7-TGIF组和MCF-7-EV组细胞蛋白提取液中Anti-Flag蛋白的表达量鉴定TGIF过表达的人乳腺癌细胞株是否构建成功。
1.5 四甲基偶氮唑盐比色(methyl thiazolyl tetrazolium,MTT)法检测2组MCF-7细胞的增殖能力分别取MCF-7-TGIF组和MCF-7-EV组转染后对数生长期的细胞接种于加有含体积分数10%胎牛血清的DMEM 的96孔板中进行培养,每孔1×104个细胞,每组设6个平行孔。于培养20、44、68、92 h后,加10 μL(5 g·L-1)MTT到各孔中,继续孵育4 h,弃培养基,每孔加入150 μL二甲基亚砜,室温低速摇动10 min,用酶标仪测定波长492 nm处各孔的吸光度值,以吸光度值大小表示细胞增殖能力;取均值。
1.6 划痕实验检测2组MCF-7细胞的迁移能力分别取MCF-7-TGIF组和MCF-7-EV组转染后对数生长期的细胞,按每孔1×106个细胞接种于6孔培养板,待细胞生长至完全融合时,用200 μL Tip头沿孔中央直线划痕,用PBS洗去漂浮细胞,加入无血清的DMEM,继续培养。于划痕后48 h用倒置显微镜拍摄照片,记录划痕愈合情况,计算各组细胞的相对迁移能力。细胞相对迁移能力=(实验组初始划痕宽度-实验组观察时间点的划痕宽度)/(MCF-7-EV组初始划痕宽度-MCF-7-EV组观察时间点的划痕宽度)。实验重复 3次,取均值。
1.7 Transwell小室实验检测2组MCF-7细胞的侵袭能力分别取MCF-7-TGIF组和MCF-7-EV组转染后对数生长期的细胞3×105个,接种于铺有基质胶的Transwell小室内,下层24孔培养板加入600 μL 含体积分数10%胎牛血清的DMEM,水平放置于 37 ℃、含体积分数5%CO2的培养箱中,培养24 h后,用棉签擦去小室膜上层的细胞,小室膜下层的细胞经甲醇/冰醋酸(31)固定,结晶紫染色,蒸馏水冲洗晾干,用倒置显微镜随机取视野拍照后,加 200 μL 体积分数33%冰醋酸溶液脱色10 min,用酶标仪测定波长570 nm处洗脱液的吸光度值,计算各组细胞的相对侵袭能力。细胞相对侵袭能力=实验组吸光度值/MCF-7-EV组吸光度值。实验重复3次,取均值。
1.8 Western blot法检测2组细胞中β-catenin、E-cadherin和N-cadherin表达水平取“1.4”项构建成功的蛋白样品30 μL上样,经聚丙烯酰胺凝胶电泳、半干转膜仪转膜后,用脱脂奶粉室温封闭1 h,分别加入β-catenin抗体(1500)、E-cadherin抗体(1500)、N-cadherin抗体(1500)和β-actin抗体(11 000)孵育,4 ℃ 过夜后进行洗膜,加入HRP标记的二抗(15 000),室温孵育1 h。ECL显色液避光反应1 min,用Chemi DocTMXRS+化学发光成像系统采集图像,应用Image J图像分析软件检测各条带灰度值,β-catenin、E-cadherin和N-cadherin相对表达量以目的蛋白灰度值与内参蛋白(β-actin)灰度值的比值表示。实验重复3次,取均值。

2 结果
2.1 2组MCF-7细胞中Anti-Flag蛋白表达结果见图1。MCF-7-TGIF组细胞中检测到Anti-Flag蛋白表达,MCF-7-EV组细胞中未检测到Anti-Flag蛋白表达,TGIF过表达的人乳腺癌细胞株构建成功。
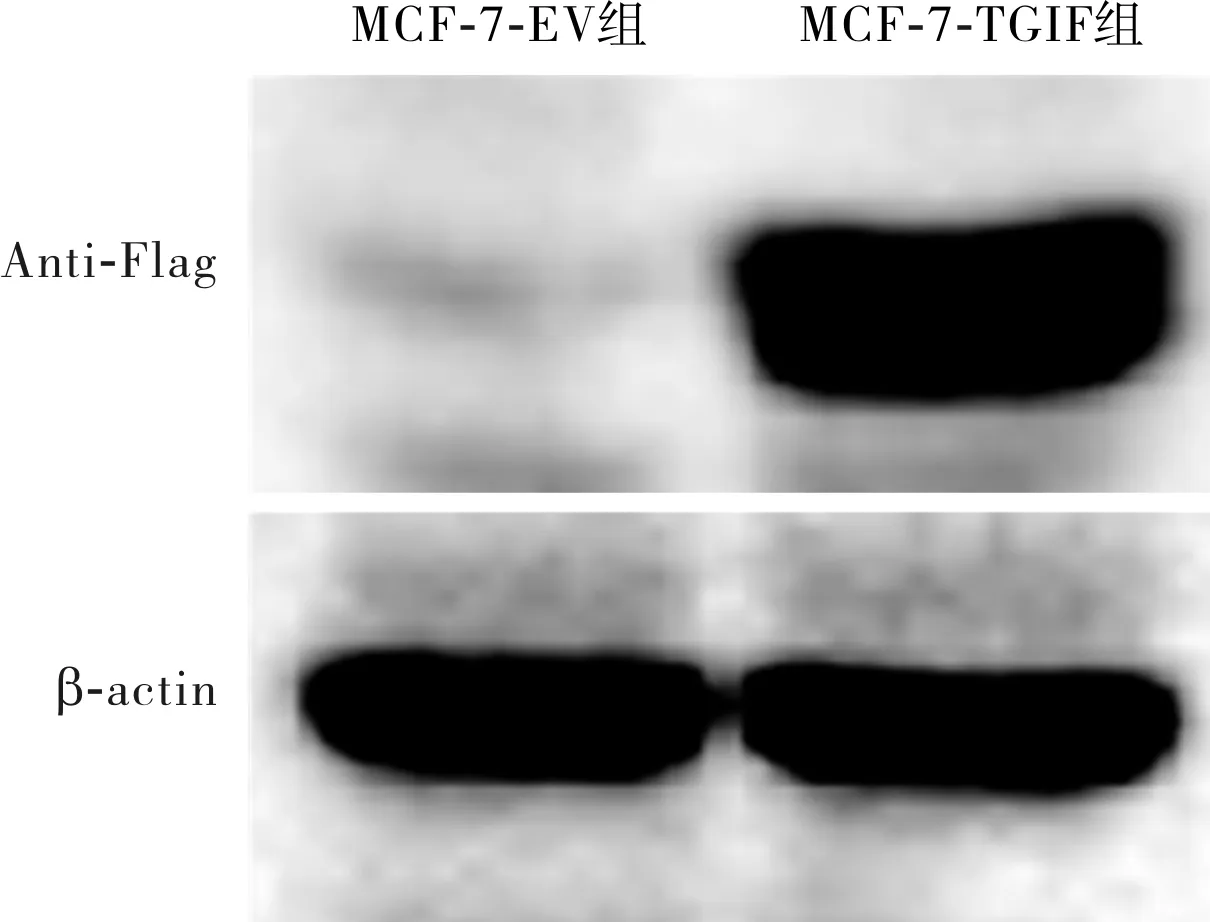
图1 2组MCF-7细胞中Anti-Flag蛋白表达(Western blot)
2.2 2组MCF-7细胞增殖能力比较结果见表1。接种24、48、72、96 h后,MCF-7-TGIF组细胞增殖能力与MCF-7-EV组比较差异均无统计学意义(P>0.05)。

表1 2组MCF-7细胞增殖能力比较
2.3 2组MCF-7细胞迁移能力比较结果见图2。细胞划痕培养48 h后,MCF-7-EV组和MCF-7-TGIF组细胞相对迁移能力分别为1.00±0.12和1.63±0.09;MCF-7-TGIF组细胞相对迁移能力高于MCF-7-EV组,差异有统计学意义(P<0.05)。

图2 2组MCF-7细胞迁移情况(划痕实验,×100)
2.4 2组MCF细胞侵袭能力比较结果见图3。MCF-7-TGIF组和MCF-7-EV组细胞相对侵袭能力分别为1.00±0.08和1.76±0.14;MCF-7-TGIF组细胞侵袭能力高于MCF-7-EV组,差异有统计学意义(P<0.05)。

图3 2组MCF-7细胞侵袭情况(结晶紫染色,×200)
2.5 2组MCF细胞中β-catenin、E-cadherin和N-cadherin蛋白表达比较结果见图4。MCF-7-TGIF组和MCF-7-EV组细胞中E-cadherin蛋白相对表达量分别为0.93±0.04、0.89±0.09,N-cadherin蛋白相对表达量分别为0.99±0.09、1.04±0.11,β-catenin蛋白相对表达量分别为0.65±0.06、0.52±0.04。MCF-7-TGIF组细胞中β-catenin蛋白相对表达量高于MCF-7-EV组,差异有统计学意义(P<0.05);2组细胞中E-cadherin和N-cadherin蛋白相对表达量比较差异无统计学意义(P>0.05)。

图4 2组MCF-7细胞中β-catenin、E-cadherin和N-cadherin蛋白表达 (Western blot)
3 讨论
乳腺癌是最常见的恶性肿瘤之一,严重威胁患者的生命健康。2018年,全球女性乳腺癌的发病率约为24.2%,病死率约为15.0%,乳腺癌是女性人群中发病率和病死率最高的癌症[12]。乳腺癌引起死亡的主要原因是转移相关的并发症,因此,研究乳腺癌转移的发生、发展机制并建立抑制肿瘤转移的有效方法具有重要意义。
TGIF是一种表达于多种细胞和组织中的核内转录抑制因子,其参与了包括TGF-β信号通路和Wnt/β-catenin信号通路在内的多条细胞信号传导通路的调节。本课题组既往研究发现,用小干扰RNA沉默侵袭能力相对较高的人乳腺癌MDA-MB-231细胞的TGIF基因后,该细胞的体外迁移和侵袭能力及其在裸鼠体内发生肺内转移的能力降低[10],说明TGIF在乳腺癌转移中起一定的生物学作用。为进一步了解TGIF在乳腺癌的侵袭和迁移中的生物学作用,本研究以侵袭能力相对较低的人乳腺癌MCF-7细胞为模型,构建TGIF过表达细胞株,因TGIF质粒带有Flag标签,本研究采用Western blot法检测了MCF-7细胞中Anti-Flag的表达,结果显示,MCF-7-TGIF组MCF-7细胞中检测到Anti-Flag蛋白表达,而MCF-7-EV组MCF-7细胞中未检测到Anti-Flag蛋白表达,说明TGIF过表达的人乳腺癌MCF-7细胞株构建成功;进一步分析发现,MCF-7-TGIF组MCF-7细胞的体外相对侵袭能力和体外相对迁移能力高于MCF-7-EV组,说明过表达TGIF促进了人乳腺癌MCF-7细胞的体外侵袭能力和体外迁移能力,证实了TGIF在乳腺癌转移中起重要作用。
β-catenin作为Wnt/β-catenin信号通路中的关键分子,参与乳腺癌的侵袭转移过程[13]。研究表明,β-catenin的异常表达与原发性人乳腺癌的临床病理相关[14],MMTV-Wnt-1转基因小鼠乳腺癌表现为伴随β-catenin蛋白活性明显升高的促生长特征[15]。沉默TGIF基因可抑制人乳腺癌细胞β-catenin蛋白的表达,有关TGIF调节β-catenin蛋白表达的分子机制研究表明,TGIF与β-catenin降解复合物中的Axin1和Axin2相互作用,并使Axin1和Axin2从β-catenin降解复合物中解离,从而允许β-catenin蛋白在细胞内累积[9]。本研究中,MCF-7-TGIF组MCF-7细胞β-catenin蛋白表达水平高于MCF-7-EV组,表明过表达TGIF可能通过激活Wnt/β-catenin信号通路而促进人乳腺癌细胞侵袭及迁移。
E-cadherin和N-cadherin是上皮细胞表型向间质细胞表型转化过程中的关键分子,在乳腺癌的侵袭转移中起一定作用。过表达E-cadherin可抑制人乳腺癌细胞侵袭转移能力,E-cadherin表达水平降低与乳腺癌转移呈正相关;而N-cadherin表达水平升高与乳腺癌发生转移呈正相关[16-17]。本研究中,2组MCF-7细胞中E-cadherin和N-cadherin蛋白表达水平比较差异无统计学意义,这一研究结果尚需进一步的实验加以证实。
综上所述,过表达TGIF在体外可促进人乳腺癌MCF-7细胞迁移和侵袭,其机制可能与Wnt/β-catenin信号通路相关,TGIF可能参与了乳腺癌细胞的迁移和侵袭过程,但其具体的调控机制尚需进一步探讨。
