生物锰氧化物对4种重金属的吸附特性研究*
2021-03-23易春龙叶欣李泰来肖乃东
易春龙 叶欣 李泰来 肖乃东
(1.大理大学 云南大理 671000; 2.中工武大设计研究有限公司 武汉 430223;3.华中农业大学资源与环境学院生态与环境工程研究室 武汉 430070)
0 引言
锰氧化物是高反应性矿物相,在元素的生物地球化学循环中起着重要作用,它们强烈参与各种重金属的氧化还原和吸附反应。与非生物锰的氧化相比,微生物可使锰的氧化过程加速多达105倍[1-2]。在缺乏微生物的情况下,天然水生系统中锰的氧化尽管在热学上是有利的,但通常以非常缓慢的速度进行。因此,大多数自然环境中的锰氧化物被认为直接来源于生物氧化过程或生物锰氧化物随后的改变。通常认为生物锰氧化物是结晶度较差、无定形的纳米颗粒。恶臭假单胞菌MnB1产生的锰氧化物是具有六边形对称结构的结晶性较弱的水钠锰矿,每个生物锰氧化物平均仅包含3个堆叠的薄片,并且在水平区域内延伸约8~9 nm,使其成为真正意义上的纳米颗粒[3]。
生物锰氧化物因其在重金属的生物地球化学循环中发挥重要作用及被用于有毒重金属污染水体环境的生物修复的潜在用途而备受关注。VILLALOBOS M等[4-5]的研究结果表明,Pb在锰氧化物上的驻留方式可分为2种,一种驻留在微晶的中间层区域,另一种驻留在其外表面。Zn在低浓度负荷下与结构O原子形成四面体配位形态吸附到生物锰氧化物上,在高浓度负荷下则以八面体配位形态被吸附[6]。这些研究结果表明,生物锰氧化物对重金属具有独特的吸附特性。
Cu、Zn、Cr、As是水体污染中常见的重金属,但尚无关于锰氧化物同时吸附此4种重金属的研究。本研究的目的在于对生物锰氧化物的结构特性及组成进行表征分析,研究不同环境条件下4种重金属在生物锰氧化物上的吸附特点,并推断可能的吸附机理,以期为生物锰氧化物治理重金属污染的水体提供科学依据。
1 材料与方法
1.1 实验材料
实验菌种:Sphingopyxissp. 4-15,由华中农业大学微生物国家重点实验室提供。
R2A培养基:酪蛋白氨基酸0.5 g,酵母粉0.5 g,可溶性淀粉0.5 g,葡萄糖0.5 g,胰蛋白胨0.5 g,丙酮酸钠0.3 g,磷酸氢二钾0.3 g,七水硫酸镁0.05 g,蒸馏水1 000 mL,高压灭菌(121 ℃)20 min。
主要试剂:硝酸铜、硝酸铬、分析纯、硝酸锌和亚砷酸钠,用于配制重金属离子母液。其中Cu2+、Zn2+母液质量浓度为10 000 mg/L,Cr3+、As3+母液质量浓度为1 000 mg/L,实验时再根据需要稀释至设定浓度和用量体积。其余试剂均为分析纯或优级纯。
1.2 实验方法
1.2.1 锰氧化细菌的形态观察
对锰氧化细菌进行革兰氏染色,在光学显微镜(LEICA MD500)下观察染色情况;将菌体在无菌条件下冷冻干燥后,用扫描电子显微镜(Hitachi SU8000, JAPAN)观察细胞形态。
1.2.2 生物锰氧化物的制备与表征
向灭菌冷却后的R2A培养基中加入一定量经过滤除菌的HEPEPS缓冲液(pH值=7.0)和MnCl2溶液(1 mol/L),使得缓冲液最终浓度为20 mmol/L,Mn(II)最终浓度为10 mmol/L。按1%的接种量接种细菌后,于28 ℃、180 r/min的条件下振荡培养10 d,离心收集锰氧化物沉淀,用去离子水反复洗涤去除杂质,随后将沉淀冻干保存备用。
对上述锰氧化物样品进行表征。在Bruker D8 Advance X射线衍射仪上进行X-射线衍射分析(XRD);场发射扫描电镜(FESEM)观察在SEM/EDX分析仪(FESEM-EDX, Hitachi SU8000, JAPAN)上进行;表面积(Specific Surface Aera, SSA)用全自动比表面和孔径分布分析仪(Micromeritics ASAP 2020, USA)测定;红外吸收光谱分析在傅里叶变换红外光谱仪(Bruker VERTEX 70)上进行;光电子能谱(XPS)分析在VG Multilab 2000 X射线多功能电子能谱仪上进行。
1.2.3 各因素对重金属吸附影响实验
吸附实验采用批实验方式进行。基准实验条件:pH值为5.0,离子强度为0.01 mol/L,温度为25 ℃,时间为24 h,Cu、Zn、Cr、As质量浓度分别为25、25、2.5、2.5 mg/L。研究一个因素对吸附的影响时保证其他基准条件不变。
取(0.010 0 ± 0.000 2) g生物锰氧化物放入100 mL离心管中,加入20 mL一定浓度的重金属混合溶液,用NaNO3调节溶液离子强度,用NaOH或HNO3调节pH值,混合溶液于25 °C振荡反应24 h。过滤后取清液,测定Cu、Zn、Cr、As浓度。pH值梯度为2、3、4、5、6;离子强度梯度为0.01、0.03、0.05、0.1、0.5 mol/L;温度梯度为15、25、35、45 °C;Cu、Zn、Cr、As浓度比为1∶1∶0.1∶0.1,其中Cu质量浓度为5、10、20、25、30、40、50 mg/L;时间梯度为5、15、30、60、120、180、240、300、360、420 min。
1.3 测试分析方法
溶液pH值用pH计(PE28,梅特勒-托利多)测定;各金属离子浓度用电感耦合等离子体发射光谱仪(ICP-OES,Agilent 5110)测定。
2 结果与讨论
2.1 锰氧化细菌形态观察
在固体培养基上培养锰氧化菌株Sphingopyxissp. 4-15,观察到其菌落形态为边缘清晰的圆形,色黄,表面有光泽,菌落直径较小。图1为该细菌的革兰氏染色结果,革兰氏染液将其染成红色,说明该菌为革兰氏阴性细菌。由扫描电镜图(图2)可见,菌体细胞为胶囊状,长度较短,约0.5~1 μm。
2.2 锰氧化物的结构及性质
生物锰氧化物的扫描电镜图如图3所示,由图3可见,生物锰氧化物为瓣片状,瓣片结构有序交联在一起形成花球状,形貌较为规则,花球直径为2.5~3 μm。XRD图谱(图4)中的衍射峰表明,生物锰氧化物中含有MnO2、Mn3O4和MnO等不同类型的晶体锰氧化物。XPS图谱(图5)显示,Mn、C、O、N为生物锰氧化物的主要组成元素。为了进一步了解生物锰氧化物中Mn的氧化态,对Mn(2p3/2)峰进行了曲线拟合,图6显示了Mn 2p的区域和XPS光谱拟合曲线,结果表明Mn2+、Mn3+和Mn4+在生物锰氧化物中共存,其中Mn4+占最高比例(见表1),平均锰氧化度为3.32。

图1 菌株革兰氏染色

图2 菌株扫描电镜图(×20 000倍)

图3 生物锰氧化物扫描电镜图(×6 000倍)
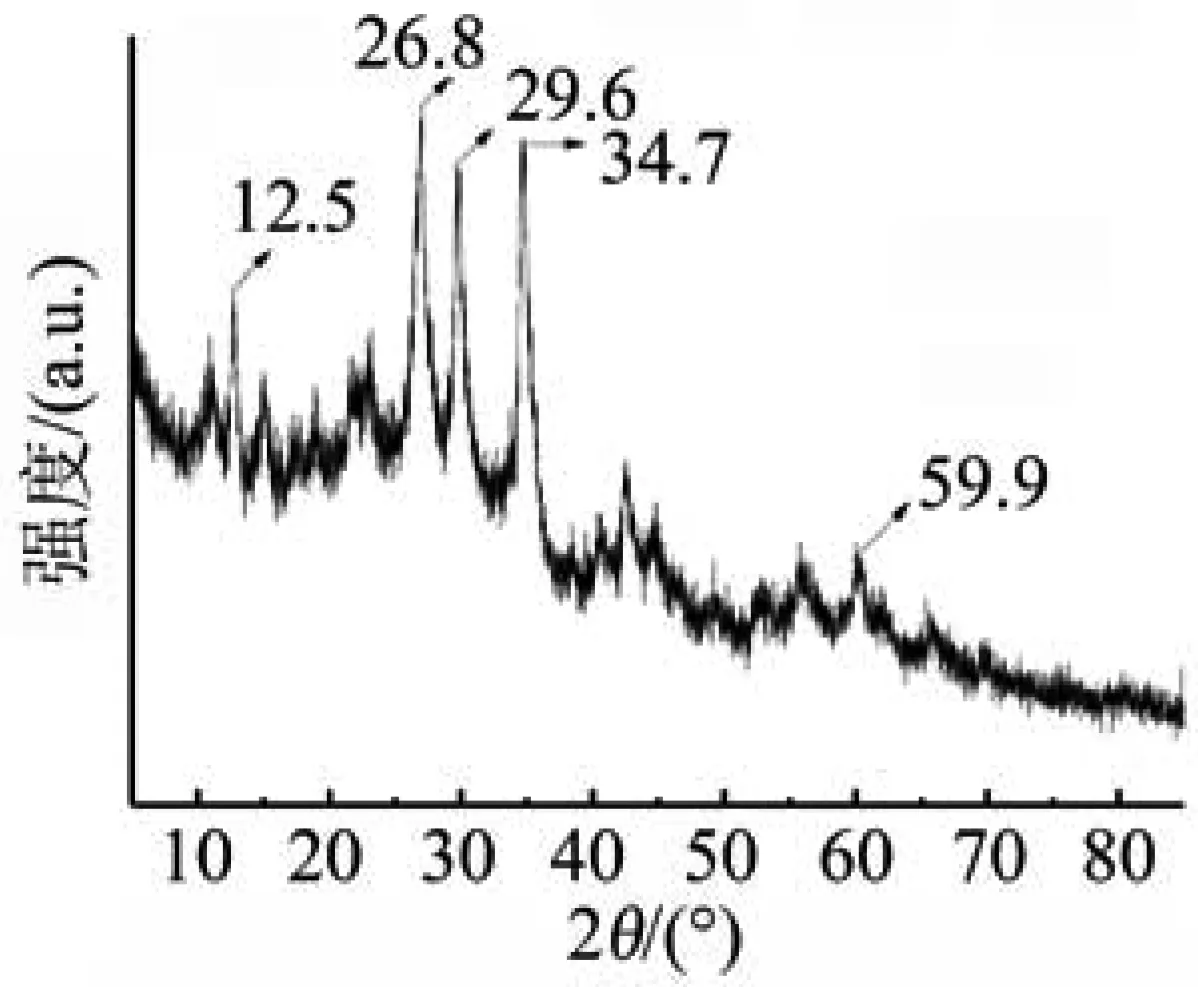
图4 XRD图谱
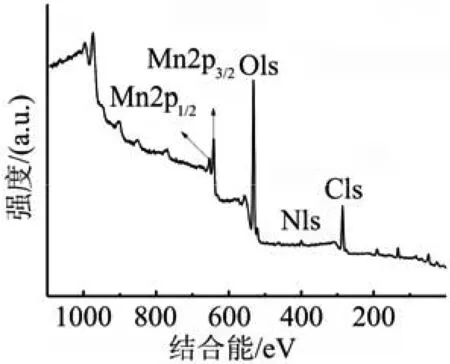
图5 XPS图谱

图6 Mn(2p3/2)拟合图谱
生物锰氧化物的平均孔径为35.56 nm,为中孔结构,比表面和孔体积分别为41.49 m2/g和0.373 cm3/g。

表1 锰氧化物样品Mn(2p3/2)的多峰拟合结果
2.3 吸附作用的影响因素
2.3.1 pH值对吸附的影响
图7为不同pH值条件下锰氧化物对4种重金属的去除率。从图7中可以看出随着pH值的升高,生物锰氧化物对Cu(II)和Zn(II)的去除率呈现逐渐升高的趋势,这可能是因为随着溶液pH值升高,生物锰氧化物表面聚集的负电荷量增加,负电荷与金属阳离子之间的静电吸引作用增强,从而吸附作用增强。此外,有研究表明,锰氧化物在pH值较高的溶液中其结晶度会有所降低,这种状态更有利于重金属的吸附[7]。
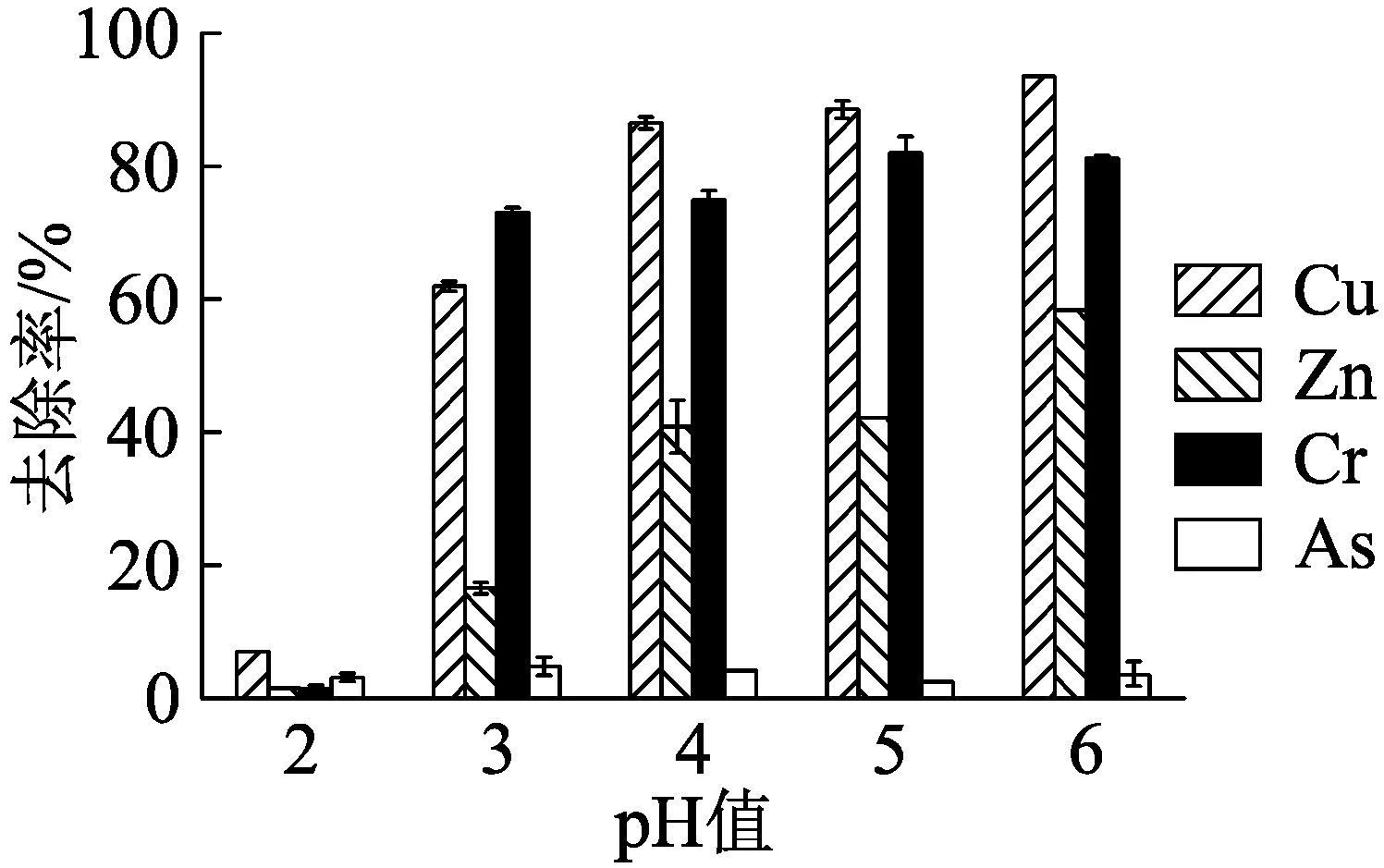
图7 初始pH值对锰氧化物吸附重金属的影响
随着pH值升高,Cr(III)的去除率呈现先升高后降低的趋势。这是因为随着pH值升高,溶液中由Cr(III)被生物锰氧化物氧化成以阴离子形态存在的Cr(VI)含量逐渐降低,由于生物锰氧化物表面的电荷特性使得其对Cr(III)的吸附作用强于对Cr(VI)的吸附作用,因此一定范围内升高pH值有利于Cr(III)的吸附去除。而溶液pH值大于5时,溶液中的Cr(III)会以Cr(OH)2+、Cr(OH)2+或者Cr(OH)3的形式存在,此类形态不利于吸附作用发生,从而去除率降低。
在实验pH值范围内,生物锰氧化物对As(III)的吸附作用均较弱,且pH值对吸附影响无明显规律。
综合分析,锰氧化物对4种重金属吸附反应的最适pH值为4~6。
2.3.2 离子强度对吸附的影响
图8为不同离子强度条件下生物锰氧化物对4种重金属的去除率。由图8可知随着离子强度增加,Cu(II)、Zn(II)和Cr(III)的去除率呈现逐渐降低的趋势。因为Na+的引入会占据锰氧化物表面的部分活性吸附位点,此外,在较高浓度的电解液条件下生物锰氧化物微粒之间容易发生团聚现象,使得其比表面积有所减小。另一方面,离子强度对吸附反应影响较小,说明通过电荷吸引和离子交换等方式被吸附到锰氧化物表面的重金属量不多,即由库伦引力导致的吸附作用较弱,猜想吸附反应发生后锰氧化物与重金属离子之间形成了稳定的配位化合物。As(III)在锰氧化物上的吸附过程没有明显受到离子强度的干扰,可能是因为锰氧化物上As(III)的吸附位点几乎不被Na+占据。

图8 离子强度对锰氧化物吸附重金属的影响
2.3.3 温度对吸附的影响
图9为不同温度条件下生物锰氧化物对4种重金属的去除率。由图9可知,Cu(II)和Zn(II)的去除率随着温度的升高而逐渐增大,这可能是因为当温度升高时布朗运动会随之加快,即金属阳离子会更快地与锰氧化物表面可交换的阳离子发生交换作用或更快地被吸附到结构晶格位点中。升高温度能够增大生物锰氧化物对Cu(II)和Zn(II)的去除率,说明该吸附过程为吸热反应过程。
Cr(III)的去除率受温度影响较小。As(III)的去除率受温度影响情况与Cu(II)和Zn(II)完全相反,这是因为溶液中的As(III)大多以亚砷酸根等阴离子形式存在,研究表明金属氧化物对阴离子的吸附过程为放热反应过程,温度升高有利于吸附向逆反应方向进行,从而导致锰氧化物中部分吸附的砷解吸出来进入溶液[8]。
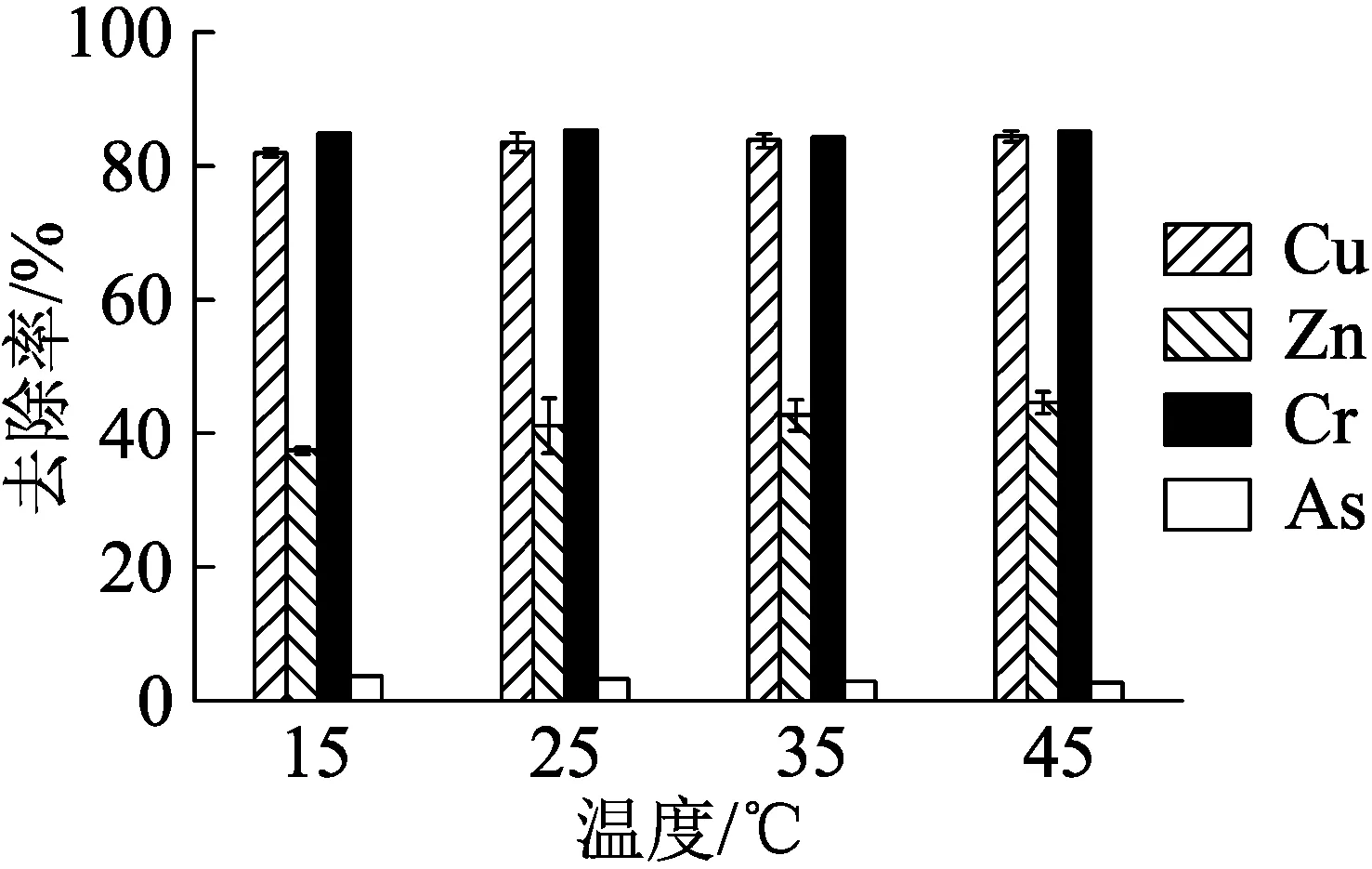
图9 温度对锰氧化物吸附重金属的影响
2.3.4 等温吸附特征
4种重金属在不同浓度条件下生物锰氧化物对其吸附量变化如图10所示。由图10可知,在低浓度时随着浓度的增加生物锰氧化物对Cu(II)的吸附量快速升高,升高幅度在高浓度时有所减缓,但依然保持上升趋势,说明在该浓度范围内生物锰氧化物对Cu(II)的吸附还未达到饱和;对Zn(II)的吸附量随着浓度的升高先增加后减小;对比Cu(II)和Zn(II)的吸附现象,在前者吸附量不断增加时后者吸附量有一定减小的趋势,说明锰氧化物对Cu(II)的吸附亲和力较强,在吸附容量一定且重金属浓度较大时Zn(II)的吸附受Cu(II)吸附的影响。在Cr(III)质量浓度为0.5~5.0 mg/L时,生物锰氧化物对其吸附也未达到饱和容量;对As(III)的吸附量随着浓度的增加缓慢上升后趋于平衡。

图10 锰氧化物对重金属的等温吸附曲线
在4种重金属最大初始浓度下,生物锰氧化物对混合重金属溶液中Cu(II)、Zn(II)、Cr(III)、As(III)的吸附量依次为:70.184、15.140、9.141、0.089 mg/g,表现出了较好的重金属吸附容量。
2.3.5 吸附动力学特征
4种重金属吸附量随反应时间的变化趋势如图11所示。在吸附反应初期(120 min前),生物锰氧化物对Cu(II)和Zn(II)的吸附量快速上升,在120~300 min时上升幅度较小,之后吸附反应逐渐达到平衡。这种变化趋势是因为在反应初期,生物锰氧化物层间结构中吸附位点较多,重金属能快速地占据到相应位点上而被吸附;当吸附反应进行到一定阶段时,锰氧化物表面活性位点有所减少,此时重金属浓度也相对较低,液固界面的传至动力减弱,导致吸附速度减慢,反应最终达到平衡。
生物锰氧化物对Cr(III)的吸附速度较快,在反应开始5 min内就可达到平衡;对As(III)的吸附量随反应时间的增加出现波动式变化,最终在反应360 min时达到平衡,这可能与锰氧化物对砷的氧化及砷在不同反应时间段的存在形态有关。
总体而言,生物锰氧化物对4种重金属的吸附反应较为快速,吸附反应达到平衡时,锰氧化物对Cu(II)、Zn(II)、Cr(III)、As(III)的平衡吸附量分别为40.02、17.22、5.99、0.20 mg/g。

图11 锰氧化物对重金属的吸附动力学曲线
3 结论
(1)由锰氧化细菌Sphingopyxissp. 4-15介导生成的生物锰氧化物中含有MnO2、Mn3O4和MnO等晶体锰氧化物,为瓣片状结构,瓣片结构之间相互交联且完全包裹在菌体细胞表面,呈现出形貌较规则的花球状。BET分析结果显示锰氧化物平均孔径为35.56 nm,为中孔结构,比表面积为41.49 m2/g。Mn、C、O、N为该生物锰氧化物的主要组成元素,Mn4+、Mn3+和Mn2+在锰氧化物中共存,但主要以高价态Mn4+和Mn3+为主,平均锰氧化度为3.32。
(2)升高pH值总体上有利于生物锰氧化物对Cu(II)、Zn(II)和Cr(III)的吸附,As(III)的吸附去除受pH值影响较小,吸附反应最适pH值为4~6。离子强度对4种重金属的吸附过程干扰较小。升高温度对锰氧化物吸附去除Cu(II)和Zn(II)有一定的促进作用,而对As(III)的吸附产生小幅度的抑制。
(3)锰氧化物对Cu(II)、Zn(II)、As(III)的吸附在反应360 min时可达到平衡,对Cr(III)的吸附在反应5 min内达到平衡。在4种重金属最大初始浓度下,生物锰氧化物对Cu(II)、Zn(II)、Cr(III)、As(III)的吸附量依次为:70.184、15.140、9.141、0.089 mg/g,具有较好的重金属吸附容量。
