铁线莲属植物SSR-PCR反应体系的建立与优化
2021-03-22李勇慧于相丽周晓君
李勇慧,于相丽,周晓君
(洛阳师范学院 生命科学学院,河南 洛阳 471934)
铁线莲属(CLematis L.) 是毛茛科(Ranuncu-Laceae)植物,大约有300多种,河南省的北部、南部和西部山区是大多数铁线莲分布的地区[1]。铁线莲有较高的药用价值,如治疗风湿、肿瘤,也有利于利尿等,这就使它的经济价值也非常高[2]。另外,铁线莲属植物有许多品种,花型多种多样,颜色艳丽,再加上叶片的修饰,使铁线莲具有较高的观赏价值,在城市绿化方面被广泛使用[3-4]。简单重复序列(simple sequence repeat,SSR)亦可称为微卫星(microsatellite),是目前最常用的微卫星标记之一,在真核生物的基因组编码区以及非编码区广泛地分布[5]。可以根据已知的侧翼序列设计出引物用于PCR扩增,将所需的卫星位点扩增出来,最后使用聚丙烯凝胶电泳进行跑胶,使实验结果更加直观[6]。SSR分子标记技术相比于其他技术有许多优点,如良好的多态性,稳定性好,操作时难度不大,有较强的重复性,成本低等[7-8]。同时它的应用前景非常广泛,近几年在引物筛选、植物种质资源分析等多个方面都有它的身影。
目前对铁线莲遗传多样性的研究大多围绕着细胞学和形态学这几个方面[9],少数的有关于分子方面的研究多集中在ISSR分子标记技术方面,如任夏萌等[10]利用ISSR分子标记技术对大叶铁线莲的种质遗传多样性进行了分析。但近年来SSR技术广泛应用于各种植物的遗传多样性分析中,如吴文强等人[11]用SSR技术标记藜麦基因组相对位点并进行扩增,然后用PAGE进行检测,对其遗传多样性进行分析,用同样方法的还有张佳欣等人[12]。铁线莲属植物SSR-PCR反应体系的优化及引物筛选方面尚未有人进行研究。因此,本实验对铁线莲属植物SSR-PCR反应体系进行优化研究。
1 材料与方法
1.1 实验材料
本实验从洛阳市周边不同区域的铁线莲属植物中选取粗齿、陕西、太行、大叶和钝萼五种铁线莲,并将其分别用 Tc、Ts、Tt、Td 和Te编号,然后进行实验(见表1)。
1.2 实验方法
1.2.1 DNA提取
采用改良的CTAB法对这五种铁线莲进行DNA提取。
1.2.2 检测叶片DNA的提取结果
为了确定DNA是否被提取出来,本实验将采用琼脂糖凝胶电泳法对DNA进行检验,通过跑出来的条带的亮度和清晰度来确定DNA是否被提取出来以及浓度高低。为了使实验结果更加准确,用分光光度计对DNA的密度和其A260∶A280的比值来判断DNA纯度。
1.2.3 SSR-PCR反应体系的建立与优化
从刚提取的DNA中挑选出条带明显、亮度高的Ts1、Tc42、Tt51和Te8等4个DNA作为模板,用编号为30的引物对PCR反应体系进行优化。首先优化PCR的扩增体系,详情如下:2×pcr mixture 5 μL,DNA 模板0.3 μL/0.5 μL/0.7 μL;正向和反向引物各 0.5 μL。
其次优化退火温度,基于已经优化好的PCR的扩增体系,选择条带明显、亮度高的Ts1、Tc42、Tt51和Te8 4个DNA作为模板,然后将退火的温度设置成51℃、53℃和55℃,筛选出最佳退火温度。
1.2.4 PCR扩增、电泳
用优化好的PCR的最佳反应体系和反应程序,从已经提取出来的DNA中选出最好的4个DNA,Ts1、Tc42、Tt51和Te8作为样品,再挑选引物进行扩增。PCR扩增体系为:正反引物各 0.5 μL,ddH2O 3.5 μL,2×pcr mixture 5 μL,DNA 模板 0.5 μL,总体系共计 10.0 μL。PCR的扩增程序见表2,低温保存产物。

表2 PCR扩增程序
将电压设置成300 V,电流为150 mA,聚丙烯酰胺凝胶电泳3 h,然后进行银染检测。
2 实验结果
2.1 模板浓度与最佳退火温度筛选结果
以Ts1、Tc42、Tt51和Te8作为模板,用编号为30的引物对DNA模板的浓度梯度进行筛选。筛选结果如图1所示,表明当体系中加入0.3 μL的DNA时,胶片上的条带不太清晰,当体系中加入0.5 μL或者0.7 μL DNA时,胶片上的条带清晰。

图1 DNA浓度梯度筛选
以Ts1、Tc42、Tt51和Te8作为模板,将30号引物的退火的温度设置成51℃、53℃和55℃进行温度梯度筛选。筛选结果如图2所示,在退火温度为51℃和55℃时,扩增出来条带不清晰,有拖尾现象,仅当53℃时,跑出来的条带才清晰,即为30号引物的最佳退火温度。
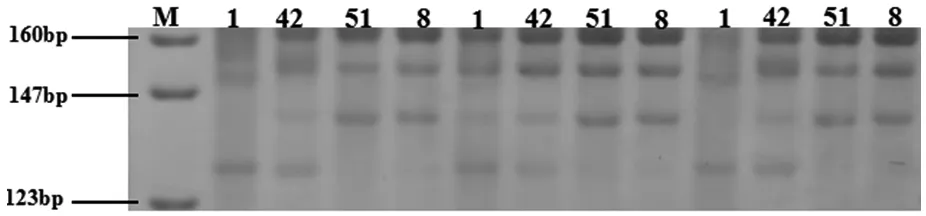
图2 退火温度梯度筛选
2.2 SSR引物筛选及扩增结果
用已经筛选出来的PCR最佳反应体系和纯合程度高的Ts1、Tc42、Tt51和Te8这4个DNA,对已有的100条引物进行多态性筛选,从其中选择出目标区段间有清晰条带的、多态性丰富的、稳定性好的6条引物,以便用于后期的铁线莲种质遗传多样性分析。筛选出的最佳引物为分别为 CH-10、CH-15、CH-28、CH-30、CH-96、CH-100,最佳退火温度分别为 53、52、51、53、52、51℃,引物筛选结果如图3-图5所示。
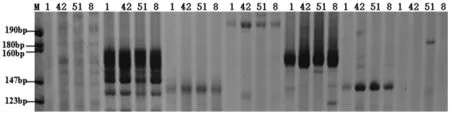
图3 15、30、67、96、63、56、41 号引物筛选图

图4 42、28、89、80、13、32、10、7、37 号引物筛选图

图5 46号扩增结果
3 讨论
朱芹等人[13]在优化刨花润楠的SSR-PCR体系时发现Taq酶的浓度对实验结果有很大的影响,并着重对其进行优化。本实验则从DNA浓度方面优化体系。何仁锋等[14]人在对菊花进行SSR-PCR体系优化时也曾对DNA浓度进行优化,并得出以下结论:一般而言,PCR扩增过程中模板DNA不会对PCR的结果产生多大影响,对结果有较大影响的是DNA的浓度,当实验用到DNA浓度较高时,对实验的结果也不会有很大影响。而本实验所提取出来的DNA浓度较高,所以筛选最佳浓度时实验结果不太明显,但由于CTAB法提取的DNA相较于试剂盒法容易降解,再加上实验做的时间较长,反复解冻DNA,使得DNA降解,造成跑胶时会出现拖尾现象。
同时退火温度也影响实验结果,本实验参照周利宏[15]在研究百合遗传多样性时的方法,并以30号引物为例,同样设置3个温度梯度以确定引物的最佳退火温度,实验结果显示当退火温度过低即为51℃时,胶片上就会显示出多条非特异性条带,从而使实验的效果不佳;若退火时温度太高即为55℃时,则引物和DNA不能够特异性地结合在一起,扩增效果也不好,在53℃也就是30号引物的最佳退火温度时才能得到清晰的条带。最后用筛选出的最佳体系和最佳反应程序筛选已有的100条引物,最终筛选出多态性较好的10号、15号、30号、46号、96号和100号引物,为日后进行铁线莲种质资源分析奠定基础。
