高温胁迫对美洲鲥1+龄鱼种抗氧化与非特异性免疫相关指标的影响
2021-03-20袁新程蒋飞施永海徐嘉波刘永士邓平平
袁新程,蒋飞,施永海,徐嘉波,刘永士,邓平平
(上海市水产研究所/上海市水产技术推广站,上海200433)
温度作为影响鱼类正常生长、代谢、发育和繁殖过程中的重要外界因子,大多数鱼类总是选择在最适宜的温度环境中生存、摄食与生长。酶作为机体催化生物反应的一种特殊蛋白质,在鱼体内起着至关重要的调节作用[1]。当外界水环境发生变化时,鱼体将产生应激反应,主要表现为机体内各种酶活性的变化[2]。诸多研究结果均显示,温度变化可对鱼类的抗氧化能力产生直接影响[2-4]。温度过高会导致鱼体抗氧化性酶活性下降以及抗氧化物质含量降低,从而削弱其清除有害自由基的能力,导致脂质过氧化物如丙二醛含量增多,对鱼体造成直接伤害[5]。温度也是影响鱼类非特异性免疫能力的外界因子之一:当外界水温低于鱼体最适温度时,鱼体的免疫反应通常会降低;而外界温度过高则会导致鱼体中参与免疫反应的相关酶活性的丧失,影响鱼类正常的免疫应答反应[6-7]。因此,研究鱼类在急性高温胁迫条件下的抗氧化和非特异性免疫酶活性指标变化具有重要意义。
美洲鲥(Alosa sapidissima),又称美洲西鲱,隶属于鲱形总目(Clupeomorpha)鲱形目(Clupeiformes)鲱科(Clupeidae)西鲱属(Alosa),为典型的溯河产卵鱼类,主要生活于大西洋西海岸(从加拿大魁北克省到美国佛罗里达州)和太平洋海岸(从美国加利福尼亚州圣迭戈市到阿拉斯加州)的海洋和河流中,是北美地区重要的经济鱼类之一[8-9]。美洲鲥以其肉质细嫩、丰腴肥美而著称[9-10],被世界各国广泛引种。由于我国长江鲥(Tenualosa reevesii)资源日益枯竭,而美洲鲥的形态特征与长江鲥相似,因此,自20 世纪90 年代以来,上海市水产研究所率先将美洲鲥引入我国进行人工繁养;目前,美洲鲥在我国的繁育及养殖技术逐渐成熟[11-12],养殖规模逐年扩大,现已成为长江鲥的替代品,并成为国内外喜爱的名贵淡水养殖鱼类之一。近年来,国内关于美洲鲥的研究主要集中在繁殖技术[10]、苗种培育[13]、生长特性[11,14]、养殖运输[8,15]等方面,而国外对美洲鲥的研究主要集中在捕捞、迁徙及遗传多样性等方面[16-18],但至今尚未有关于美洲鲥对环境温度应激性变化的相关研究报道。为此,本研究通过对1+龄美洲鲥进行96 h的温度胁迫实验,测定其肝和血清中抗氧化及非特异性免疫相关酶指标的变化,以期为美洲鲥的健康养殖和其对环境变化适应能力的评价提供基础数据。
1 材料与方法
1.1 实验用鱼和用水
实验用鱼为上海市水产研究所奉贤科研基地于2017年5月经人工繁育养殖的1+龄美洲鲥鱼种,平均体质量(152.07±25.24)g,平均体长(21.89±1.28)cm。实验在上海市水产研究所奉贤科研基地进行,选取同一批次卵孵化养成的大小均匀、体质健壮、活力较强的个体进行实验。实验用水均是经过60目筛绢网过滤、沉淀和充分曝气后的当地河口水(盐度为2~3),实验期间水中溶解氧水平均高于5 mg/L,pH 为7.62±0.21,氨氮和亚硝酸盐质量浓度均低于0.01 mg/L。
1.2 实验设计
设24 ℃(对照组)、28 ℃和30 ℃3个温度水平处理组(在预实验中,由于在32 ℃的温度水平下,美洲鲥在网箱中狂躁不安,不断死亡,12 h 后无存活,故确定最高温度为30 ℃),每一水平设3个平行,每一平行25尾鱼,组间个体无显著差异(P<0.05)。实验在网箱(1.0 m×0.6 m×0.4 m)中进行,在每个水泥池(2.5 m×7.5 m×1.5 m)中放置3个相同的网箱作为重复组。实验开始前,将水温升至24 ℃,作为实验初始温度,实验鱼先暂养于水泥池中(此时水温均为24 ℃),稳定1周后,移入对应的实验网箱中,再稳定3 d后开始实验,通过热水循环(CWNS0.85-90/70-Y型全自动燃油热水机)进行水温调控(±0.2 ℃),并在1 h 内从初始温度(24 ℃)升至28 ℃和30 ℃。当温度达到各设定水平后,立即对各组进行取样(表示调节温度前的情况),记为0 h,然后,分别在3、6、12、24、48、96 h时取样,从每个温度水平的3个重复中各随机取3尾,整个实验过程中共取样189尾鱼。实验前一天及实验期间,各温度处理下均不投食。
1.3 样品采集与酶活性测定
1.3.1 样品采集
分别对0、3、6、12、24、48、96 h 采集的189 尾实验鱼取血清和肝样品。首先,利用0.5 mg/L 间氨基苯甲酸乙酯甲磺酸盐(MS-222)对实验鱼进行麻醉,然后进行尾静脉取血,将取出的血液移入1.5 mL离心管中,在4 ℃冰箱中静置2 h后,于4 ℃、3 000 r/min条件下离心10 min,取上清液,保存于-80 ℃冰箱中;接着,将实验鱼放于冰盘上,解剖取肝,用事先准备好的生理盐水(4 ℃,0.86%)对肝进行冲洗后,按照质量浓度比1∶9的比例加入事先预冷的生理盐水,在冰浴下使用事先准备好的玻璃匀浆器进行匀浆,制成10%匀浆液,并于4 ℃、3 500 r/min 条件下离心10 min,取上清液,保存在-80 ℃冰箱中。将制备的上清液用于抗氧化酶、非特异性免疫酶活性及总蛋白含量的测定。
1.3.2 酶活性和总蛋白含量测定
分别采用南京建成生物工程研究所提供的A001-1 总超氧化物歧化酶(total superoxide dismutase, T-SOD)检测盒(羟胺法)、A007-2 过氧化氢酶(catalase, CAT)检测盒(可见光比色法)、A003-1 丙二醛(malondialdehyde,MDA)检测盒(硫代巴比妥酸法)、A005 谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定盒(可见光比色法)、A059-1 碱性磷酸酶(alkaline phosphatase,AKP)测定盒(可见光比色法)、A060-1 酸性磷酸酶(acid phosphatase,ACP)测试盒(可见光比色法)、C009-1 谷丙转氨酶(alanine aminotransferase,ALT)测试盒(赖氏法)以及C010-1 谷草转氨酶(aspartate aminotransferase,AST)测试盒(比色法)对所取实验鱼肝和血清样品中抗氧化酶和非特异性免疫酶活性进行测定;使用考马斯亮蓝法测定总蛋白含量。
1.4 数据处理
利用Excel 2007 整理实验数据,所得结果以平均值±标准差表示;利用SPSS 17.0对实验数据进行单因素方差分析和邓肯多重比较,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 高温胁迫对美洲鲥肝和血清中抗氧化相关酶指标的影响
肝中SOD 活性大小变化如图1A 所示:对照组(24 ℃)的活性大小基本稳定,变化范围为182.438~244.819 U/mg,而28 ℃和30 ℃组的SOD 活性呈现随时间增长逐渐增大的趋势,在48 和96 h 时,SOD活性均明显大于24 ℃组(P<0.05);此外,除3 h 的28 ℃组明显小于24 ℃组外,其他时间的高温组与24 ℃组均无明显差异(P>0.05)。血清中SOD活性大小变化如图1B所示:24 ℃和28 ℃组活性大小均基本稳定,并且两者之间无明显差异(P>0.05),而30 ℃组随时间增长呈逐渐增大趋势,并在12、48和96 h时显著大于对照组(P<0.05)。总之,在高温胁迫下,美洲鲥肝和血清中SOD活性随时间增长逐渐增大,并从48 h开始明显增大。
肝中CAT 活性大小变化如图2A 所示:24 ℃组CAT活性在实验期间基本保持稳定,大小为4.712~6.292 U/mg,而高温组美洲鲥CAT 活性受温度影响明显,28 ℃和30 ℃组CAT活性在胁迫48和96 h时均明显大于24 ℃组(P<0.05)。血清中CAT活性大小变化如图2B所示:24 ℃组CAT活性变化不大,基本维持稳定;28 ℃组CAT活性随时间增长呈现逐渐增大的变化趋势,但与对照组相比,总体增大不明显(P>0.05);而30 ℃组CAT 活性随时间增长逐渐减小,并从24 h 时开始明显小于24 ℃和28 ℃组(P<0.05),说明高温胁迫显著抑制了血清中CAT活性。
如图3 所示:高温胁迫期间,24 ℃组的肝和血清中GSH-Px 活性随时间增长基本保持稳定,分别为0.968~1.153和1.603~2.273 U/mg。28 ℃和30 ℃组的肝中GSH-Px 活性总体上随时间增长逐渐增大,其中:在胁迫48 h时,28 ℃组的GSH-Px活性显著大于24 ℃组(P<0.05),与30 ℃组间无显著差异(P>0.05);在胁迫96 h 时,28 ℃组的GSH-Px 活性与24 ℃组间无显著差异(P>0.05),而30 ℃组显著大于24 ℃(P<0.05)(图3A)。28 ℃组的血清中GSH-Px活性也随时间增长呈增大趋势,而30 ℃组随时间增长呈减小趋势,并从24 h开始均显著小于24 ℃和28 ℃组(P<0.05)(图3B)。

图2 高温胁迫对美洲鲥肝和血清中CAT活性的影响Fig.2 Effects of high temperature stress on CAT activities in liver and serum of A.sapidissima
如图4A所示:24 ℃组肝中MDA含量基本保持稳定,为0.357~0.545 nmol/mg,而28 ℃和30 ℃组随时间增长均呈先升高后降低的变化,其中在12 h时达到最大后开始降低。从6 h开始,30 ℃组MDA含量随时间增长均明显大于24 ℃组(P<0.05);28 ℃组在12 h 时明显大于24 ℃组,而之后的其他时间点虽大于24 ℃组,但均不显著(P>0.05)。如图4B所示:血清中24 ℃组的MDA含量基本保持稳定,为0.098~0.139 nmol/mg,而28 ℃和30 ℃组随时间增长均呈先升后降再升的变化趋势,并均从24 h开始MDA含量明显大于24 ℃组(P<0.05)。
2.2 高温胁迫对美洲鲥肝中AKP 和ACP 活性的影响
从图5中可看出,实验期间24 ℃组美洲鲥肝中AKP活性变化基本稳定,大小为18.448~21.090 U/g。28 ℃和30 ℃组AKP活性随时间增长具有较明显的下降趋势,从3 h时开始,除12 h外高温胁迫显著降低AKP活性,28 ℃和30 ℃组AKP活性均明显小于24 ℃组(P<0.05),但除48 h 外,28 ℃和30 ℃组间差异均不显著(P>0.05)。图6中显示:对照组24 ℃的ACP活性大小在48和96 h时略有升高,但变化不大,基本保持稳定,大小为28.186~33.293 U/g。在0~24 h范围内,28 ℃和30 ℃组的ACP活性随时间增长基本保持稳定,与24 ℃组间均无显著差异(P>0.05),但随时间继续增长,在48 和96 h 时28 ℃和30 ℃组的ACP 活性均显著低于24 ℃组(P<0.05),而这2组间无显著差异(P>0.05)。
2.3 高温胁迫对美洲鲥肝中转氨酶活性的影响
实验期间,24 ℃组AST 活性基本保持稳定,于12和24 h时略有升高,但变化不大,大小为76.591~94.589 U/g。而28 ℃和30 ℃组AST 活性随时间增长呈逐渐增大趋势,在96 h时,28 ℃和30 ℃组AST活性均显著大于24 ℃组(P<0.05),表明高温可明显提高AST活性(P<0.05),但28 ℃和30 ℃组间差异不明显(P>0.05);胁迫6 h时,30 ℃组AST活性显著小于24 ℃和28 ℃组(图7)。从图8中可以看出,ALT 活性受高温胁迫影响较明显,其中:24 ℃组的ALT 活性基本保持稳定,大小为3.730~4.354 U/g;28 ℃组ALT 活性随时间增长呈先升后降的变化趋势,在6 和24 h 时明显大于24 ℃组(P<0.05),而在48 和96 h 时明显降低,但与24 ℃组无显著差异(P>0.05);30 ℃组的ALT活性随时间增长呈现逐渐升高的趋势,受高温胁迫影响较明显,其中在48 h时ALT活性显著大于24 ℃和28 ℃组,在96 h时其活性显著大于28 ℃组(P<0.05)。
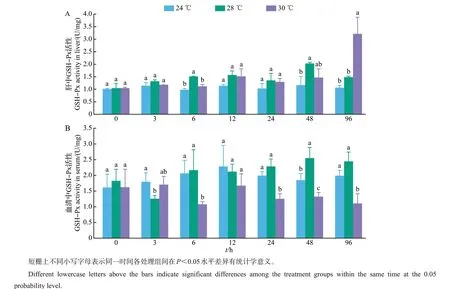
图3 高温胁迫对美洲鲥肝和血清中GSH-Px活性的影响Fig.3 Effects of high temperature stress on GSH-Px activities in liver and serum of A.sapidissima
3 讨论
3.1 高温胁迫对美洲鲥抗氧化相关指标的影响
温度作为随时间、空间而改变的外界因子,不仅对水体中诸多理化因子产生影响,而且对鱼体的正常生理活动也产生重要影响[19]。SOD、CAT和GSHPx作为生物体内重要的抗氧化酶,在生物体的自我防护系统中起着至关重要的作用,是抗氧化防御过程中的关键酶[20]。有研究表明,水温高低可直接对鱼类机体的抗氧化能力产生影响[21-22]:当鱼体受到外界高温胁迫时,由于呼吸爆发和其他免疫过程而产生过多有害的活性氧自由基,因而机体通过产生更多的抗氧化酶来清除这些活性氧自由基,从而维持细胞和机体的正常生理活动。本实验中,28 ℃和30 ℃组肝及血清中SOD均出现逐渐升高的变化趋势,这与谢明媚等[23]研究急性温度胁迫对银鲳(Pampus argenteus)幼鱼抗氧化和免疫指标影响的结果相一致。这表明高温胁迫使美洲鲥产生应激反应,迫使细胞和组织中自由基迅速增加,以致损伤细胞和组织,机体通过产生大量SOD来应对过量的自由基,所以美洲鲥体内SOD 活性升高。CAT、GSH-Px 活性在肝中均随时间增长逐渐升高,而在血清中表现出先升后降的趋势。带来这种变化的原因主要是高温胁迫对肝造成了一定损伤,肝中过量自由基未被清除而导致CAT 和GSH-Px 活性逐渐升高,而血液中过量的自由基逐渐被清除,所以CAT和GSH-Px活性表现出先升后降的变化。相似的研究结果还出现在中华鲟(Acipenser sinensis)[19]和虹鳟(Oncorhynchus mykiss)[24]中。
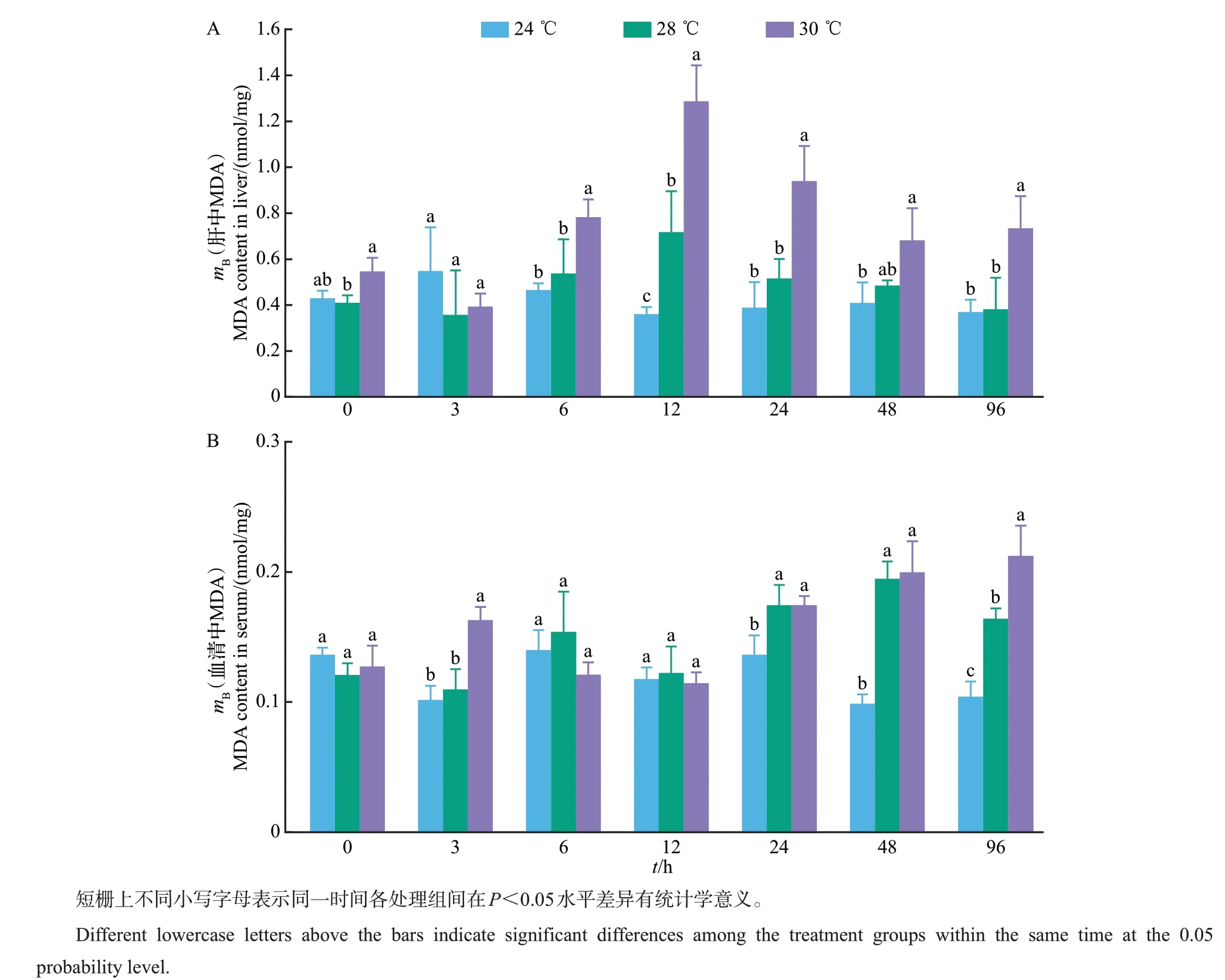
图4 高温胁迫对美洲鲥肝和血清中MDA含量的影响Fig.4 Effects of high temperature stress on MDA contents in liver and serum of A.sapidissima
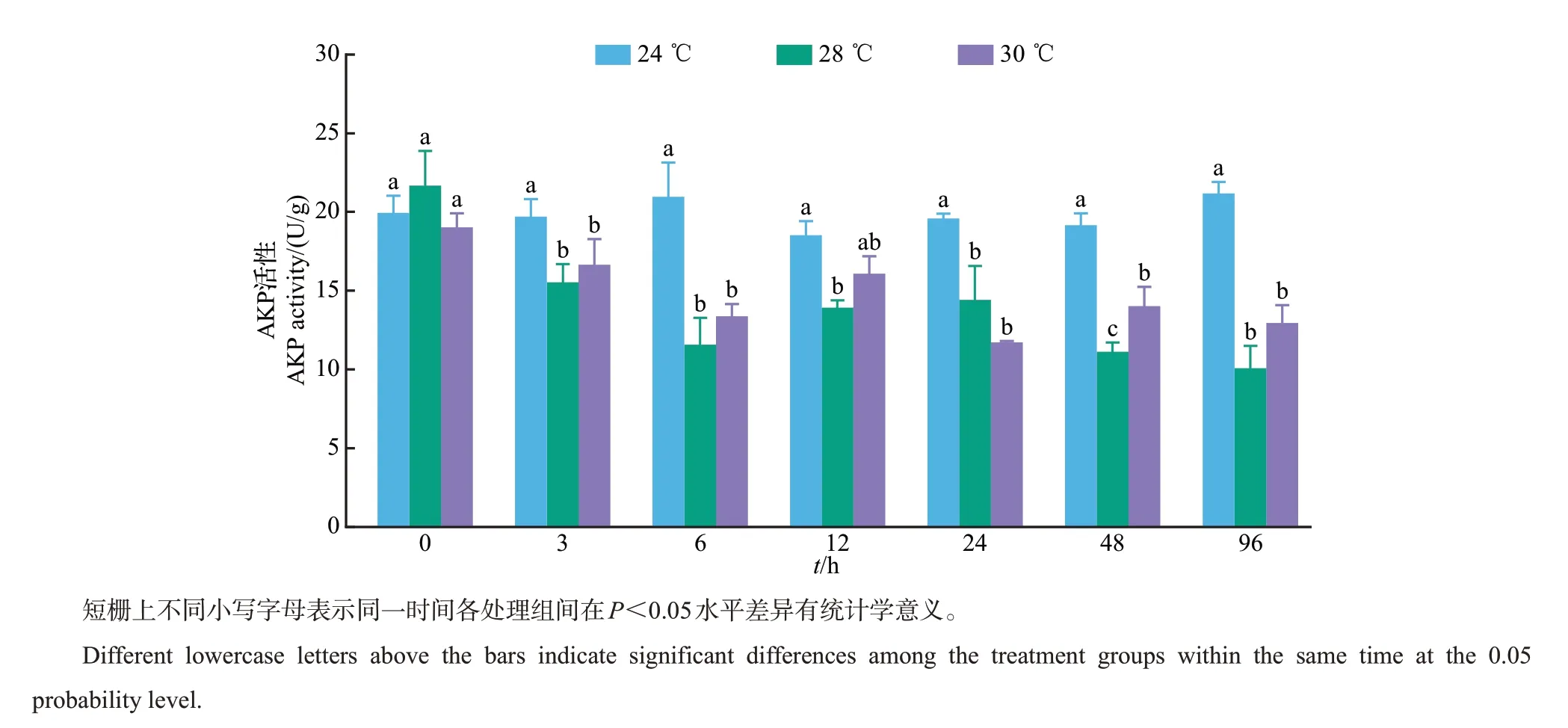
图5 高温胁迫对美洲鲥肝中AKP活性的影响Fig.5 Effects of high temperature stress on AKP activity in liver of A.sapidissima

图6 高温胁迫对美洲鲥肝中ACP活性的影响Fig.6 Effects of high temperature stress on ACP activity in liver of A.sapidissima

图7 高温胁迫对美洲鲥肝中AST活性的影响Fig.7 Effects of high temperature stress on AST activity in liver of A.sapidissima
生物体中MDA作为不饱和脂肪酸被氧化后的最终产物,已被作为一种细胞膜氧化损伤的指示物,它的产生加剧了膜的损伤[25]。因此,MDA 水平高低间接反映了组织细胞受自由基攻击的严重程度,也代表生物机体抗氧化能力水平的高低[26]。本研究中,28 ℃和30 ℃组肝中MDA含量在高温胁迫96 h 内均随时间增长表现出先升高后降低的变化,而肝中SOD、CAT 和GSH-Px 均随时间增长显著升高,这表明高温胁迫对美洲鲥肝造成了氧化损伤,导致抗氧化酶大量生成以抵抗过量的自由基。该变化趋势与谢明媚等[23]的研究结果相似,而与王伟等[25]对太平洋鳕(Gadus macrocephalus)仔稚鱼在急性温度胁迫下MDA的变化趋势不同。这可能是由实验鱼种、应激时间及实验温度等不同而造成的。在美洲鲥血清中,2个高温组MDA含量随时间增长均呈先升后降再升的变化趋势,但30 ℃组在96 h时显著大于其他2 组,这与范耘硕等[27]研究温度胁迫对大鳞副泥鳅(Paramisgurnus dabryanus)抗氧化与非特异性免疫指标影响的结果相似。这主要是因为在30 ℃的高温胁迫下,美洲鲥血清中CAT 和GSH-Px 均随时间增长显著降低,抗氧化酶活性受到显著抑制,抗氧化能力减弱,所以导致MDA 在30 ℃高温胁迫后期迅速升高。
3.2 高温胁迫对美洲鲥非特异性免疫相关指标的影响
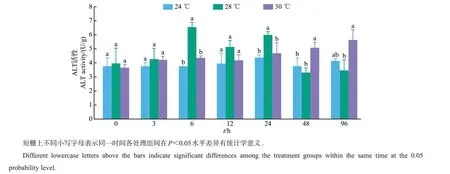
图8 高温胁迫对美洲鲥肝中ALT活性的影响Fig.8 Effects of high temperature stress on ALT activity in liver of A.sapidissima
AKP是一种磷酸单酯水解酶,在机体正常情况下特异性低,而受到外部刺激或出现病变时活性会增强,主要起到解毒剂的作用,是鱼类等生物健康的重要标志[28]。有研究表明,温度胁迫会对鱼体中的AKP 产生明显影响,如:强俊等[29]对尼罗罗非鱼(Oreochromis niloticus)幼鱼研究发现,温度胁迫下实验鱼的AKP活性呈先上升后下降的变化趋势;管标等[30]研究发现,高温胁迫下虹鳟(O. mykiss)的AKP活性较对照组明显降低,表明高温胁迫对AKP活性有抑制作用。本研究中,高温胁迫对美洲鲥的AKP活性也产生明显影响,AKP活性随时间增长而降低,并在各时间点(除12 h 外)时高温组(28 ℃和30 ℃)均显著小于对照组(24 ℃)。这说明高温抑制了美洲鲥的AKP活性,减弱了鱼体非特异性免疫能力。ACP作为生物体内重要的代谢酶,不仅参与磷酸酯和细胞消化代谢,还与参加自溶过程和免疫调节功能有关[31]。本实验中,ACP 活性在24 h 内均无明显变化,高温组与对照组均无显著差异;而24 h后,高温组ACP活性均明显降低,并均小于24 ℃对照组。这与大菱鲆[Scophthalmus maximus (L.)]体内酸性磷酸酶活性变化趋势[32]相似。表明美洲鲥可承受短时间内的高温压力,当超过一定时间后,ACP活性就会受到抑制而显著减小。因此,可认为本实验条件下的高温胁迫对美洲鲥肝造成了一定程度的损伤。AST 与ALT 是生物体中2 种重要的转氨酶,正常情况下AST和ALT存在于肝、心、肾、血液等许多器官或组织中,尤其以肝中含量最高[33]。当生物机体受到外界胁迫或发生病变时,肝中AST和ALT活性会显著升高,糖异生途径加强,通过产生葡萄糖来对抗不利环境[34];因此,测定肝中AST 和ALT 活性水平的高低,可以反映细胞膜通透性的变化,并判断肝等组织是否受到损伤[30]。本研究中,高温组AST活性随时间增长逐渐升高,前48 h内总体上无显著差异,而在96 h 时均显著大于对照组;此结果与范耘硕等[27]对大鳞副泥鳅(P. dabryanus)中AST与ALT 随温度变化的研究结果相似。这可能是因为美洲鲥受到高温胁迫后,肝中AST 活性开始升高,在短时间内有一定的调节作用,但当长时间处于高温环境下可能对肝造成一定的损伤,而导致AST 活性显著升高。ALT 在30 ℃组中活性逐渐升高,而在28 ℃组表现出先升高后降低的变化趋势,且在48 h 时,30 ℃组的ALT 活性显著大于28 ℃组和24 ℃对照组,在96 h 时,其活性显著大于28 ℃组。相似结果也出现在对虹鳟(O.mykiss)[30]的研究中。这主要是因为在28 ℃条件下,ALT活性通过机体的调节可以恢复到正常水平,未对肝细胞造成破坏,而30 ℃可能对肝产生了显著影响,致使ALT活性显著升高。因此,在30 ℃高温胁迫下美洲鲥肝细胞可能受到了一定程度的损伤,但未造成永久性破坏。
4 结论
在本实验条件下,连续96 h的高温胁迫会显著抑制美洲鲥抗氧化能力与非特异性免疫能力,尤其是高温条件(30 ℃)下对其非特异性免疫相关酶活性会造成抑制作用,可能对肝造成一定程度的损伤。由于美洲鲥对高温条件的耐受能力较弱,因此,在实际养殖生产中应避免高温,建议养殖温度控制在28 ℃以下。
