背角无齿蚌幼蚌心率对镉暴露胁迫的响应及预警评估*
2021-03-19陈修报王安琪郑浩然刘洪波
陈修报 王安琪 郑浩然 刘洪波 杨 健,①
(1. 中国水产科学研究院淡水渔业研究中心 中国水产科学研究院长江中下游渔业生态环境评价和资源养护重点实验室 无锡 214081;2. 南京农业大学无锡渔业学院 无锡 214081)
重金属镉(Cd)具有来源广、积累性强、难以降解、易于沿食物链发生生物放大作用等特点,被列为对水生生物和人类危害最大的优先控制污染物之一(Campbell, 2006; 刘天红等, 2015)。需要高度关注的是,我国渔业生态环境Cd 污染形势仍较为严峻(张聪等, 2018),其中,江河等天然重要渔业水域中的Cd超标率为1.5%,国家级内陆水产种质资源保护区的Cd 超标率达2.7% (农业部等, 2015),而水产品中的Cd 残留现象大量存在,如长三角地区池塘养殖水产品中Cd 的超标率甚至高达100% (和庆等, 2017)。因此,亟需对渔业水环境Cd 污染动态进行早期预警和有效监测。
贝类因具有运动能力差、对污染物的高积累性和低代谢性等特点,被证实为评价水环境污染的理想指示生物(崔正国等, 2015; Farrington et al, 2016)。背角无齿蚌(Anodonta woodiana)作为“淡水贝类观察”研究体系的专用指示生物(Yang et al, 2008),已成功预警和监测Cd 等污染状况(Liu et al, 2010; Chen et al,2019)。利用贝类对水环境Cd 污染的预警监测,可分为“致死性”(如分离出整个软组织,并测定其中Cd含量)和“非致死性”(如分析心率等生理指示的响应特征) 2 类方法(Liu et al, 2016; 孙珊等, 2017),而后者越来越受到重视(Liu et al, 2016; Bakhmet et al,2019)。值得注意的是,前人基于贝类心率对Cd 污染监测多集中于应用成体(贝壳不透明),需要在贝壳上靠近心脏部位钻一个洞(开一个“窗口”)才能观察到心脏跳动(Cândido et al, 2006; Liu et al, 2016),这会对贝类产生应激影响并导致污染物从“窗口”渗透进入软组织,进而影响到贝类真实的心跳规律。本研究发现,背角无齿蚌早期幼蚌对Cd 的胁迫非常敏感(陈修报等, 2017),且贝壳为透明或半透明状态,能够在非致死或非损伤条件下清晰观察到心率(Chen et al, 2015)。
本研究尝试利用自主开发的相关研究专用“标准化”背角无齿蚌(陈修报等, 2017)的早期幼蚌(即从心跳清晰可见直至贝壳不再透明发育期的个体)为模式生物,研究其正常的心率规律,并探索其对水环境Cd 毒性的应答特征,以期为从新角度开发基于淡水贝类的早期生物预警和监测技术提供理论支撑。
1 材料与方法
1.1 早期幼蚌采集与心率检测
在“标准化”背角无齿蚌的人工繁育过程中(Chen et al, 2015),连续采集从心跳清晰可见直至贝壳不再透明的典型生长阶段的早期幼蚌(图1):EJ1 [25 日龄,壳长为(1.5±0.1) mm,平均值±标准差,下同,n=30]、EJ2 [55 日龄,壳长为(10.5±0.6) mm,n=30]、EJ3[70 日龄,壳长为(20.4±0.9) mm,n=30]和EJ4 [85 日龄,壳长为(30.0±2.0) mm,n=30]。人工繁育方法及水体理化指标参见Chen 等(2015)。
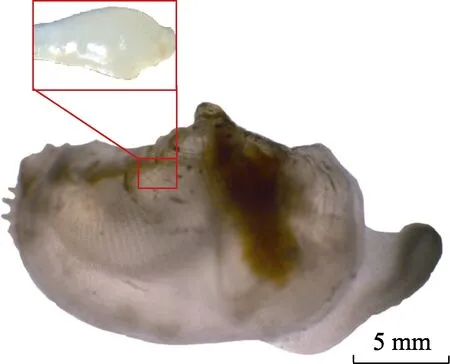
图1 “标准化”背角无齿蚌的早期幼蚌(□示心脏)Fig.1 The early juvenile of “standardized” A. woodiana(the square shows the heart)
鉴于背角无齿蚌的活动强度存在一定的昼夜节律变化(早晨最低,傍晚最大)(吴庆龙等, 2005),为了确认早期幼蚌的心率是否具有日间分时变化差异,分别在09:00~10:00 和16:00~17:00 采集同一批次的早期幼蚌(n=30),依据Pandolfo 等(2009)对淡水贝类幼蚌心率的观察方法,用解剖镜直接观察不同生长阶段早期幼蚌的心率。根据Liu 等(2016)的统计方法,心率定义为1 min 观察到的心跳次数。
1.2 Cd 暴露实验
根据淡水贝类毒理学实验规范(ASTM, 2006;陈修报等, 2017),参考我国《渔业水质标准》(GB11607-89)规定的Cd 限量(0.005 mg/L)和作者前期研究获得的 Cd2+对背角无齿蚌幼蚌的安全浓度(0.45 mg/L)(陈修报等, 2017),用人工配制软水(ASTM,2006)和CdCl2(分析纯,国药集团化学试剂有限公司)配制5 个Cd2+理论浓度梯度:0 (对照组)、0.0025、0.005、0.025、0.1 和0.5 mg/L;实测Cd2+浓度分别为0、0.0026、0.005、0.026、0.11 和0.55 mg/L。Cd2+实测浓度和理论浓度的偏差均<10%,本研究采用理论浓度对结果进行分析和讨论。对照组和暴露组各设置3 个平行。
综合考虑不同生长阶段早期幼蚌在自然水环境中的存活率及监测适宜规格,本研究选取EJ4 阶段的早期幼蚌作为暴露对象。用500 ml 玻璃培养皿作实验容器,溶液200 ml,每个培养皿加入5 个幼蚌,每24 h 全部更换溶液以保持Cd2+浓度稳定,实验期间不投饵。实验于贝类重金属暴露系统(上海海圣水族设备厂)中进行,水温保持在(20±1)℃,16 h 光照︰8 h 黑暗,光照强度为1000 lx。实验持续96 h,并于24、48、72 和96 h 取样,观察心率。心率的观察和统计方法同1.1。
1.3 统计分析
所得数据运用SPSS 22.0 统计软件分析。应用Paired t-test 比较不同生长阶段早期幼蚌的心率差异性,以及Cd 暴露期间的早期幼蚌心率差异水平。应用Pearson 等级相关系数分析心率与壳长、日龄及Cd暴露浓度、暴露时间之间的相关性,并用回归分析变量之间的关系。P<0.05 表示差异水平或相关性显著。
2 结果
2.1 早期幼蚌的心率
不同生长阶段的“标准化”背角无齿蚌早期幼蚌的心率见表1。EJ1、EJ3 和EJ4 的心率在09:00~10:00和16:00~17:00 之间保持一致(P>0.05),只有EJ2 在前期的心率略高于下午(P<0.05)。随着日龄的增加或壳长的增长,早期幼蚌的心率逐渐降低(表1),心率(H)与日龄(D)和壳长(L)之间均呈显著线性负相关(P<0.05; 图2)。
2.2 Cd 对早期幼蚌心率的影响
如图3所示,暴露期间,对照组(0)、0.025和0.1 mg/L Cd2+暴露组的“标准化”背角无齿蚌早期幼蚌(EJ4)的心率总体保持一致(P>0.05);0.0025 mg/L Cd2+暴露组的心率在72和96 h出现显著降低(P<0.05);0.005 mg/L Cd2+暴露组的心率在72 h出现显著降低(P<0.05);0.5 mg/L Cd2+暴露组的心率在96 h出现显著降低(P<0.05)。心率(H)和暴露时间(T)仅在0.0025和0.5 mg/L Cd2+暴露组间呈显著线性负相关(P<0.05)。
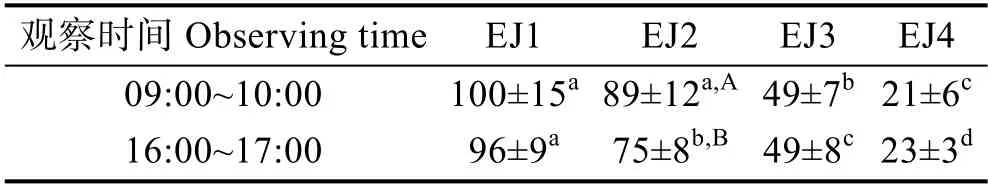
表1 “标准化”背角无齿蚌早期幼蚌的心率(次/min; Mean±SD; n=30)Tab.1 Heart rates of early juveniles of “standardized”A. woodiana (beats/min; Mean±SD; n=30)
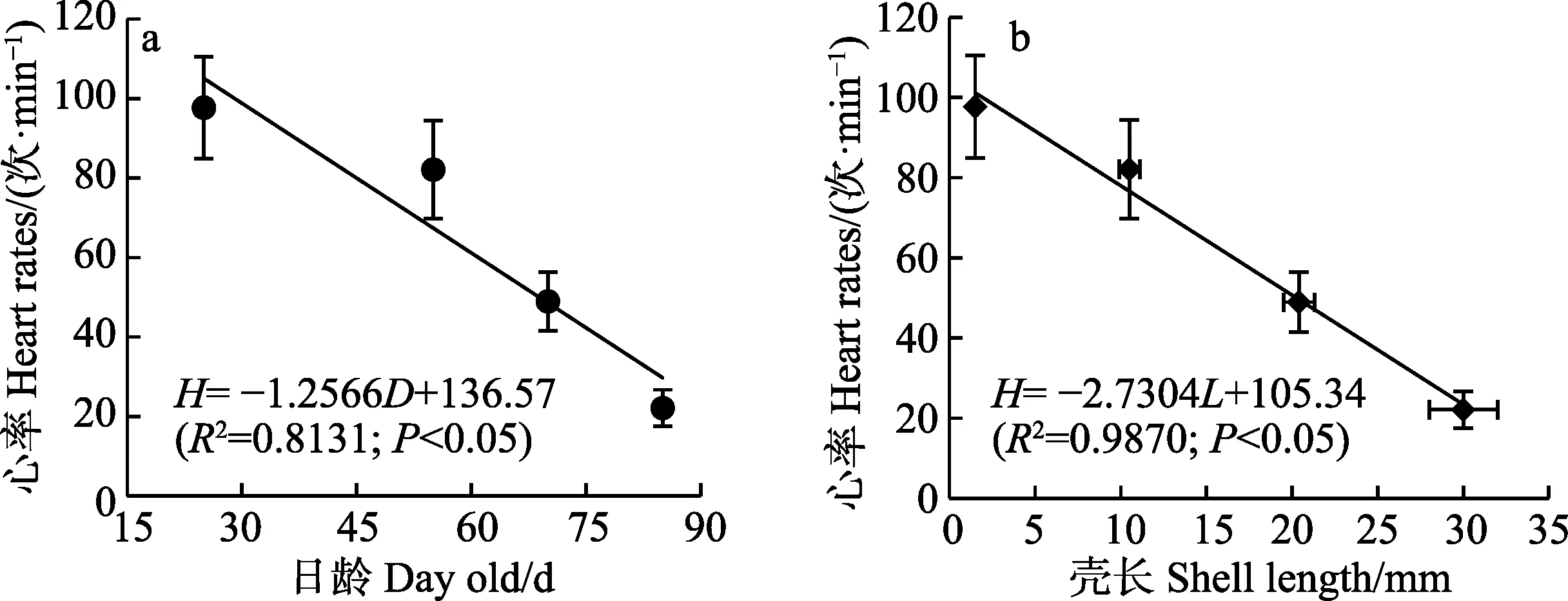
图2 “标准化”背角无齿蚌早期幼蚌心率与日龄(a)和壳长(b)之间的关系(n=60)Fig.2 Relationships between heart rates and day old (a) as well as shell length (b)of early juveniles of “standardized” A. woodiana (n=60)
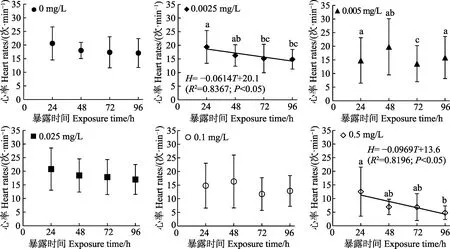
图3 “标准化”背角无齿蚌早期幼蚌心率(n=15)与Cd 暴露时间的关系Fig.3 The relationship between heart rates of early juveniles of “standardized” A. woodiana (n=15) and Cd exposure time
不同暴露时间下,各组别早期幼蚌(EJ4)的心率变化见图4。其中,暴露24 h 的0.005、0.1 和0.5 mg/L Cd2+暴露组的心率显著低于对照组(P<0.05);暴露48 h的0.5 mg/L Cd2+暴露组的心率显著低于对照组和其他暴露组(P<0.05);暴露72 h 的0.1 mg/L Cd2+暴露组的心率显著低于对照组(P<0.05),0.5 mg/L Cd2+暴露组的心率显著低于对照组和其他暴露组(P<0.05);暴露96 h 的0.5 mg/L Cd2+暴露组的心率显著低于对照组和其他暴露组(P<0.05)。贝类对Cd2+暴露的响应较为敏感,容易引起同一组别中心率变幅较大(Liu et al,2016)。尽管如此,Paired t-test 检验结果显示,随着Cd2+暴露浓度的增加,6 个组别EJ4 的心率(n=15)仍表现为降低趋势(图4),且Pearson 等级相关系数和回归分析显示,6 个组别EJ4 的心率(H; n=15)和Cd2+暴露浓度(C)之间呈显著的线性负相关(P<0.05; 图4)。
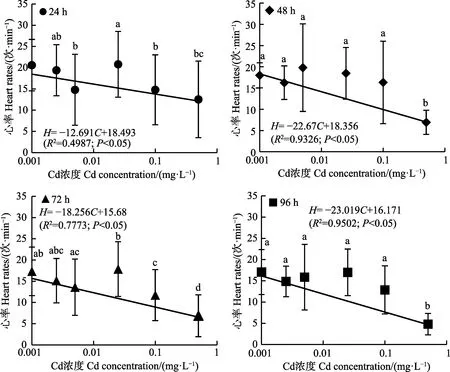
图4 “标准化”背角无齿蚌早期幼蚌心率(n=15)与Cd 浓度之间的关系Fig.4 The relationship between heart rates of early juveniles of “standardized”A. woodiana (n=15) and Cd concentrations
3 讨论
3.1 早期幼蚌心率规律
贝类心率是反映新陈代谢强度的重要指标(Liu et al, 2016; Bakhmet et al, 2019)。心率变化与生物自身因素(如年龄、规格、昼夜变化)和外界环境因素(如水体理化因子、藻类丰富度)紧密相关(Bakhmet et al,2005、2019; Liu et al, 2016)。本研究在观察不同生长阶段早期幼蚌的心率规律时,所采集的样本来源相同、所处的外界环境因素一致,因此,心率的差异应归因于生物自身因素不同。
本研究为背角无齿蚌相关心率重金属胁迫应答方面的首次探索。结果发现,早期幼蚌的心率总体无明显的日变化(表1),表明其新陈代谢强度总体保持一致。然而,早期幼蚌心率与日龄、壳长之间均呈显著的线性负相关(图2),这与紫贻贝(Mytilus edulis)的心率变化趋势相似(Sukhotin et al, 2017)。日龄和壳长小的幼蚌比日龄和规格大的幼蚌的心率快,这可能与前者的新陈代谢(如生长速率、滤水率)较强有关。Chen等(2015)研究发现,30~60日龄(壳长为1.9~9.1 mm)背角无齿蚌的相对生长率是60~90日龄(壳长为9.1~28.7 mm)的1.4倍,证实日龄和壳长小的幼蚌的代谢强度明显高于日龄和规格大的幼蚌。贝类等水生生物的滤水率与心率总体呈正相关(Grace et al, 1987; 郭鹄飞等, 2018)。背角无齿蚌的滤水率随规格的增大而逐渐降低(彭建华等, 2004),也支持了本研究的上述观点。随着日龄和规格的增加,贝类中膜磷脂的不饱和程度降低,从而降低膜的离子通透性,促使新陈代谢效率提高,因而导致心率降低(Sukhotin et al, 2017)。
3.2 早期幼蚌心率对Cd 毒性的响应及预警评估
贝类通过摄食和滤水作用主动或被动的吸收水环境中的Cd (Farris et al, 2007; Pernice et al, 2009)。之后,经过易化扩散、主动运输或内吞作用,Cd 在有机体内进一步转运和分配(Farris et al, 2007)。心脏作为贝类循环系统的最重要器官,是Cd 毒性作用的关键“靶器官”之一(Bakhmet et al, 2012)。
本研究显示,背角无齿蚌早期幼蚌(EJ4)的心率和Cd2+暴露时间之间的“时间–效应”关系总体不明显(图3)。Martinović等(2015)将紫贻贝暴露于4.5 mg/L Cd2+(40 μmol/L CdCl2)水体中,结果显示,经过24、48和72 h后,紫贻贝的心率未产生明显变化,与本研究结果相吻合。这可能是由于较大规格的背角无齿蚌(如EJ4)已形成完善的解毒机制,不仅能够通过紧闭双壳、减少滤水率和呼吸率以减少对Cd2+的吸收(Farris et al, 2007),还能够诱导金属硫蛋白(MT)的合成来络合Cd2+进行解毒(Farris et al, 2007)。例如,Li等(2015)发现,Cd2+暴露会引起背角无齿蚌鳃和外套膜中MT显著增加,且MT含量与Cd积累量呈线性正相关,从而在短时间内避免Cd2+对心率的影响。
值得注意的是,早期幼蚌(EJ4)的心率和Cd2+暴露浓度之间具有显著的“剂量–效应”关系(图4)。本研究中,心率和暴露浓度之间呈线性负相关(图4),这与牛蛙(Rana catesbiana)心率与水体中Pb2+浓度呈负相关(高波等, 2015),罗纹贻贝(Geukensia demmissa)心率与水体中多氯联苯(PCB)、多环芳烃(PAH)浓度呈负相关(Galloway et al, 2002),香港巨牡蛎(Crassostrea hongkongensis)心率与水体中溶解性重金属(Cd、Cr、Cu、Ni、Pb 和Zn)总浓度呈负相关的趋势(Liu et al,2016)一致。当Cd2+的积累量超过贝类解毒能力时,Cd2+就会通过与蛋白质和钙基因互作并产生氧化损伤,对有机体(如心脏)产生毒性作用(Moulis, 2010),导致心率降低,研究背角无齿蚌早期幼蚌的心跳频率对Cd2+浓度的毒性效应特征,有潜力应用于渔业水环境Cd 污染的预警及监测。
综上所述,本研究首次探索和阐明了“标准化”背角无齿蚌早期幼蚌的心率规律及其对水环境Cd2+暴露的响应特征。早期幼蚌的心率总体没有明显的日变化,心率与日龄、壳长之间呈显著的线性负相关。早期幼蚌的心率对Cd2+较为敏感,虽然心率和Cd2+暴露之间未表现出明显的“时间–效应”关系,但存在显著的“剂量–效应”关系。根据早期幼蚌心率对Cd2+的响应特征,有潜力应用于渔业水环境Cd 污染的预警及监测。由于贝类心率可能会受到水温、pH、水体硬度等因子的影响,在今后的研究中还需要进一步较为系统地探究心率与水质因子之间的关联性。
