超声微泡联合骨髓间充质干细胞移植对脊髓损伤大鼠的神经保护作用研究
2021-03-18陈宇张智汪凡栋宋昭君刘元彬唐龙廖伟郑佳状
陈宇 张智 汪凡栋 宋昭君 刘元彬 唐龙 廖伟 郑佳状△
脊髓损伤(Spinal Cord Injury,SCI)是由外创伤引起的中枢神经系统疾病[1]。大多数脊髓损伤伴有生理生化异常和结构损伤,会导致神经损伤和神经再生,从而引起严重的运动和感觉通路功能障碍,且这些影响均是不可逆的[2]。SCI创伤后立即引起原发性损伤,后续发展为继发性损伤,此时受损神经组织发生一系列的病理过程,包括氧化应激、炎症反应、细胞凋亡与自噬等[3-4],使得神经功能出现障碍。通过预防或减轻继发性损伤来尽可能地保留受损组织或挽救脊髓中受损细胞是脊髓损伤治疗的关键措施。
骨髓间充质干细胞(BMSCs)来源于骨髓,具有多向分化的潜能,目前已运用于多种组织修复中。BMSCs分泌的神经营养因子可以为神经组织和神经元提供营养和保护。例如脑源性神经营养因子(BDNF)在轴突生长和神经元分化中起重要作用,可以促进BMSCs的神经元分化和神经组织再生[5]。超声介导的微泡破坏可增强向肿瘤的药物输送,是一种新型、可耐受的靶向治疗策略,超声技术中探头的中心频率通常为1~5 MHz,声压范围为0.1~0.5 MPa,从而引起声空化。作为气泡的核心,微泡在超声场中不断压缩、膨胀和塌陷,从而增强了声音的气泡效应并产生了一系列机械效应,增加了细胞膜和微血管的渗透性,从而有助于药物递送[6-8]。因此,本研究通过构建大鼠SCI模型,观察BMSCs和超声微泡单独或联合移植对脊髓损伤后神经恢复的作用,为BMSCs移植治疗脊髓损伤提供参考。
1 材料与方法
1.1 分组与处理
将造模成功的50只大鼠随机分为5组,包括:假手术组、模型组、超声微泡组、BMSCs 组、超声微泡+BMSCs组。制模后第2天,超声微泡组和超声微泡+BMSCs组大鼠经尾静脉注入1 mL浓度约2×108个/mL的超声微泡溶液,并经胸诊断超声辐照10 min(频率5 MHz,机械指数为1.3,辐照5 s),每次间隔5 s,第4天和第6天重复超声辐照微泡操作,共3次。同时制模后第2天假手术组、模型组大鼠经尾静脉注入1 mL生理盐水,BMSCs 组和超声微泡+BMSCs组大鼠经尾静脉注入干细胞悬液(1×107个细胞混悬于2 mL PBS中)于2 min内缓慢注入。
1.2 动物模型制作
参照文献[9]方法构建SD大鼠SCI模型。腹腔注射10%水合氯醛麻醉大鼠,将大鼠俯卧固定于实验台上,碘伏消毒后,沿大鼠背部正中逐层皮肤组织,暴露T9~T11椎板,在T10锥板显露脊髓,做长约2.5 cm 的正中切口,分离椎旁肌肉,将T9~T11的棘突和椎板完全切除暴露脊椎,在实验台上安装固定打击器,将直径为2 mm 的10 g打击锤从5 cm的高度处自由落下撞击T10脊髓,击打后迅速移开打击锤,观察锥击瞬间鼠尾痉挛性摆动,双后肢及躯体出现回缩扑动视为造模成功。大鼠伤口处常规消毒表面,并逐层缝合皮肤和肌肉,将其放置在37 ℃动物饲养箱内直至麻醉完全清醒,每天早晚对大鼠的膀胱进行按摩,以便于排尿,连续3 d 给予大鼠腹腔注射青霉素预防感染。假手术组大鼠仅暴露脊柱,不进行锥击 T10脊髓。
1.3 实验材料
DMEM培养液、胰蛋白酶购自美国Gibco公司,声诺维超声微泡造影剂购于意大利博莱科公司,苏木精-伊红(HE)染色试剂和尼氏染色试剂购自北京康为世纪生物公司,IL-1β,TNF-α,IL-6 ELISA试剂盒购自上海碧云天生物研究所,RNA 提取试剂盒、反转录及实时定量 PCR试剂盒均购于日本TaKaRa 公司,抗体Nestin和GFAP购自美国Santa Cruz 公司,Alexa Fluor 488标记山羊抗兔IgG与Alexa Fluor 594标记山羊抗小鼠IgG购自美国 Cell Signaling公司。
1.4 细胞培养与分离
脱臼法处死SD大鼠,在无菌条件下分离取出大鼠的股骨和胫骨,应用DMEM培养液冲洗骨髓腔,收集骨髓冲洗液,尼龙网过滤,缓慢加入等体积的Percoll分离液(1.077 g/mL),在离心机中以2 000 r/min离心20 min,收集细胞,PBS洗涤后再次离心,弃上清,用含10%胎牛血清的DMEM培养液重悬,按1×106/mL的密度接种于培养瓶内,置于37 ℃ 5% CO2的培养箱内培养。48 h后更换培养液,将有粘附于培养底壁的细胞弃掉。之后每3 d更换1次培养液,当细胞基本长满瓶底壁时,弃去培养液,PBS洗涤,滴加0.25%胰蛋白酶消化细胞,并以1∶2比例传代,待细胞融合度达到80%后,继续消化并传代。
1.5 BBB评分
分别于术后第1,7,21天对各组大鼠的后肢运动功能进行BBB(Basso Beattie and Bresnahan)评分[10],分为22个等级。评分均采用双人双盲独立观察与记录,对实验结果进行平均以减少误差。
1.6 HE染色
评分结束后,采用10%水合氯醛麻醉大鼠并处死。其中,5只大鼠脊髓组织标本置于4%多聚甲醛中固定,另外5只大鼠脊髓组织标本在液氮迅速冷冻后,于-80 ℃下保存。将脊髓组织经4%多聚甲醛固定后,常规石蜡包埋,切成约4 μm 的切片,进行HE染色。将石蜡切片置于55 ℃烤箱烘烤30 min,二甲苯脱蜡,酒精水化,苏木精染色液染色5 min,伊红染色液染色1 min,PBS洗涤后以梯度酒精脱水,二甲苯中透明10 min,中性树胶封片,光学显微镜下观察脊髓组织病理损伤程度。
1.7 ELISA 法
取100 mg脊髓组织,加入裂解缓冲液(pH7.4)后研磨匀浆,4 ℃低温离心机中以1 500 r/min离心15 min,获取上清液,根据ELISA试剂盒检测脊髓组织中IL-1β,TNF-α,IL-6的表达,操作步骤按照试剂盒说明书进行,用酶标仪检测450 nm处吸光度值,并计算各因子含量。
1.8 尼氏染色
将固定后的脊髓组织进行常规石蜡包埋,切成30 μm厚的切片,蒸馏水洗涤,梯度酒精脱水,尼氏染色检测尼氏体形态变化。将切片浸入0.1%甲苯酚紫溶液染色5 min,蒸馏水洗涤,使用乙醇脱水分化,二甲苯中透明5 min,中性树胶封片,光学显微镜下观察神经元内尼氏小体形态学变化。
1.9 免疫荧光染色
将骨髓组织石蜡切片置于室温下干燥2 h,PBS洗涤后,滴加0.3% TritonX-100 于37 ℃下孵育15 min,PBS洗涤后,加入5%山羊血清封闭1 h,之后加入稀释后的一抗抗体Nestin(1∶500)和GFAP(1∶500),4 ℃ 孵育过夜,次日PBS洗涤,加入相应的稀释的荧光二抗(1∶250),37 ℃ 孵育2 h,PBS再次洗涤,加入DAPI染色10 min,中性树胶封片,在荧光显微镜下观察拍照,使用ImageJ2x软件对荧光图片进行测定分析,记录染色阳性区域面积占总面积的百分比。
1.10 实时荧光定量PCR
将保存于-80 ℃冰箱的脊髓组织取出并剪碎,用RNA 提取试剂盒提取总RNA,紫外分光光度计测定RNA的纯度和浓度,根据逆转录试剂盒进行操作将RNA转录成cDNA,通过实时荧光定量PCR试剂盒进行qRT-PCR实验,以 GAPDH 作为内参,检测BDNF,NT3,Caspase-3,Bax,Bcl-2 mRNA 的表达情况,PCR反应条件为:95 ℃预变性3 min,95 ℃变性20 s,60 ℃ 退火 15 s,72 ℃ 延伸 45 s,循环 40 次,实验重复 3 次。结果采用2ΔΔCt法计算各基因的表达水平。采用Primer Premier5软件设计基因引物序列(见表1)。

表1 qRT-PCR引物序列
1.11 统计学分析

2 结果
2.1 各组大鼠不同时间点BBB评分比较
对各组大鼠进行BBB评分的检测结果显示:在术后第1,7,21天,模型组、超声微泡组、BMSCs组和超声微泡+BMSCs组大鼠BBB评分均显著低于假手术组,差异有统计学意义(P<0.05)。术后第1天超声微泡组、BMSCs组和超声微泡+BMSCs组大鼠BBB评分与模型组差异无统计学意义(P>0.05 );术后第7天和第21天,超声微泡组、BMSCs组和超声微泡+BMSCs组大鼠BBB评分与模型组比较显著增加,差异有统计学意义(P<0.05),且超声微泡+BMSCs组大鼠BBB评分显著高于超声微泡组和BMSCs组,差异有统计学意义(P<0.05),见表2。

表2 各组大鼠术后第1,7,21天BBB运动功能评分比较
2.2 各组大鼠检测脊髓组织形态学变化
HE染色结果显示:假手术组脊髓组织结构完整,无明显炎症细胞浸润现象;模型组脊髓组织结构明显损伤,出现脊髓充血、水肿等现象,脊髓空洞较大,炎症细胞浸润增多;超声微泡组、BMSCs组和超声微泡+BMSCs组脊髓组织病理损伤较模型组明显得到改善,炎症细胞浸润得到抑制,见图1。

图1 HE染色检测大鼠脊髓组织形态学变化(×100)
2.3 各组大鼠脊髓组织中炎性因子表达比较
ELISA检测结果显示:与假手术组比较,模型组、超声微泡组、BMSCs组和超声微泡+BMSCs组脊髓组织中IL-1β,TNF-α及IL-6含量均显著增加(P<0.05);与模型组比较,超声微泡组、BMSCs组和超声微泡+BMSCs组中IL-1β,TNF-α及IL-6含量均显著减少(P<0.05),且超声微泡+BMSCs组中IL-1β,TNF-α及IL-6含量较超声微泡组和BMSCs组显著减少(P<0.05),见表 3。

表3 各组大鼠脊髓组织中IL-1β,TNF-α及IL-6含量比较
2.4 各组大鼠脊髓组织中尼氏小体形态观察比较
尼氏染色结果显示:假手术组脊髓组织中尼氏小体形态清晰,模型组尼氏小体出现模糊不清、变小甚至消失的现象;超声微泡组、BMSCs组和超声微泡+BMSCs组脊髓组织中尼氏小体形态有所恢复,融合现象减少,且超声微泡+BMSCs组比超声微泡组和BMSCs组尼氏小体融合更少,形态恢复更为明显,见图2。

图2 尼氏染色检测大鼠脊髓组织尼氏小体形态变化(×100)
2.5 各组大鼠脊髓组织中Nestin和GFAP表达比较
免疫荧光染色结果显示:假手术组脊髓组织Nestin和GFAP标记的荧光表达强度较高,而模型组中少有Nestin和GFAP标记的荧光表达;超声微泡组、BMSCs组和超声微泡+BMSCs组脊髓组织中Nestin和GFAP标记的荧光表达较模型组增加,且超声微泡+BMSCs组比超声微泡组和BMSCs组的表达增加更多,见图3。
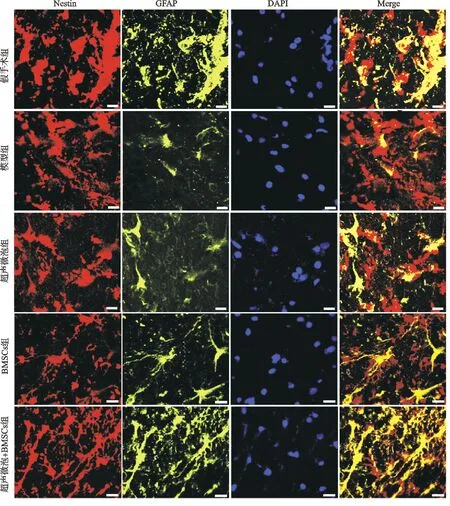
图3 免疫荧光染色检测大鼠脊髓组织Nestin和GFAP表达(×200)
2.6 各组大鼠脊髓组织中BDNF,NT3,Caspase-3,Bax及Bcl-2 的mRNA表达比较
qRT-PCR检测结果显示:与假手术组比较,模型组、超声微泡组、BMSCs组和超声微泡+BMSCs组脊髓组织中BDNF,NT3及Bcl-2 mRNA相对表达量均显著下降,差异有统计学意义(P<0.05),Bax及Caspase-3 mRNA相对表达量显著升高,差异有统计学意义(P<0.05);与模型组比较,超声微泡组、BMSCs组和超声微泡+BMSCs组中BDNF,NT3及Bcl-2 mRNA相对表达量均显著升高,差异有统计学意义(P<0.05),Bax及Caspase-3 mRNA相对表达量显著下降,差异有统计学意义(P<0.05);同时,与超声微泡组和BMSCs组比较,超声微泡+BMSCs组中BDNF,NT3及Bcl-2 mRNA相对表达量均显著升高,差异有统计学意义(P<0.05),而Bax及Caspase-3 mRNA相对表达量显著下降,差异有统计学意义(P<0.05),见表4。

表4 各组大鼠脊髓组织BDNF,NT3,Caspase-3,Bax及Bcl-2 mRNA相对表达量
3 讨论
在脊髓损伤中由于原发性损伤已经发生,因此大多数疗法的目标是防止因继发性损伤机制而造成的损害,这种损害在初次伤害后的数小时至数周内发生,机制主要包括血管功能障碍、水肿、局部缺血、炎症、电解质转移、自由基产生和细胞凋亡[3-4]。减轻继发性损伤脊髓中受损的细胞是脊髓损伤治疗的一项措施。为了实现这一措施,有效的策略是改善病变部位的微环境,从而进一步抑制神经元的损失。
近年来,随着对SCI发病机制的进一步研究,BMSCs移植已成为SCI治疗领域的一项突破。尽管研究表明,BMSCs可以减轻损伤和促进轴突再生,但依靠干细胞在损伤区的归巢能力来治疗的疗效一般。已有研究表明,通过将目的基因与超声微泡结合后导入机体内,超声辐照后生的空化效应,可以使目的基因更容易进入细胞,实现靶向治疗的目的[11]。超声微泡可以使组织血管壁或其他屏障产生微孔,来促进血液和组织进行物质交换,使得药物更容易穿过血脊髓屏障[12]。此外,超声微泡联合干细胞移植在心肌梗死中可以促进VEGF来刺激血管新生,并改善心肌微环境[13]。本研究结果显示,在术后第7天和第21天,超声微泡组、BMSCs组和超声微泡+BMSCs组大鼠BBB评分较模型组均明显增加,且超声微泡+BMSCs组BBB评分要高于超声微泡组和BMSCs组,同时脊髓组织病理现象较模型组明显得到改善,尼氏小体形态有所恢复。因此,推测超声微泡联合BMSCs对大鼠脊髓损伤具有明显的改善作用。
脊髓受到损伤后外源性和内源性有害物质会通过血脑屏障进入中枢神经系统,从而导致一系列的并发症,严重危害脊髓损伤的恢复。脊髓损伤中继发性损伤伴随着多种病理生理机制,其中炎症反应能够大大促进脊髓损伤的发展[14]。Paterniti等[15]研究发现脊髓损伤后几小时内,促炎性细胞因子TNF-α,IL-1β和iNOS的水平明显升高;Okada[16]揭示脊髓损伤继发性损伤的级联引起病变部位的炎症反应不断扩大并扩散到周围组织,导致细胞死亡,同时抑制了组织再生与功能恢复。本研究结果显示:模型组脊髓组织中IL-1β,TNF-α及IL-6含量均增加,超声微泡组、BMSCs组和超声微泡+BMSCs组中IL-1β,TNF-α及IL-6含量均减少,且超声微泡+BMSCs组中IL-1β,TNF-α及IL-6含量较超声微泡组和BMSCs组减少更为明显。由此表明超声微泡联合BMSCs能够抑制脊髓损伤大鼠脊髓组织内炎症反应。
引起运动和感觉神经元继发性死亡最多的神经损伤之一是细胞凋亡,脊髓损伤后神经微环境失衡,细胞凋亡增加,神经细胞在中枢神经系统中起着重要作用,并参与神经炎症的发生和发展,神经细胞的死亡能够加剧神经退行性疾病。本研究发现超声微泡组、BMSCs组和超声微泡+BMSCs组脊髓组织中Nestin和GFAP标记的荧光表达较模型组增加,且超声微泡+BMSCs组比超声微泡组和BMSCs组的表达增加更多。Nestin是神经干细胞的标志性蛋白,GFAP通常被用于鉴定分化的星形胶质细胞。此外,本研究结果还显示:超声微泡组、BMSCs组和超声微泡+BMSCs组中BDNF,NT3及Bcl-2 mRNA相对表达量较模型组明显升高,Bax及Caspase-3 mRNA相对表达量下降,且超声微泡+BMSCs组中这些基因表达升高或下降程度较超声微泡组和BMSCs组更为明显。BDNF是中枢神经系统中广泛表达的神经营养因子,具有促进神经元分化、增殖和成熟的作用,也是突触可塑性和记忆形成的主要驱动力[5,17]。NT3是神经营养因子家族中的一个活性营养因子,可以特异性作用于急性受损的脊髓组织,以维持神经元存活,促进增殖和分化,诱导神经轴突生长并促进神经损伤的修复[18]。Bcl-2具有抑制凋亡的功能,可通过影响线粒体膜的通透性来调控细胞凋亡,而Bax可以与Bcl-2结合形成异二聚体,从而促进细胞凋亡。在线粒体凋亡途径中,释放到胞浆中的Cyt-c能够与凋亡诱导因子相互作用激活Caspase,其中Caspase-3是多种细胞凋亡途径中的关键因子之一[19]。
综上所述,本实验发现超声微泡联合骨髓间充质干细胞对大鼠脊髓损伤发挥着神经保护作用,这对超声微泡联合BMSCs临床治疗脊髓损伤提供了实验依据,并对全面研究脊髓损伤的修复机制具有重要意义。
致谢 感谢川北医学院基础医学院刘天桥老师在动物实验中给予的指导和帮助。
