新鲜羌活挥发油的成分分析以及抗氧化和抑菌活性探究
2021-03-18王小云脱聪聪黄志芸丁旭周瑫史金涵俞树良霍归国张继
王小云,脱聪聪,黄志芸,丁旭,周瑫,史金涵,俞树良,霍归国,张继,3*
1(西北师范大学 生命科学学院,甘肃 兰州,730070)2(甘肃省特色植物有效成分制品工程技术研究中心,甘肃 兰州,730070)3(西北师范大学 新农村发展研究院,甘肃 兰州,730070)
羌活(NotopterygiumincisumTing ex H.T.Chang)为伞形科多年生植物,主要分布在我国云南、四川、甘肃和青海一带,在解表散寒、祛风除湿和止痛等方面功效俱佳[1-2]。关于羌活挥发油组成的研究已经十分普遍,但这些研究主要集中于干燥羌活或中成药羌活所得挥发油的成分研究[3-7]。李春丽等[7]研究了不同采摘期的羌活挥发油的成分差异,但他们对于羌活样品仍然采用了干燥的处理方式。有研究表明是否干燥与不同的干燥方式对中草药原料的成分有很大的影响[8]。
红外光谱作为一种绿色、便捷的分析手段,因其不需要繁琐的样品处理,已广泛应用于构建各类挥发油的红外指纹图谱[9-12]。挥发油的抑菌和抗氧化性能是评价其生物活性的主要方法。刘景坤等[13]报道了羌活地上部分提取物对3种农业病原真菌(番茄早疫病原菌、灰葡萄孢菌和尖孢镰刀菌)具有明显的抑制作用。研究表明,羌活挥发油在关节消炎及镇痛方面具有显著的效果[5-6],羌活种子挥发油具有一定的抗氧化活性[14]。然而,关于新鲜羌活挥发油的组成、抗氧化和抑菌活性研究十分缺乏。
本文以云南省丽江市生长期内的新鲜羌活茎叶为原料,未经任何干燥处理,利用水蒸汽提取法获得新鲜羌活挥发油,并利用GC-MS鉴定其成分,利用傅里叶红外光谱(Fouier transform infrared,FT-IR)构建其红外指纹图谱。研究新鲜羌活挥发油在生物活性方面的抗氧化潜力和抑菌活性,为羌活的科学评估以及应用方向提供理论依据。
1 材料和方法
1.1 材料和仪器
新鲜羌活(NotopterygiumincisumTing ex H.T.Chang),云南丽江翠森茂生物科技有限责任公司;KBr、乙醚(分析纯),中华试剂网。
HP6890/5973型气相色谱-质谱联用仪,美国Hewlett-packard 公司; Bluestar紫外可见光分光光度计,北京莱伯泰科仪器有限公司; is10傅里叶红外光谱测定仪,美国Thermo Fisher 公司;WFX-210原子吸收分光光度计,上海皖宁精密科学仪器有限公司。
1.2 实验方法
1.2.1 新鲜羌活挥发油的提取
精密称取1 kg新鲜羌活置于不锈钢锅中,料液比1∶12(g∶mL),浸泡3 h,水蒸汽提取12 h,直至挥发油含量不再增加。新鲜羌活的挥发油产率为2.4%。
1.2.2 挥发油的GC-MS分析
参照刘卫根等[1]的GC-MS测试条件并稍作改进。GC条件:初始温度60 ℃,以10 ℃/min升至210 ℃,持续2 min,随后4 ℃ /min升至280 ℃,持续2 min。进样模式为分流进样,进样量1 μL,分流比20∶1。
1.2.3 挥发油的FT-IR图谱测定
参照赵玉丛等[9]的方法,利用FT-IR测定羌活挥发油的指纹特征吸收峰。将光谱纯KBr压片,采集背景。吸取少量挥发油滴于KBr压片表面,轻摇,使挥发油分布均匀形成薄层,在400~4 500 cm-1范围内扫描挥发油,扫描次数累计至32次,分辨率0.74 cm-1。
1.2.4 挥发油的抑菌活性及其机制探究
采用滤纸片扩散法考察新鲜羌活挥发油对待测菌株的抑制活性。将灭菌的直径为6.0 mm的圆形滤纸片置于含有菌悬液的LB培养基上,以无菌水设置对照组,其余滤纸片均滴加5 μL挥发油。将LB培养基封口并置于37 ℃恒温培养箱中,培养12 h后,测量抑菌圈直径,重复3次。参照文献[15-16]的测定方法,采用倍比稀释法将100 μL新鲜羌活挥发油(最终体积分数为80,40,20,10,5,2.5,1.25,0.625,0 μL/mL)与活化后的菌悬液(菌体浓度1×106CFU/mL)混合后分别滴入无菌96孔平底微量培养板中,确定挥发油对供试菌株的最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)值。
参照SHI等[17]的制样方法,利用扫描电镜观察铜绿假单胞杆菌经挥发油作用前后的微观形貌。参照文献[18-19]的方法并稍作改进,测定铜绿假单胞杆菌经挥发油在MIC和MBC作用下,菌悬上清液在不同时间段内的吸光值以及K+的浓度。
1.2.5 挥发油的抗氧化活性测定
参照文献[20-21]的方法,测定新鲜羌活所得挥发油对DPPH自由基和·OH的清除活性,以VC作为阳性对照。
2 结果与分析
2.1 羌活挥发性成分分析及讨论
新鲜羌活挥发油经GC-MS分析,共分离出103种成分(图1),其中可以确定的成分共91种(表1),占总含量的98.49%。相对含量高于1%的共18种,分别为D-柠檬烯、γ-松油烯、芹菜脑、胡萝卜次醇、1,7,7-三甲雙環[2.2.1]庚-2-烯、萜品醇、(+)-α-蒎烯、α-紫穗槐烯、芳樟醇、榄香醇、α-月桂烯、D-香芹酮、α-红没药醇、α-荜澄茄醇和荜澄茄油烯等。新鲜羌活挥发油的成分以倍半萜类物质为主,烯烃类物质的含量高达56.50%,醇类物质的含量为21.95%,酮类物质的含量为3.8%,酯类物质的含量为2.2%,醛类物质的含量为0.89%,烷烃类物质的含量仅为0.3%。
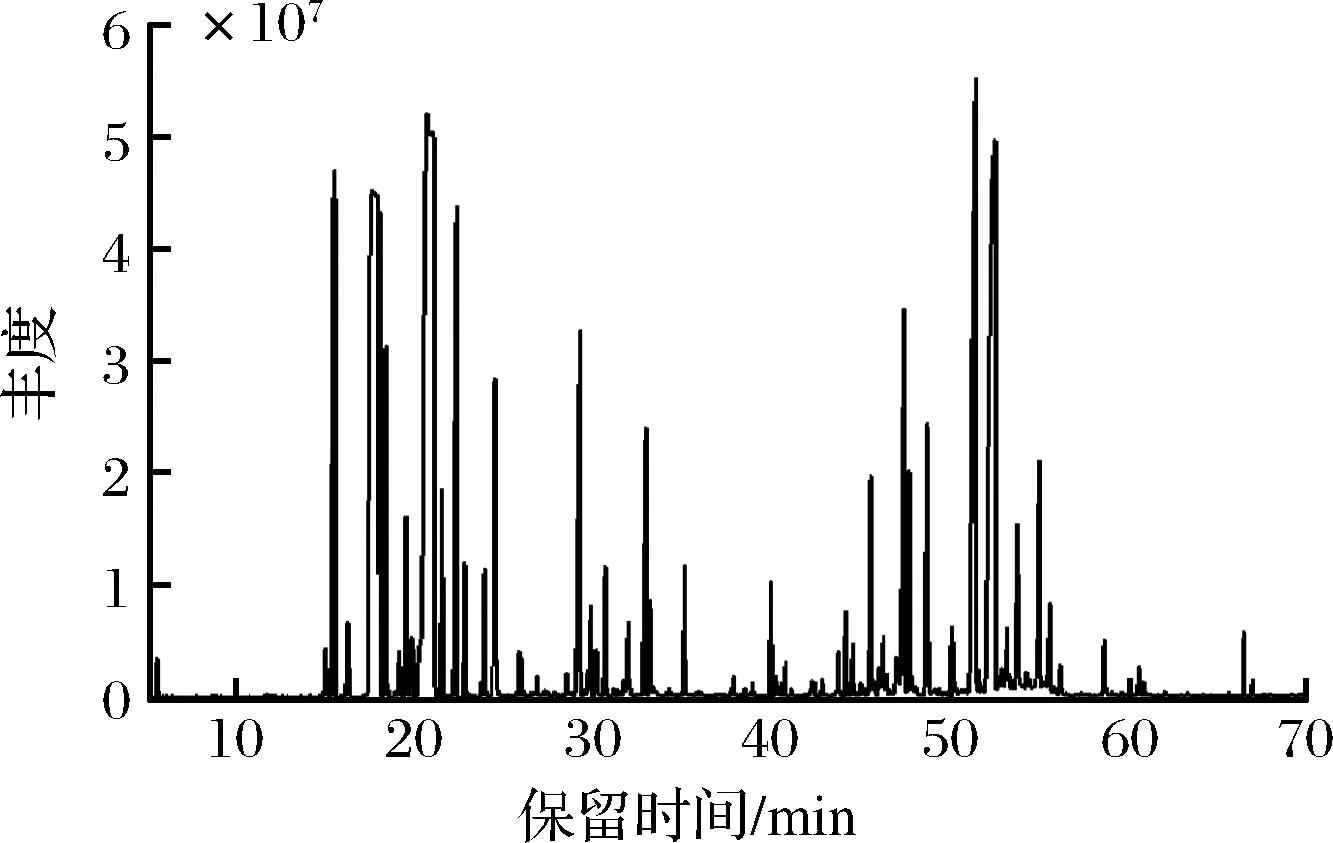
图1 羌活挥发油总离子流图Fig.1 Total ion flow diagram of volatile oil from N.incisum
唐国琳等[4]研究了四川、青海和甘肃等地11批羌活挥发油的得率及组成,除四川白玉绒盖乡产率为2.60%外其挥发油产率在0.60%~1.99%,代表成分为(+)-α蒎烯(1.60%~52.93%)、α-蒎烯(0.83%~21.61%)和松油烯(0.79%~14.66%)等。四川绒盖乡的羌活挥发油检测出了较高含量(37.30%)的柠檬烯,高于新鲜羌活挥发油中的含量(18.83%),但其中含量较高的肉豆蔻醚类物质(20%~60%)在新鲜羌活挥发油中未检出。这11批次羌活挥发油的主要成分包含烯烃类、醇类、醚类、酯类以及醛酮类,并含有少量的酚类和脂肪酸,缺乏烷烃类物质等。
新鲜羌活挥发油中含量高于1%的胡萝卜次醇(7.69%)、1,7,7-三甲雙環[2.2.1]庚-2-烯(4.41%)、α-紫穗槐烯(2.45%)、芳樟醇(2.11%)、α-红没药醇(1.43%)和荜澄茄油烯(1.10%)在四川、青海和甘肃等地的羌活挥发油中未检出;新鲜羌活挥发油中的芹菜脑(13.16%)在四川、青海和甘肃羌活挥发油中的含量低于1%;新鲜羌活挥发油中的γ-松油烯(13.91%)的含量高于四川、甘肃和青海除四川白玉绒盖乡(14.66%)外,其他地区均低于6.3%)。上述分析说明,新鲜羌活挥发油富含烯醇类化合物,含有少量的酮酯类和醛类物质,但缺乏醚类、酚类和脂肪酸等物质。新鲜羌活的挥发油(2.4%)产率高于青海、甘肃和四川多地的干燥羌活。综上所述,新鲜羌活挥发油与已报道的羌活挥发油在组成及其含量上具有显著差异,这可能与产地、品种、生长期以及提取方式(是否干燥)有关。
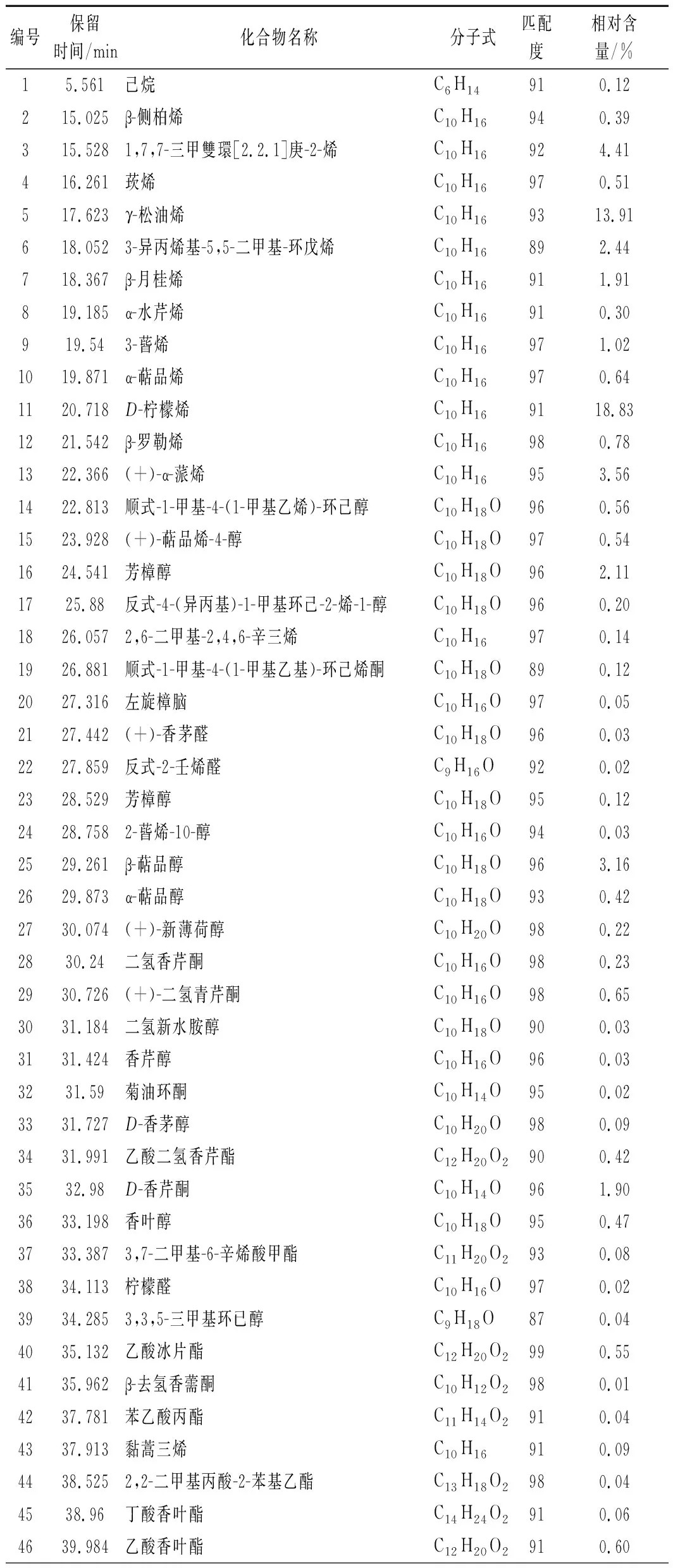
表1 新鲜羌活挥发油的化学成分Table 1 Chemical constituents of volatile oils from fresh N.incisum
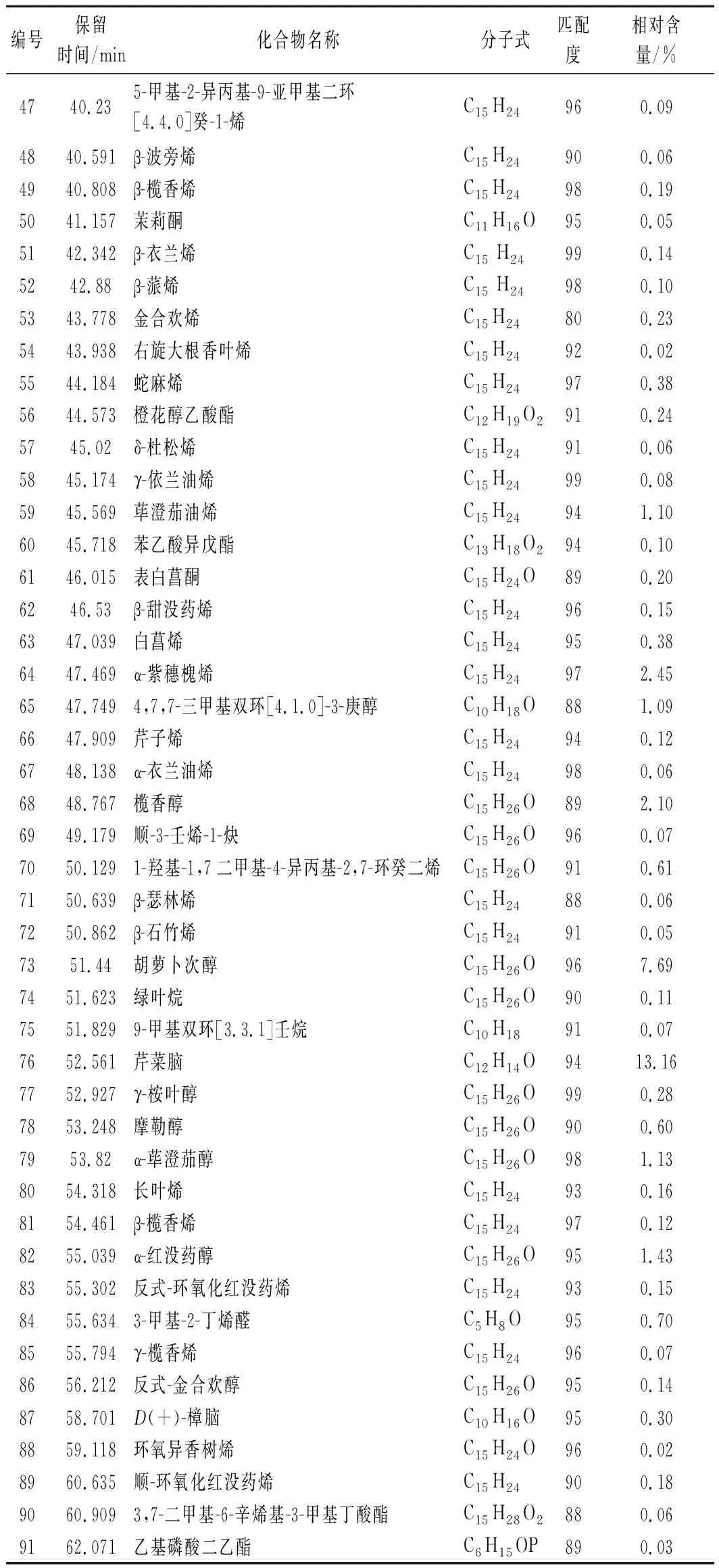
续表1
2.2 羌活挥发油的红外指纹图谱分析


a-4 500~500 cm-1的红外图谱;b-3 200~2 500 cm-1的二阶图谱;c-1 900~500 cm-1的二阶图谱图2 新鲜羌活所得挥发油的红外光谱图及二阶导数图像Fig.2 Infrared spectrogram of volatile oil from fresh N.incisum and second derivative image
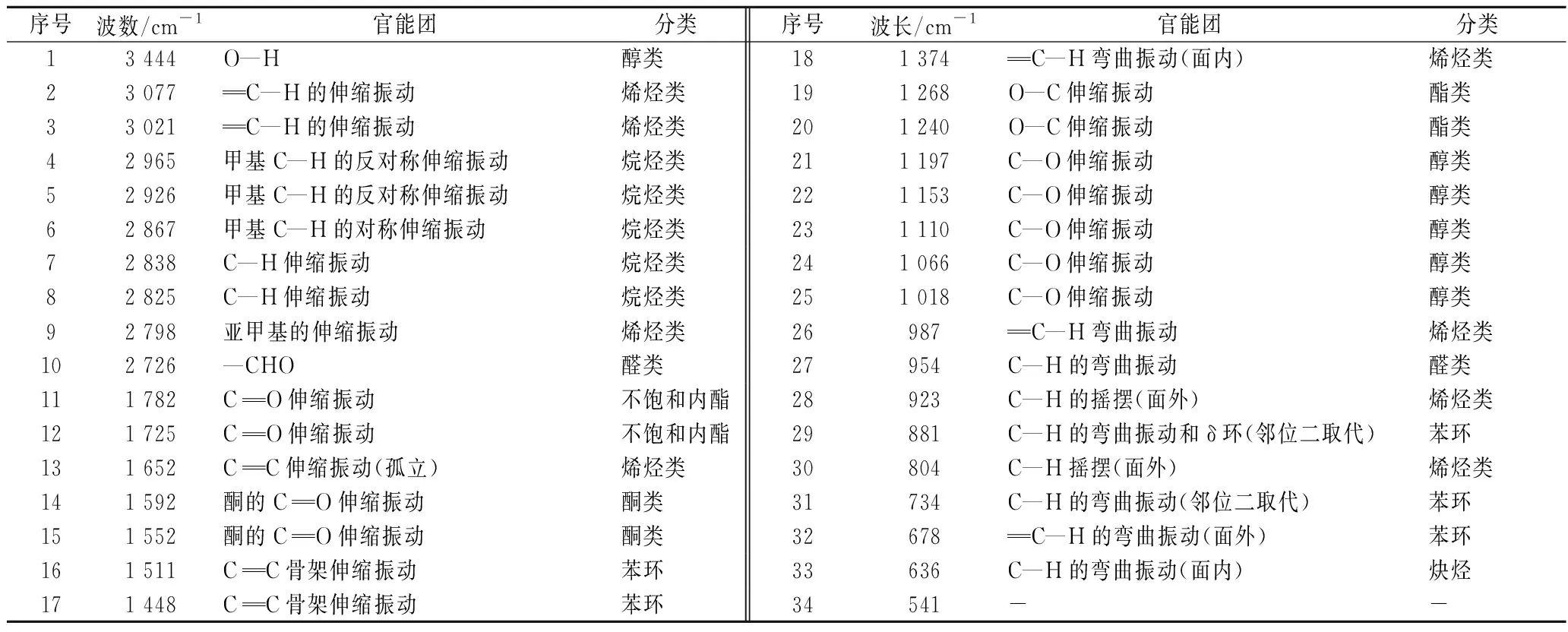
表2 新鲜羌活挥发油的红外特征峰及其归属Table 2 The infrared characteristic peak and its attribution of the volatile oil from fresh N.incisum
羌活及其宽叶羌活挥发油红外图谱的研究目前尚未开展。参照赵玉从等[9]的研究,新鲜羌活挥发油与艾叶挥发油的红外图谱相似,共有峰(±1 cm-1)在3 444、3 077、2 926、2 726、1 448、1 018、987 cm-1附近;相近峰(±6 cm-1)在2 965、2 867、2 838、1 782、1 511、1 374、1 240、881 cm-1附近。新鲜羌活挥发油与干姜[11]挥发油红外图谱比较,其共有峰(±1 cm-1)在3 077、2 926、2 726、1 374、881、541 cm-1处;相近峰(±5 cm-1)在2 965、2 867、1 511、1 448、1 374、1 240 cm-1附近。相较于艾叶和干姜挥发油红外图谱,羌活挥发油的特有峰为3 021、2 798、1 725、1 652、1 552、1 268、1 197、1 153、1 110、1 066、954、804、734、678、636 cm-1。其在1 652和804 cm-1处的峰形明显,无需借助二阶图谱,在红外图谱中便可直接观察,可作为新鲜羌活挥发油鉴定及其快速筛选的重要依据。
2.3 新鲜羌活挥发油的抑菌活性
2.3.1 新鲜羌活挥发油的抑菌活性初筛
表3表明,新鲜羌活挥发油对3种供试菌均有不同程度的抑制效果,其强弱顺序为铜绿假单胞杆菌>大肠杆菌>金黄色葡萄球菌。新鲜羌活挥发油对铜绿假单胞杆菌和大肠杆菌的抑制作用表现为高度敏感,对金黄色葡萄球菌的抑制作用表现为低度敏感。羌活挥发油的抑菌活性研究尚未见报道。本研究中羌活挥发油的抑菌结果与柠檬果皮挥发油[22]相类似,它们对大肠杆菌的抑制活性都优于对金黄色葡萄球菌的抑菌活性,这可能与它们拥有相似的主要成分,D-柠檬烯(42.93%)、γ-松油烯(8.41%)和α-萜品醇(6.39%)有关。柠檬果皮挥发油[22]对大肠杆菌和金黄色葡萄球菌的MIC值分别为0.10和12.50 μL/mL,而新鲜羌活挥发油对大肠杆菌和金黄色葡萄球菌的MIC值分别为5.0和40.0 μL/mL,这可能是新鲜羌活挥发油的主要成分D-柠檬烯(18.83%)含量低于柠檬果皮挥发油(42.93%)所致。柠檬烯对金黄色葡萄球菌无抑制活性[23-24],而新鲜羌活挥发油对金黄色葡萄球菌有抑制活性,因此,柠檬烯可能不是新鲜羌活挥发油对金黄色葡萄球菌起微弱抑制作用的主要活性物质。其研究表明,柠檬烯对铜绿假单胞杆菌和大肠杆菌的MIC值分别为10.0和30 μL/mL,高于羌活挥发油对铜绿假单胞杆菌(2.5 μL/mL)和大肠杆菌(10 μL/mL)的MIC值,这说明除D-柠檬烯外,新鲜羌活挥发油中的其他萜类物质也参与了铜绿假单胞杆菌和大肠杆菌的活性抑制过程[23]。据报道α-紫穗槐烯(2.45%)、榄香烯(0.19%)和石竹烯(0.05%)等对金黄色葡萄球菌具有显著的抑制活性[25],但这些组分在新鲜羌活挥发油中的含量较低,故羌活挥发油对金黄色葡萄球菌具有微弱的抑制活性。综上所述,新鲜羌活挥发油的抑菌活性是多种活性成分协同作用的结果,并存在一定量效关系。
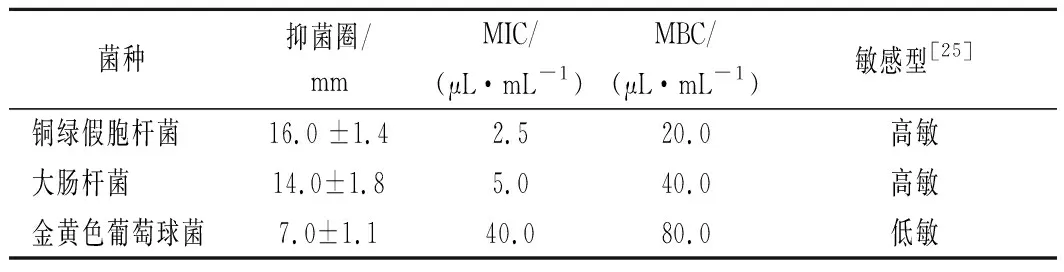
表3 新鲜羌活挥发油的抑菌圈直径及其MIC和MBCTable 3 Diameter of bacteriostatic circle and its MIC and MBC of the volatile oil from N.incisum
2.3.2 新鲜羌活挥发油的抑菌机制的初步探究
以铜绿假单胞杆菌为研究材料,利用扫描电镜观察铜绿假单胞杆菌在挥发油MIC和MBC作用下的微观外貌形态,并监测不同时间段内菌悬上清液中的K+浓度和紫外吸光值。通过图3-a可以看出未经挥发油作用的铜绿假单胞杆菌无褶皱和菌体凹陷现象,外表光滑,呈杆状规则分布。经MIC处理后(图3-b),菌体出现了部分干瘪,同时存在粘结和细胞堆叠以及部分坍塌现象。经MBC处理后(图3-c),菌体变短,细胞壁和细胞膜结构已被完全破坏,并存在严重的坍塌和原生质外泄,菌体的正常代谢严重受阻,甚至死亡。上述现象说明新鲜羌活挥发油可以损坏铜绿假单胞杆菌的细胞膜和细胞壁结构从而抑制其生长。

a-处理4 h后的空白组;b-MIC浓度处理4 h;c-MBC浓度处理4 h图3 铜绿假单胞杆菌的扫描电镜图片Fig.3 Scanning electron micrograph of Pseudomonas aeruginosa
图4-a为MIC和MBC处理后的菌悬上清液中的钾离子浓度曲线。MIC组和MBC组K+质量浓度随时间的增加上升显著,最终质量浓度分别为MIC组0.98 mg/L,MBC组1.49 mg/L,对照组0.29 mg/L。经挥发油MIC和MBC处理下的菌悬液上清液,在260 nm处的紫外吸光值可以作为评价细胞内溶物释放量的指标。图4-b为菌悬上清液的吸光值曲线。MIC组和MBC组的吸光值均显著上升,MIC组0.42,MBC组最终吸光值为0.73,对照组0.05。上述现象说明,经挥发油MIC作用下的铜绿假单胞杆菌的膜结构部分受损,K+外泄和细胞内溶物释放增强;经挥发油MBC作用下的膜结构已被完全破坏,K+外泄和细胞内溶物的释放不受膜结构限制。上述结论佐证了扫描电镜的观察结果,刘雪等[23]观察到铜绿假单胞杆菌经柠檬烯作用后破坏了细胞的正常结构及其完整性,与本实验结果相类似。同时3-蒈烯被证明可以抑制铜绿假单胞杆菌的生长[26],故柠檬烯和3-蒈烯可能是新鲜羌活挥发油对铜绿假单胞杆菌起抑制作用的主要活性物质。至于其他组分的作用机制仍需进一步研究。
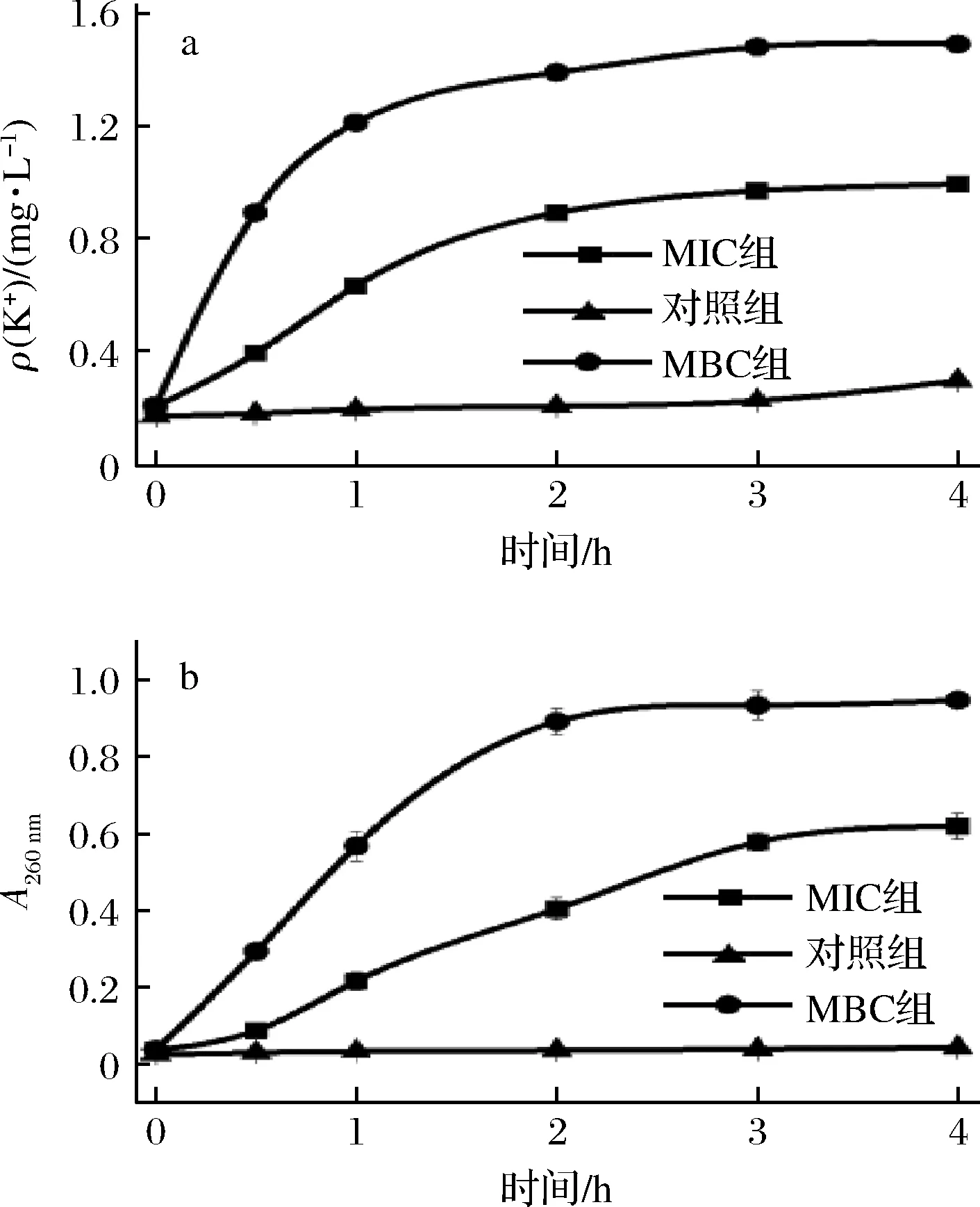
a-K+质量浓度;b-吸光值图4 不同浓度挥发油处理对菌悬液上清液中的K+质量浓度和紫外吸光值的影响Fig.4 Effects of different concentrations of volatile oil on the concentration of K+ and UV absorbance value in the supernate of bacterial suspension
2.4 新鲜羌活挥发油对DPPH自由基和·OH的清除活性
图5-a为新鲜羌活挥发油对DPPH自由基的清除活性,质量浓度在5~80 mg/mL时挥发油对DPPH自由基的清除率为30.10%~95.89%,IC50为15.27 mg/mL。图5-b为新鲜羌活挥发油对·OH的清除活性,在质量浓度为1~10 mg/mL时,对·OH的清除率达到8.34%~91.04%,IC50为4.07 mg/mL。新鲜羌活挥发油对DPPH自由基和·OH均有显著的清除效果,这可能是由于新鲜羌活挥发油具有较高含量的萜烯类物质(D-柠檬烯和γ-松油烯)[27-28]。新鲜羌活挥发油对DPPH自由基的清除率(IC50为15.29 mg/mL)显著低于羌活种子挥发油对DPPH的清除率(IC50为1.90 mg/mL)[14],这可能与羌活种子挥发油具有较高含量的蒎烯(α-蒎烯含量为31.37%,β-蒎烯含量为8.93%)有关,其他组分对自由基的清除作用仍需进一步研究。
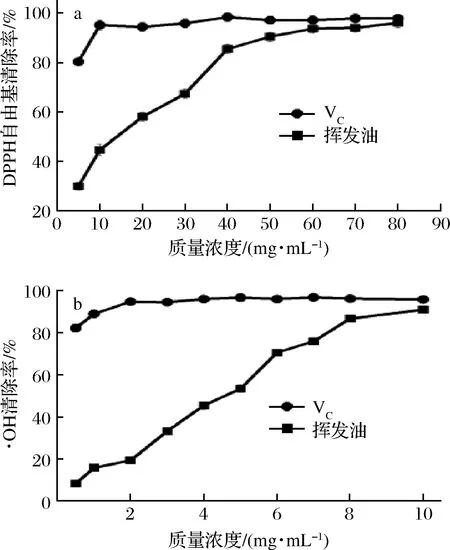
a-DPPH自由基;b-·OH图5 挥发油对DPPH和·OH自由基的清除活性Fig.5 Scavenging activity of volatile oil on DPPH free radical and ·OH
3 结论与讨论
利用GC-MS进行分析,新鲜羌活挥发油中共分离出103种组分,鉴定出91种化学成分,占总含量的98.49%,共有18种组分的相对含量在1%以上,主要为D-柠檬烯(18.83%)、γ-松油烯 (13.91%)、芹菜脑(13.16%)等,其富含烯烃类和醇类物质。其中柠檬烯具有广谱的抑菌活性[23];γ-松油烯对革兰氏阴性菌具有一定程度的抑制活性[29];芹菜脑被报道具有镇定安神的效果[30];α-蒎烯具有抑制HepG2细胞增殖的作用[31];胡萝卜次醇对网膜神经细胞具有保护作用[32];芳樟醇具有抗肿瘤、镇痛、抗炎、镇静安眠等功效,并具有芳香味,可应用于复配香料的生产[33];萜品醇具有广谱的抑菌活性[22]。应用FT-IR,新鲜羌活挥发油共鉴定出34个指纹特征吸收峰,佐证了新鲜羌活挥发油中烯醇类、醛酯类以及酮类等物质的存在;其红外图谱在1 652和804 cm-1处的特征峰,峰形明显,可作为快速筛选羌活挥发油的重要依据。
抗氧化实验表明新鲜羌活挥发油具有显著的清除DPPH自由基和·OH的能力,这主要是因为羌活挥发油中含有烯烃类物质和醇类物质,这些物质可以阻断氧化反应过程中反应链之前的非链过程,清除启动链产生的·OH,同时γ-松油烯、萜品烯和蒎烯等可阻断氧化反应的自由基链,并形成稳定的自由基,从而表现出较强的清除DPPH自由基的能力[22]。抑菌实验表明新鲜羌活挥发油对于铜绿假单胞杆菌和大肠杆菌具有良好的抑制活性,对金黄色葡萄球菌的抑制作用较弱。本研究为新鲜羌活挥发油作为一种天然抑菌剂应用到食品及医疗行业提供了理论依据。
综上,新鲜羌活挥发油拥有良好的抗氧化和抑菌活性并包含多种功效性组分,可作为一种多功效型食品添加剂应用到食品行业。
