miR-20a过表达促进VEGF表达及血管平滑肌细胞活性和迁移
2021-03-18王桂娟
王桂娟
动脉粥样硬化(Atherosclerosis,AS)是一种常见的破坏性和危及生命的疾病,其特征在于大动脉中纤维元素和脂质的积累[1]。血管平滑肌细胞(Vascular smooth muscle cell,VSMC)是构成动脉血管壁的主要细胞成分,调控增殖、迁移和凋亡等异常细胞功能促进AS 的形成和发展[2]。然而,VSMC 对AS 影响的详细分子机制仍不清楚。研究表明,血管内皮生长因子(vascular endothelial growth factor,VEGF)通过调控血管生成影响AS斑块的形成和发展[3]。微小RNA(microRNA,miRNA)是长度为18~24 个核苷酸的非编码RNA分子,通过与靶基因的3'非翻译区(3'untranslated regions,3'UTR)结合来抑制翻译或诱导mRNA 切割。最近,许多研究表明miRNA 通过调控VSMC的增殖、迁移、表型转换和体内血管重塑等参与AS 的进展[4]。miR-20a 属于miR-17-92 簇,在多种恶性肿瘤中发挥作用,包括结肠癌、前列腺癌、胃癌和肺癌等[5]。然而,迄今为止,miR-20a 在VSMC中的生物学功能尚未明确阐明。本研究探究miR-20a 对VSMC 活性和迁移及VEGF 表达的影响以及可能的机制,以期为AS 的治疗提供新的方向。
1 材料与方法
1.1 细胞系和主要试剂
人主动脉血管平滑肌细胞系T/G HAVSMC(美国ATCC);SmGM-2 培养基(瑞士龙沙集团有限公司);胎牛血清、胰蛋白酶(赛默飞世尔科技公司);RNA 提取试剂盒、反转录试剂盒(大连宝生物工程有限公司);除抗体外Western blot 检测所需试剂(上海碧云天生物技术研究所);miR-20a mimics 及mimics NC(上海吉玛制药有限公司);脂质体2000转染试剂(美国Invitrogen 公司);Real-time PCR Kit检测试剂盒(上海研卉生物科技有限公司);CCK-8试剂盒(日本同仁化学研究所);Transwell 下室(美国BD 公司);VEGF、CNN1 抗体(美国NEB 公司);辣根过氧化酶标记的二抗(美国CST 公司);荧光素酶报告基因检测试剂盒(美国Promega 公司)。
1.2 细胞培养
人血管平滑肌细胞培养在含5%灭活胎牛血清的SmGM-2 培养液中,置于体积分数5%CO2、37℃、饱和湿度的细胞培养箱中培养,细胞生长融合度达90%以上时以胰蛋白酶消化传代,指数生长期的细胞用于后续实验。
1.3 细胞分组和转染
将对数生长期的VSMC 分为空白对照(Con)组、阴性对照(miR-NC)组和转染(miR-20a)组共3组。VSMC 接种到24 孔板中,于37℃培养箱过夜培养,待细胞生长汇合度达50%时,将脂质体2000与miR-20a mimics 或mimics NC 以2.5∶1 的比例混合,并加入到24 孔板的细胞中,转染miR-20a mimics 的VSMC 记为miR-20a 组,转染mimics NC 的VSMC 记为miR-NC 组,未做转染处理的VSMC 记为Con 组。各组细胞在37℃培养箱孵育6 h 后更换为5%胎牛血清的SmGM-2 培养液。
1.4 Real-time 检测
收集转染48 h 后3 组VSMC,RNA 提取试剂盒分别提取总RNA,并将RNA 反转录成cDNA,使用Real-time PCR Kit 检测试剂盒进行Real-time PCR。miR-20a 正向引物5′-CACCTCGAGCCTGCTATTTCCTTCAA-3′,反向引物 5′-GAG AATTCAGTAACAGGACAGTTTG-3′。VEGF 正向引物5′-ATCTTCAAGCCGTCCTGTGTGC-3',反向引物5′-CAAGGCTCACAGTGAACGCT-3′。CNN1 正向引物5′-AAGGGCGGAACATCATTGGGCT-3′,反向引物5′-CTCGAAGATCTGCCGCTTGGT-3′。反应结束后读取Ct 值,采用相对定量2-△△Ct法计算目的基因相对表达量。
1.5 Western blot 检测细胞中PCNA 和Ki-67 蛋白表达水平
使用RIPA 裂解缓冲液分别从3 组VSMC 中提取蛋白质,并通过12%十二烷基硫酸钠聚-丙烯酰胺凝胶电泳分离,然后转移至聚偏二氟乙烯膜(polyvinylidene fluoride membranes,PVDF)上。在37℃下用5%脱脂牛奶封闭2 小时,将膜与一抗孵育过夜:VEGF(1∶1 000 稀释),CNN1(1∶800 稀释)。随后将膜与1∶2 000 稀释的相应二抗室温孵育2 h。以GAPDH 的蛋白质水平作上样对照,使用ECL 试剂盒显影,获取各蛋白条带,采用Image J 软件分析各组VSMC 中VEGF 和CNN1 蛋白相对表达量。
1.6 CCK-8 法检测
对数期的VSMC 以8×103个/孔接种到96 孔板中,按照上述1.3 法转染和分组,分别在转染0、24、48、72 h 时向每孔细胞加入10 μL CCK-8 溶液,37℃孵育2 h,使用酶标仪测定490 nm 波长处吸光度值(OD 值)。
1.7 Transwell 实验
三组VSMC 以胰酶消化,制成单细胞悬液,取100 μL 细胞悬液接种到Transwell 小室的上室,在下室中添加含10%胎牛血清的SmGM-2 培养液,放置在37℃培养箱常规培养48 h。采用多聚甲醛固定,结晶紫染色,在显微镜下观察穿膜细胞,随机选取5 个视野技术穿膜细胞数。
1.8 荧光素酶报告基因实验
通过生物信息学在线软件TargetScan 等预测结果显示miR-20a 与CNN1 mRNA 3′-UTR 存在靶向结合位点。根据预测结果将CNN1 3′-UTR 及突变结合位点分别插入到psiCHECK-2 荧光素酶载体上(该部分由上海生工生物工程有限公司完成),分别记为CNN1-Wt 和CNN1-Mut 荧光素酶重组载体。将miR-20a mimics 或mimics NC 与重组载体质粒共转染至VSMC,48 h 后使用荧光素酶报告基因检测试剂盒测定萤火虫和海肾荧光素酶活性,以萤火虫荧光素酶活性作为内部对照计算细胞相对荧光素酶活性。
1.9 统计学分析
采用SPSS 21.0 统计学软件分析数据,计量资料均以(±s)表示,多组间差异比较采用单因素方差分析,两组间比较采用t检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组VSMC 中miR-20a 的表达量比较
与miR-NC 组(0.96±0.09)相比,miR-20a 组(3.16±0.32)VSMC 中miR-20a 的相对表达量明显升高,差异有统计学意义(P<0.05),而Con 组(1.00±0.10)中miR-20a 的相对表达量无明显变化,差异无统计学意义(P>0.05)。
2.2 各组VSMC 中VEGF 表达量比较
Western blot 检测结果:与miR-NC 组相比,miR-20a 组VSMC 中VEGF mRNA 和蛋白相对表达量均明显上调,差异有统计学意义(P<0.05),而Con 组中VEGF 的表达无明显变化,差异无统计学意义(P>0.05)。见图1,表1。
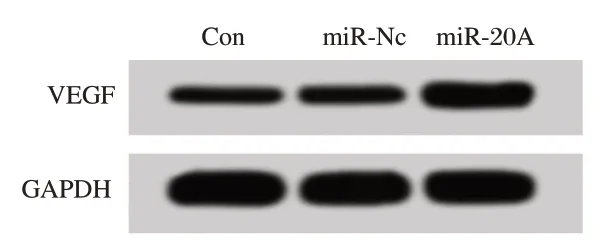
图1 Western blot 检测3 组VSMC 中VEGF 蛋白表达Figure 1 Western blot detection of VEGF protein expression in 3 groups of VSMC
表1 3 组VSMC 中VEGF mRNA 和蛋白相对表达量比较(±s)Table 1 Comparison of the relative expression of VEGF mRNA and protein in the 3 groups of VSMC(±s)
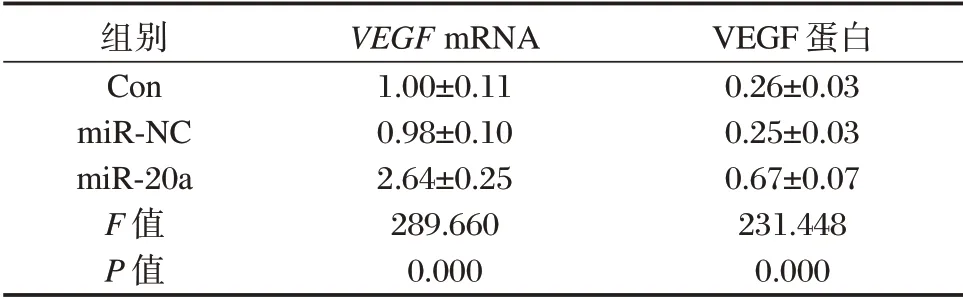
表1 3 组VSMC 中VEGF mRNA 和蛋白相对表达量比较(±s)Table 1 Comparison of the relative expression of VEGF mRNA and protein in the 3 groups of VSMC(±s)
组别Con miR-NC miR-20a F 值P 值VEGF mRNA 1.00±0.11 0.98±0.10 2.64±0.25 289.660 0.000 VEGF 蛋白0.26±0.03 0.25±0.03 0.67±0.07 231.448 0.000
2.3 各组VSMC 活性比较
与miR-NC 组相比,miR-20a 组VSMC 活性在转染24、48、72 h 时均明显上调,差异有统计学意义(P<0.05),而Con 组中VSMC 活性无明显改变,差异无统计学意义(P>0.05)。见表2。
表2 3 组VSMC 在不同时间点OD 值(λ=490 nm)比较(±s)Table 2 Comparison of OD values(λ=490 nm)of 3 groups of VSMC at different time points(±s)

表2 3 组VSMC 在不同时间点OD 值(λ=490 nm)比较(±s)Table 2 Comparison of OD values(λ=490 nm)of 3 groups of VSMC at different time points(±s)
组别Con miR-NC miR-20 F 值P 值0 h 0.20±0.02 0.18±0.02 0.20±0.02 3.000 0.069 24 h 0.44±0.04 0.42±0.04 0.52±0.05 13.263 0.000 48 h 0.61±0.06 0.59±0.06 0.74±0.07 14.802 0.000 72 h 0.79±0.08 0.78±0.08 0.96±0.09 13.220 0.000
2.4 各组VSMC 迁移能力比较
与miR-NC 组相比,miR-20a 组VSMC 穿膜细胞数明显增多(P<0.05),而Con 组中VSMC 穿膜细胞数无明显改变(P>0.05)。见表3。
表3 3 组VSMC 穿膜细胞数比较(±s)Table 3 Comparison of the number of VSMC penetrating cells in the 3 groups(±s)

表3 3 组VSMC 穿膜细胞数比较(±s)Table 3 Comparison of the number of VSMC penetrating cells in the 3 groups(±s)
组别Con miR-NC miR-20a F 值P 值迁移细胞数62.04±6.10 59.25±6.24 113.36±10.58 133.251 0.000
2.5 miR-20a 对CNN1 的靶向关系验证
Western blot 检测结果发现(图2A),与miR-NC组相比,miR-20a 组VSMC 中CNN1 mRNA 和蛋白表达明显下调(P<0.05),而Con 组中CNN1 的表达无明显变化(P>0.05)。生物信息学软件分析结果显示(图2B),CNN1 的3′UTR 与miR-20a 存在互补结合碱基位点。荧光素酶报告基因实验结果显示(图2C),miR-20a mimics 能够显著抑制CNN1-Wt 细胞的相对荧光素酶活性(P<0.05),而对CNN1-Mut 细胞的相对荧光素酶活性无明显抑制作用(P>0.05)。
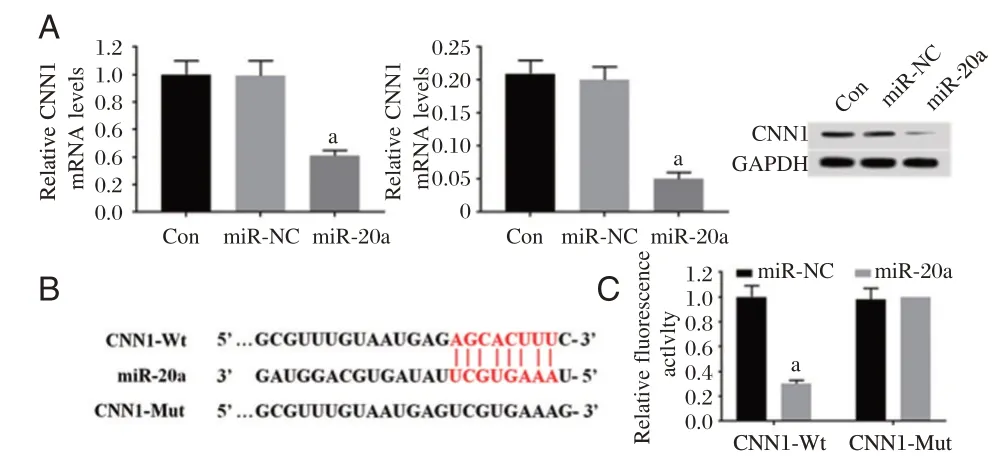
图2 miR-20a 靶向调控CNN1Figure 2 miR-20a targets and regulates CNN1
3 讨论
AS 是由于脂肪、血栓、碳酸钙和结缔组织在血管沉积导致的一种慢性动脉疾病,也是全世界死亡率和发病率的主要原因。目前关于AS 治疗策略包括药物治疗、外科手术和综合治疗,但未能取得良好的治疗效果[6]。因此迫切需要探究AS 的发病机制,对开发新的有效的AS 治疗手段具有十分重要的意义。AS 的发病机制极其复杂,近年来随着研究的深入,发现VSMC 的增殖和迁移涉及AS 进展的所有阶段[7]。VEGF 是一类特殊的细胞因子,广泛存在于心、脑、肝等组织和细胞中,在维持VSMC 结构和功能上均具有重要作用[8]。VEGF可通过调控血管生成,导致VSMC 异常增生,最终诱发AS 的形成和发展。近年来已经描述了miRNA 在控制VSMC 增殖和迁移中的调节作用[9]。此外,越来越多的证据表明miRNA 与VSMC的功能密切相关[10-11]。据报道,异常的miRNA 表达与动脉粥样硬化的发展有关[12]。miRNA 在调节VSMC 中的作用有助于了解动脉粥样硬化的分子机制,为AS 的诊断和治疗策略提供新的作用靶点。
miR-20a 位于chr13orf25 内含子的染色体13q31 上,miR-20a 的表达失调参与多种癌症的发展。Fan 等人通过微阵列数据分析表明在增殖的VSMC 中miR-20a 异常高表达,推测miR-20a 可能与VSMC 活性有关[13]。一项研究显示,miR-20a 在调节卵巢癌OVCAR3 细胞的顺铂耐药和通过激活EMT 促进细胞迁移中具有重要作用[14]。miR-20a在肝癌组织和细胞系中均低表达,恢复其表达可抑制肝癌HepG2 细胞的增殖、迁移和侵袭[15]。以上这些数据提示miR-20a 可调控细胞的迁移能力。本实验与以上研究类似。Deng 等人研究发现,VEGF 可通过激活Akt 和Erk 信号通过刺激人脐静脉内皮细胞中miR-31 和miR-20a 的表达[16]。在本实验结果发现过表达miR-20a 的VSMC 中VEGF mRNA 和蛋白表达均明显升高。以上实验数据提示过表达miR-20a 可能通过上调VEGF 的表达及VSMC 的活性和迁移能力参与AS 的发展。CNN1 在多种恶性肿瘤中呈低表达,是一种广谱肿瘤诊断标记物。本实验通过生物信息学软件预测发现,CNN1 可能是miR-20a 一个直接靶基因,荧光素酶报告基因测定证实miR-20a 直接结合VEGF-A mRNA 的3′-UTR。且Real-time PCR 和Western blot 检测结果表明过表达miR-20a 可显著抑制CNN1 的表达。本实验结果提示miR-20a 可能通过靶向调控CNN1 影响VSMC 活性和迁移以及VEGF 的表达。
总之,本实验结果显示过表达miR-20a 可促进VEGF 的表达及VSMC 活性和迁移,其作用机制可能与miR-20a 靶向负调控CNN1 的表达有关。本研究提供了对AS 发展中miR-20a 功能的进一步理解,为开发新的AS 治疗手段提供一定的实验基础。
