芘污染盐碱土壤微生物-电动修复效率影响因素
2021-03-17范瑞娟刘雅琴北方民族大学生物科学与工程学院宁夏银川75002宁夏特殊生境微生物资源开发与利用重点实验室宁夏银川75002
范瑞娟,马 艳,张 琇,2,刘雅琴,2 (.北方民族大学生物科学与工程学院,宁夏 银川 75002;2.宁夏特殊生境微生物资源开发与利用重点实验室,宁夏 银川 75002)
随着石油化工行业的发展,大量有毒有机污染物如多环芳烃(PAHs)通过各种途径进入土壤,对土壤环境造成严重污染[1].工业废水往往含盐量很高,因而石油烃类有机污染土壤常伴有盐碱化的发生[2].开展PAHs 污染盐碱土壤的修复工作,对农业生产和人类健康发展极其重要.
微生物修复(Bioremediation, BIO)在PAHs 的去除中起着重要作用[3-4].然而,PAHs 水溶性低、生物可利用性差,尤其对于高环PAHs(≥4 个环),高盐环境更增加了其疏水性,延长了其半衰期[5].采用微生物-电动联合技术(Bio-electrokinetics, BIO-EK)可通过微生物氧化代谢作用与电动力学效应或电化学氧化作用之间的耦合效应增强PAHs 的去除效率[6].前期研究发现,在BIO-EK 联合修复石油烃类污染土壤的过程中,随着修复的进行,污染物去除效率逐渐降低,而微生物群落结构的变化可能是导致污染物降解难度逐渐增加的重要原因[7].然而,BIO-EK 修复过程中微生物群落变化的关键影响因素及其与污染物降解效率之间的关系有待于进一步探究.
微生物群落的变化受土壤环境因素影响,而电场的施加可能引起土壤理化性质发生变化.一方面,水的电解作用会导致土壤水分含量减少或分布发生变化,不利于微生物的呼吸、代谢;另一方面,电场的施加引起电极附近pH 值极端化,从而导致微生物数量、丰度减少以及微生物呼吸作用下降[8].随着电流的持续产生,电极两端离子的聚集可能使土壤内渗透势增加,造成微生物细胞失水,使微生物数量下降,代谢能力减弱[9].不同的电场强度所引起的土壤理化性质变化幅度不同,因而所造成的微生物群落变化及其代谢水平变化幅度也不同.如Alshawabkeh等[10]研究发现,较高场强下,土壤离子、水分、pH 值等土壤理化性质变化幅度较大,且较高的电流密度将增加土壤内电势降,影响微生物细胞膜电位,对微生物细胞内外酶系统及其代谢水平产生抑制作用,当电势降大于1.5V/cm 时,土壤悬液中部分微生物将出现“休克”现象;刘广容等[11]研究表明,弱电场(1V/cm)可激活底泥中脱氢酶活性,而强电场(3V/cm)则会降低细菌的活性.不同的电场强度也会引起不同的电流热效应,因而对微生物生长、活性及其代谢水平产生不同影响.如,Li 等[12]研究发现,适当的电场强度(2V/cm)所产生的电流热效应有利于微生物的生长代谢,而较高的电场强度(3V/cm)使得土壤温度过高,将对微生物活性和代谢产生负面影响.另外,也有研究表明,随着土壤中营养物质的消耗和污染物浓度的变化,微生物群落也将随之发生变化,进而导致微生物代谢状态的改变[13].由此可见,土壤环境因素的改变可能导致微生物群落发生变化,从而改变其对污染物的降解能力.因此,深入研究土壤环境因素、污染物浓度与微生物群落之间的相关性,有望揭示BIO-EK 修复中后期制约污染物高效降解的关键因素.
本研究以盐碱土壤中投加芘的方式, 研究微生物-电动修复效率及影响因素.具体是通过监测BIO-EK 修复过程中芘浓度、电流和土壤pH 值、水分含量、温度等环境因子以及微生物群落变化特征,并分析它们之间的相关性,以期找到影响微生物群落变化的关键因素,并明确其与污染物降解效率之间的关系,从而为有机污染物BIO-EK 修复过程调控提供一定的理论依据.
1 材料与方法
1.1 试验材料
1.1.1 试验土壤 试验土壤采自北方民族大学实习基地附近(N 38°29′46″,E 106°6′847″)0~30cm 土层,除去石子颗粒等杂质,自然风干后过筛(<2mm),121℃灭菌30min 以除去土著微生物.初始土壤部分理化性质见表1.
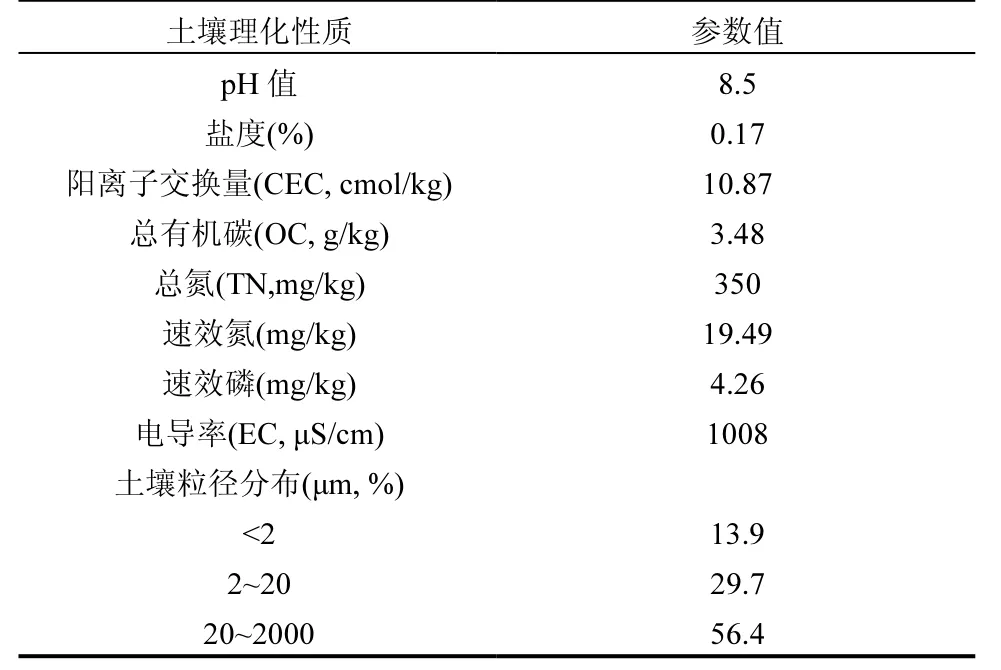
表1 土壤理化性质初始值Table 1 Initial characteristics of the test soil
1.1.2 污染物 芘(纯度>98%,上海笛柏生物科技有限公司).用二氯甲烷将芘溶解,以300mg/kg 的比例加入土壤中,充分混匀,室温下避光平衡14d,测得芘的实际初始浓度为288mg/kg.
1.1.3 降解菌 以前期从石油污染土壤中分离出的4 株可降解高环多环芳烃的耐盐碱菌SYP-1、SYP-2、SYP-5 和SYP-11 为供试细菌,其中SYP-1为代尔夫特菌属(Delftia sp.),SYP-2 和SYP-11 为海杆菌属(Marinobacter sp.),SYP-5 为芽孢杆菌属(Bacillus sp.)[14].用牛肉膏蛋白胨固体培养基活化后,接种于牛肉蛋白胨液体培养基中,30℃、140r/min 培养3d,8000r/min 离心5min,弃去上清液,用无机盐培养液重悬,再次离心、重悬,获得OD600nm值约0.25的菌悬液.上述所用培养基的盐度均为5%,pH 值均为8.6,配制方法参照前期试验[14].
1.2 试验装置及设计
试验装置如图1 所示.该装置包括PVC 土壤室(20cm×10cm×8cm)、可调直流电源、继电器、电流表和土壤温度计各一个,以及不锈钢电极(20cm×1cm)两对.土壤室配有聚氯乙烯盖以防止水分蒸发,继电器可以设定的时间间隔交替变换电极极性,电 极阴阳间距为16cm,极性相同两电极间距为8cm.
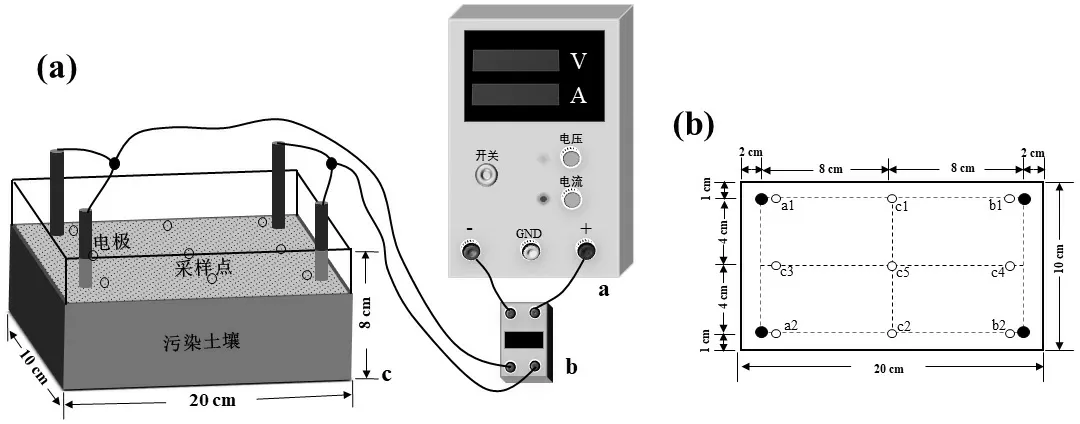
图1 试验装置 (a)及采样点 (b)Fig.1 Schematic of the experimental set-up (a) and sampling positions (b)
试验共设置三组处理:微生物-电动联合修复(bioelectrokinetics, BIO-EK)、电动修复(electrokinetics,EK)、微生物修复(bioremediation, BIO).此外,设置了对照组(CK).其中, BIO-EK 和BIO 污染土壤中添加嗜盐碱降解菌的悬浮液,使土壤中的微生物数量达到107~108CFU/g,土壤盐分和pH值分别为1%和8.0,土壤湿度为最大持水量的67.5%; EK 和CK 中添加相同量的无机盐培养液,使其盐度、pH 值和水分含量与BIO-EK 和BIO 中相同. BIO-EK 和EK 在图1a 所示的装置中进行,施加的直流电场为1.0V/cm,电极极性每30min 切换一次; BIO 和CK 在与EK 和BIO-EK 相同的土壤室中进行,但不施加电场.将1.5kg 处理好的土壤分层放入土壤室,每一层都被夯实以缩小间隙,试验共持续91d,定期向土壤中加入去离子水以保持土壤水分.
1.3 试验方法
1.3.1 电流及土壤理化性质的测定 BIO-EK 中的电流值直接从电流表读取,每5min 记录1 次,每天共记录6 次.土壤理化性质的测定参照《土壤农业化学分析方法》[15]:土壤电导率由电导率仪测定,土壤水分比为1:5 (W/V);土壤温度用土壤温度计测量,每天测量一次;土壤pH 值由pH 计测定,土壤水分比为1:2.5 (W/V);土壤含水量用烘干法测定;土壤水溶性盐总量采用残渣烘干法测定;阳离子交换量采用乙酸铵法测定;土壤总有机碳含量采用重铬酸钾容量法测定;土壤总氮含量采用凯氏法消解,凯氏定氮仪测定;土壤速效氮采用碱解扩散法测定;土壤速效磷含量采用钼锑抗比色法测定;土壤粒径分布采用比重计法测定.
1.3.2 土壤中芘含量的测定 BIO-EK、EK、BIO及CK 试验过程中,每7d 从图1b 所示的9 个位点取样,自然晾干后,研磨过筛(40 目),将不同位点土样充分混匀后提取芘,采用高效液相色谱法(HPLC)测定芘含量,采用外标法进行定量,从而得到芘含量随时间的变化值.试验最后一天(91d),除测定混匀后土样中的芘含量外,还测定9 个不同位点的芘含量,从而得到芘含量随空间的变化值.芘的提取方法及HPLC操作条件如下:
芘的提取:将风干后的土样充分研磨过40 目筛,称取1g 于50mL 的离心管内,加入丙酮和二氯甲烷混合溶剂(1:1)共30mL,盖好瓶盖振荡摇匀后超声萃取30min(水温<35℃),低温离心2min(8000r/mim),上清液收集至锥形瓶中,再用30mL丙酮和二氯甲烷混合溶剂(1:1)以相同的方法对沉淀物提取两次,合并提取液.将提取液通风浓缩至干,用色谱纯乙腈溶解并定容至1mL,用0.22μm 有机滤膜过滤到棕色液相小瓶中待测.HPLC 操作条件:流动相为乙腈和水,梯度比为:乙腈/水90:10, 0min;乙腈(100%)1min;乙腈/水90:10, 9min;柱温为25.0℃;流速为1.0mL/mim;进样体积为10.0μL.

式中:C0为0d时芘的实际测定浓度;Ct为不同处理时间芘的浓度.
1.3.3 微生物群落分析 对0,7,21,63 和91d BIO和BIO-EK 处理组共10 个土壤样品以及91d BIOEK 处理组不同取样点的4 个土壤样品进行微生物群落分析.其中, BIO-EK 组不同取样点的4 个样品是将9 个位点(图1b)样品合并后所得,具体为:将a1、a2、b1 和b2 合并,表示为a+b; c1 和c2 合并,表示为c1+c2;c3 和c4 合并,表示为c3+c4; c5 单独表示.
经现场取样实测,砌体砂浆强度为0.5 MPa,砌筑砖强度满足MU10砖的强度要求,但砌筑质量差,不平整。
用土壤 DNA 提取试剂盒(QIAGEN GmbH,Germany)提取土壤细菌基因组DNA 后,利用引物338F(5’-ACTCCCTACGGGAGGCA-3’) 和 806R(5’-GGACTACHVTWTCTAAT-3’)扩增V3-V4 区的16S rRNA 基因.扩增程序为98℃变性2min;98℃变性30s,50℃变性30s;72℃变性60s,循环30次;72℃延伸5min.PCR 产物用DNA 纯化试剂盒(Omega,America)纯化,然后采用NanoDrop 2000 (NanoDrop Technologies, Inc., Wilmington, DE, USA)定量.使用Illumina 的NEBNext Ultra DNA 文库制备试剂盒(NEB, USA)建立测序文库,将质检合格的文库通过Illumina HiSeq2500 平台(Biomarker Technologies Co., Ltd., Beijing, China)进行高通量测序.将得到的原始图像数据文件经碱基识别(Base Calling)分析转化为原始测序序列(Sequenced Reads),进行数据预处理:首先,采用FLASH v1.2.7 通过overlap 对每个样品的reads 进行拼接,得到原始Tags 数据(Raw Tags);其次,采用Trimmomatic v0.33 对拼接得到的Raw Tags 进行过滤,得到高质量的Tags 数据(Clean Tags);最后通过UCHIME v4.2 鉴定并去除嵌合体序列,得到最终有效数据(Effective Tags).通过USEARCH v11.0.667 在97%的相似度水平上对Tags 进行聚类,获得分类操作单位(OTUs),并基于silva 分类学数据库对OTU 进行分类学注释,用Venn图表示样品之间共有或特有的OTUs.将OTU 的代表序列与微生物参考数据库进行比对得到每个OTU 对应的物种分类信息,进而在各水平(phylum、class、order、family、genus、species)统计各样品群落组成,利用QIIME 软件生成不同分类水平上的物种丰度表,利用R 语言工具绘制样品各分类学水平下的群落结构图.利用Mothur(v. 1.30)对样品的ACE和Chao1(物种丰度)、Shannon 和Simpson (物种多样性)等α 多样性指数进行评价.利用qime (v1.8.0)对β 多样性指数进行分析,包括主成分分析(PCA)、主坐标分析(PCoA)和非度量多维尺度分析(NMDS).利用典型对应分析(Canonical correspondence analysis, CCA)分析微生物群落结构对土壤理化因子的响应.
1.4 数据分析
每个分类层次上的群落结构图、热图、多样性指数分析图均采用R 语言工具(v. 3.0.2)绘制,其他图形采用Excel 2019 绘制;方差分析采用SPSS 17.0(SPSS Software, USA)中“Duncan”法;Beta 多样性基于Bray Curtis 算法进行分析.
2 结果与讨论
2.1 土壤中芘的降解
由图2 可知, 91d 后BIO-EK、BIO、EK 和CK中芘的浓度由初始的288.03mg/kg 分别降至73.40,114.23,150.27,256.09mg/kg(图2(a)).采用一级动力学模型拟合不同处理过程中石油的降解,回归方程的相关系数为0.9678~0.9827,模拟效果较好.在91d 的处理过程中,BIO-EK 中芘的降解速率常数最大,为0.0151d-1,半衰期为45.90d,而BIO 和EK 中芘的降解速率常数分别为0.0111 和0.0078d-1,半衰期分别为62.45 和88.87d,而CK 中芘的降解速率常数仅为0.0012d-1,半衰期长达577.62d(表2).以上结果表明BIO-EK 联合修复有利于促进芘的降解.相较而言,BIO、EK 和BIO-EK 处理过程中,前期芘的降解速率较大,后随着处理时间的延长,降解速率逐渐降低(图2a),与前期研究结果相似[7].CK 和BIO 中,芘在各取样点(a1、a2、b1、b2、c1、c2、c3、c4 和c5)的降解率无明显差异(P>0.05),而EK 和BIO-EK 组中离电极较近的取样点(a1、a2、b1 和b2)降解率高于其他位点(P<0.05).EK 和BIO-EK 组中a1、a2、b1 和 b2 点的降解率范围分别为49.3%~49.6%和79.1%~80.5%;c1、c2、c3 和c4 点的降解率范围分别为45.3%~48.5%和69.9%~76.9%;离电极最远的c5 点降解率最低,分别为43.5%和65.2%(图2(b)).电场强度在空间上的差异会引起污染物降解速率的不同,具体来说其与污染物降解速率呈正相关, 该现象已在前期的研究中所证实[7,13,16-17].除此之外,土壤微环境变化以及由此引起的微生物群落结构变化可能是导致芘降解效率发生时间和空间上变化的重要原因.

图2 不同处理土壤中芘浓度随时间变化及91d 不同取样点芘的降解率Fig.2 The variation of pyrene concentration with time in different treatments and the degradation rate of pyrene at different sampling sites by day 91
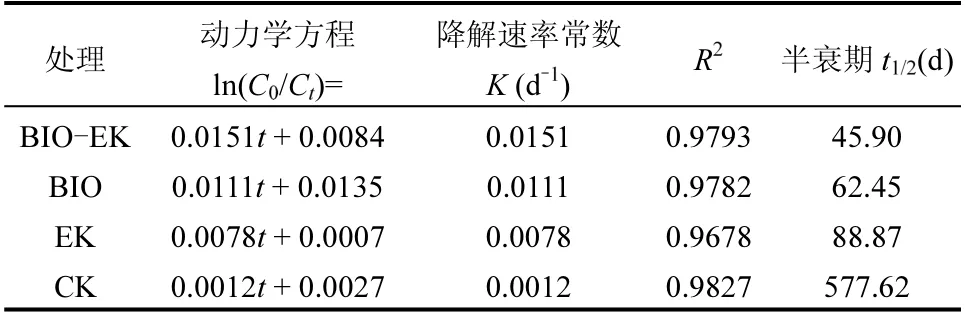
表2 不同处理芘降解的一级动力学方程Table 2 First-order kinetic equations of pyrene degradation in different treatments
2.2 BIO-EK 处理过程中电流变化
图3 为BIO-EK 试验过程中电流变化情况.施加电场1d 后电流略有上升(由240mA 上升至247mA),随后则迅速降低,在整个试验过程中,虽然由于水分的补充使电流有所回升,但整体上呈下降趋势,至91d 时,下降至23mA.本研究土壤盐度较高(1%),因而BIO-EK 中的电流峰值高于其它研究[18-19].在一个稳定的电压梯度下,电流的变化反映了电导率的变化,而电导率的变化与土壤的含水量、离子浓度等参数密切相关[20].试验初期电流有所上升,可能由于电场的施加促进了土壤中无机离子的解吸,增加了可溶态离子含量.随后电流强度快速降低,一方面可能源于电解作用引起的土壤含水率的降低(图4);另一方面,可能由于电解作用所产生的OH-同土壤中的一些阳离子,如Ca2+、Mg2+和Al3+等形成氢氧化物沉淀,使土壤溶液中可溶性离子减少[21].此外,电化学腐蚀引起的电极损耗可能也是引起电流降低的原因之一.在电动力学修复过程中,电流是影响电化学氧化效率的重要因素,通常情况下,电流越大,污染物去除效率越高[22].而在微生物-电动联合修复过程中,电流本身可能引起微生物生长繁殖、活性和群落结构发生变化[23],或者通过影响土壤微环境从而对微生物群落产生影响,进而影响到污染物降解效率[24].

图3 BIO-EK 试验过程中电流变化Fig.3 Changes in electric current during the experimental period of BIO-EK
2.3 土壤水分含量变化
在微生物-电动联合修复中,适当的土壤湿度是电化学反应正常进行以及微生物保持较高代谢能力的重要保证[25].图4 为不同处理土壤湿度随时间和不同采样点变化情况.试验过程中,CK 和BIO 中的土壤平均湿度变化幅度较小,分别为最大持水量的63.1%~69.0%和60.3%~72.2%,而EK 和BIO-EK中土壤湿度在施加电场后即由于电解作用而明显下降,14d 后由最大持水量的68.9%和69.0%分别下降至40.7%和40.8%(图4a),虽然定期向土壤中补充水分,并周期性切换电场极性,但水分消耗明显大于以往研究结果[26-27],可能由于本研究土壤盐度较高(1%),电流强度较大,因而所引起的电化学反应较强所致.土壤中水分含量的减少会导致土壤电阻增大,电流减小,从而对微生物群落产生负面影响[12,28].91d 后,CK 和BIO 处理土壤中,不同取样点土壤湿度无明显变化(P>0.05),而EK 和BIO-EK 处理土壤中,各点之间土壤湿度分布呈现不均匀的状态,整体来看,电极附近(a1、a2、b1 和b2)土壤湿度高于其它位点(P<0.05)(图4b),可能由于电渗析作用引起[29],但由于周期性切换电极极性,使得土壤湿度在空间上并未发生极端变化.

图4 不同处理土壤湿度随时间变化(a)及91d 不同取样点土壤湿度(b)Fig.4 Changes in soil moisture content with time in different treatments (a) and the soil moisture content at different sampling sites by day 91 (b)
2.4 土壤温度变化
图5 为不同处理中土壤温度随时间的变化.监测结果表明,土壤温度随处理时间呈现上下波动的趋势,但波动幅度有所不同,施加电场的试验组(EK和BIO-EK)与未施加电场的试验组(CK 和BIO)温度波动范围分别为26~32℃和27~37℃.施加电场的EK 和BIO-EK 组的平均温度比CK 和BIO 组的平均温度高1~7℃.而前期研究发现施加电场与未施加电场的试验组之间土壤温度无明显差异[7].Acar等[30]研究发现,不对电压梯度进行任何控制时,焦耳热可使土壤温度升高10~20℃.又有研究表明电流密度较小时往往观察不到热效应[31].在本研究中,由于较高的电流密度值,使得土壤产生了明显的温度变化.土壤温度适当升高,一方面可通过影响有机污染物的物理状态、化学组成等加快污染物的生物转化速率[32],另一方面可能通过影响微生物群落结构而影响污染物的降解效率[24].
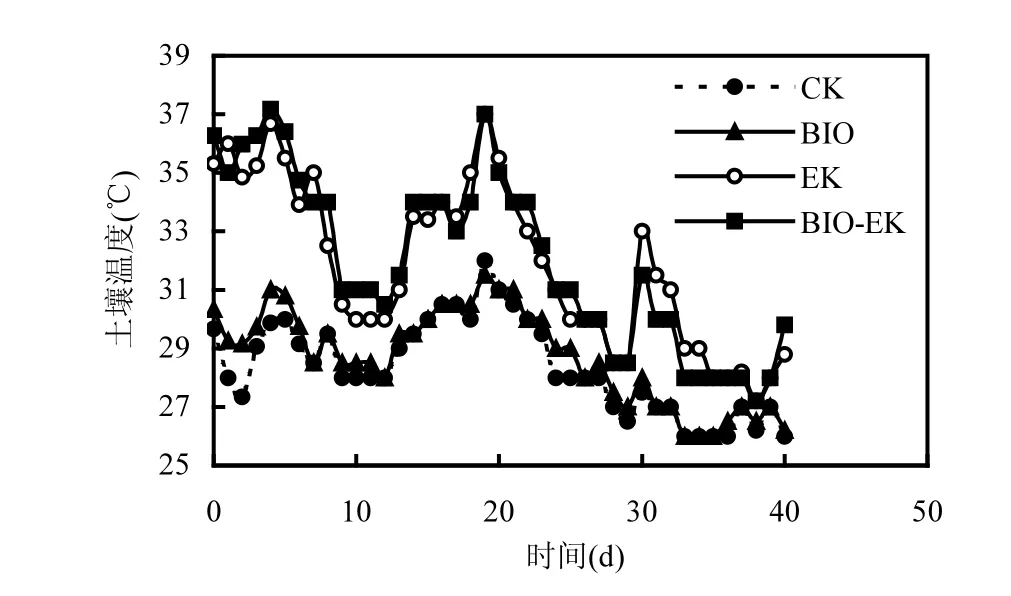
图5 不同处理土壤温度变化Fig.5 Changes in soil temperature in different treatments
2.5 土壤pH 值变化
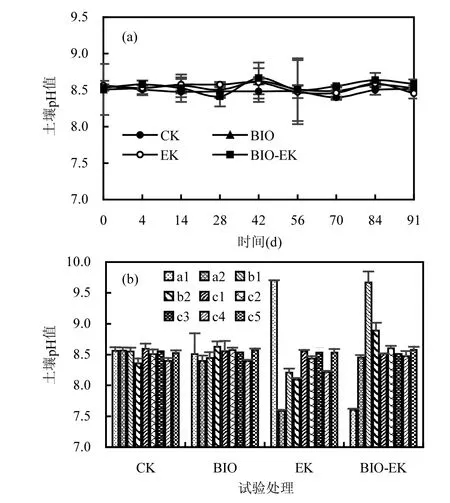
图6 不同处理土壤pH 值随时间变化(a)及91d 不同取样点土壤pH 值(b)Fig.6 Changes in soil pH with time in different treatments (a)and the soil pH at different sampling sites by day 91 (b)
由图6 可知,试验过程中,各处理土壤平均pH 值在较小范围内波动(8.42~8.67).CK 和BIO 试验中,各采样点之间pH值没有明显差异(P>0.05),而EK和BIO-EK 组不同点pH 值之间变化幅度较大,尤其表现在电极附近.具体来看,EK 和BIO-EK 中,电极附近的a1、a2、b1 和b2 点,pH 值变化范围分别为7.59~9.70 和7.60~9.67,而c1~c5 点之间的pH 值变化范围较小,分别为8.22~8.55 和8.48~8.60(图6b).当向土壤中施加电场时,电极上发生的电解水反应会使电极附近土壤pH 值发生大幅度变化[33],而该变化一方面可以通过影响土壤中离子的吸附与解吸、沉淀与溶解而影响电渗流的方向和速度,进而对土壤中污染物的存在形态、电化学氧化反应速率等产生重大影响[21],另一方面,可能通过影响微生物的活性、数量、多样性及群落结构等进而对污染物降解效率产生影响[34].本研究通过每30min 切换一次电极极性的方式消除了电极附近土壤极端pH 值的产生,但相较于前期研究结果[7],EK 和BIO-EK 电极附近土壤pH值仍有较大幅度的变化,可能与较强电流引起的较强的电化学反应有关,而该变化可能影响微生物群落结构,进而对污染物降解效果产生影响.
2.6 微生物群落变化
14 个样品测序共获得1,119,259 对Reads,双端Reads 拼接、过滤后共产生1,018,506 条Clean tags,每个样品至少产生49,213 条Clean tags,平均产生72,750 条Clean tags.在97%的相似度水平上对tags进行聚类,获得每个样品的 OTU 数,所有土样16SrRNA 测序文库覆盖率均大于99%,说明测序深度合理(表3).
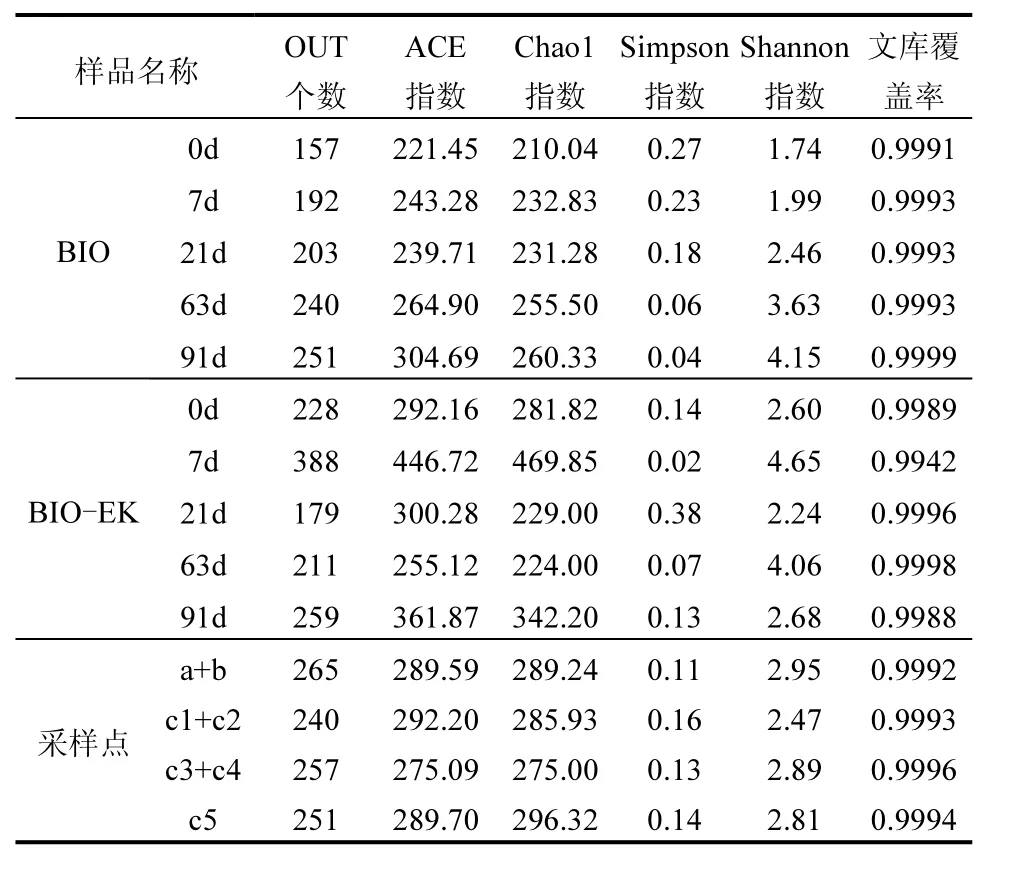
表3 土壤样品微生物丰度与多样性Table 3 Richness and microbial diversity indices in soil samples
2.6.2 微生物群落结构分析 根据主成分分析(Principal Component Analysis, PCA)(图7b),BIO 中0~21d 样品较为集中,63~91d 较为集中,说明0~21d微生物群落结构较接近,而63~91d 较接近,同时说明微生物群落变化主要发生在63d 后;施加了电场的BIO-EK 组各取样时间样品分布较分散, 说明电场的施加使微生物群落结构发生了明显的变化.同时,BIO-EK中不同采样点样品聚集在一起,说明不同取样点之间微生物群落结构变化较小.聚类分析(图7c)结果进一步表明,BIO 中微生物群落变化主要发生在63d 后,而BIO-EK 组中微生物群落结构在7d 后即发生了明显的变化,但在空间上的变化相对较小.
图7(d)显示了不同时间和不同位点土样中微生物种类在门水平上的组成和相对丰度.对各样品前10 种优势菌门的相对丰度进行分析,结果表明,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)丰度较高, 而这些菌门在烃类污染土壤的修复方面起重要作用[38-41].BIO 处理土壤中Firmicutes 在前63d 所占比例最高(42.7%~52.2%), 91d 时降低至19.0%,Proteobacteria 在前21d 的丰度(39.1%~48.7%)仅次于Firmicutes,后期则明显降低,至91d 时降至12.9%;Actinobacteria 和Bacteroidetes 的丰度整体上随处理时间呈现逐渐上升的趋势,至91d 时,分别由初始的0.5%和 0.2%增加至 34.1%和 23.4%.相较而言,BIO-EK处理土壤中微生物群落结构7d后即发生了明显变化.其中, Firmicutes 和Proteobacteria 均呈现先下降后上升的趋势,具体为,前21d 由初始的58.8%和31.4%分别降至11.5%和11.2%,至91d 时又分别上升至45.3%和22.1%; Actinobacteria 丰度随处理时间呈逐渐增加的趋势,91d 后其比例由初始的6.5%增至28.6%;且与BIO 不同的是,在7~63d 的土样中检测到了较高丰度的蓝藻门(Cyanobacteria),其丰度随时间呈现先上升后下降的趋势, 21d 比例达62.3%.研究表明,Cyanobacteria 可生活在极端环境中,能降解包括石油烃、PAHs 等在内的多种有机污染物[42].
纲水平(图7e)变化特征进一步说明BIO 处理土壤中微生物群落机构在63d 后发生了明显的变化,而施加了电场的BIO-EK 组,其土壤微生物群落结构变化尤为明显,7d 后即发生了明显变化.对各样品前10 种优势菌纲的相对丰度分析表明,BIO 中杆菌纲(Bacilli)和γ-变形菌纲(gammaproteobacteria)在前21d 丰度最大,分别为37.6%~50.3%和38.9%~48.6%,后期则快速降至8.6%~13.3%和2.4%~5.0%;放线菌纲(Actinobacteria)和拟杆菌纲(bacteroidia)丰度随处理时间大体上呈逐渐增加的趋势,至91d 时,其比例由初始的 0.5%和 0.2%分别上升至 34.0%和23.2%.BIO-EK 中Bacilli 和gammaproteobacteria 丰度在7d后即明显降低,21d后分别由初始的58.8%和31.4%降至11.5%和11.2%,后期又逐渐上升,91d 后分别增至45.2%和19.9%;7~63d 的土样中检测到了较高丰度的产氧光细菌纲(Oxyphotobacteria),其在21d 的丰度达62.3%.
不同取样点之间微生物群落组成相似,但各组成丰度有一定的变化.从门水平看,离电极最远的c5点,其 Actinobacteria (14.9%)丰度低于其他位点(20.8%~41.9%),而Firmicutes(41.7%)、Proteobacteria(29.0%)和Bacteroidetes (10.9%)丰度均稍高于其他位点(三个菌门丰度分别为30.4%~41.4%、19.7%~28.0%和 1.3%~6.4%).从纲水平看,不同取样点Bacilli 丰度变化范围为30.3%~38.5%;电极附近(a+b)土样中gammaproteobacteria (16.8%)丰度稍低于其它位点(22.7%~23.8%),而a+b和c1+c2点Actinobacteria(34.1%~39.8%)丰度稍高于其它位点(13.8%~18.1%).这种空间上的差异可能与土壤含水率(图4b)和pH值(图6b)所发生的空间上的变化有关[35].
不同处理时间及不同采样点土样中优势菌属的变化如图7f 所示.BIO 修复过程中,前21d 海杆菌属(Marinobacter)、葡萄球菌属(Staphylococcus)、枝芽孢杆菌属(Virgibacillus)和芽孢杆菌属(Bacillus)为优势菌属,其中Marinobacter 和 Bacillus 为试验初期所添加的外源菌株,说明其在芘污染盐碱土壤中具有较强的竞争力和适应性,而同时接种的代尔夫特菌属(Delftia)并未被检测到,说明其竞争力及适应性较弱. Marinobacter 是一种耐盐碱菌属,其可利用多种不同碳氢化合物作为碳和能量的唯一来源[43-44]; Bacillus 是一种常见烃类化合物降解菌属[45];研究证明Staphylococcus[46]、Virgibacillus[47]均具有PAHs 降解能力.BIO 修复后期优势菌属发生了明显的变化,且丰度明显降低,其中,63d 所检测出的 优 势 菌 属 为 uncultured_bacterium_f_Muribaculaceae 和乳杆菌属(Lactobacillus),而91d 后红球菌属(Rhodococcus)成为优势菌属,其被证明可产生胞外表面活性剂,能降解多种烃类化合物[48].BIO-EK 处理过程中,初始优势菌属为Bacillus、Marinobacter 和Staphylococcus,7d 后则发生了明显的变化,其中7~63d 主要的优势菌属为Lactobacillus、Rhodococcus和uncultured_bacterium_f_Muribaculaceae,91d 后Bacillus 和Marinobacter 丰度明显回升,除此之外,优势菌属还有Staphylococcus、盐单胞菌属(Halomonas)和气微菌属(Aeromicrobium).其中,Halomonas 多具有耐盐碱性[49],并具有PAHs 降解能力[50], Aeromicrobium 中的某些菌种也具有耐盐碱性[51],并具有PAHs 降解能力[52].不同取样点优势菌属为 Staphylococcus、Aeromicrobium、Marinobacter、 盐Halomonas 和Bacillus.
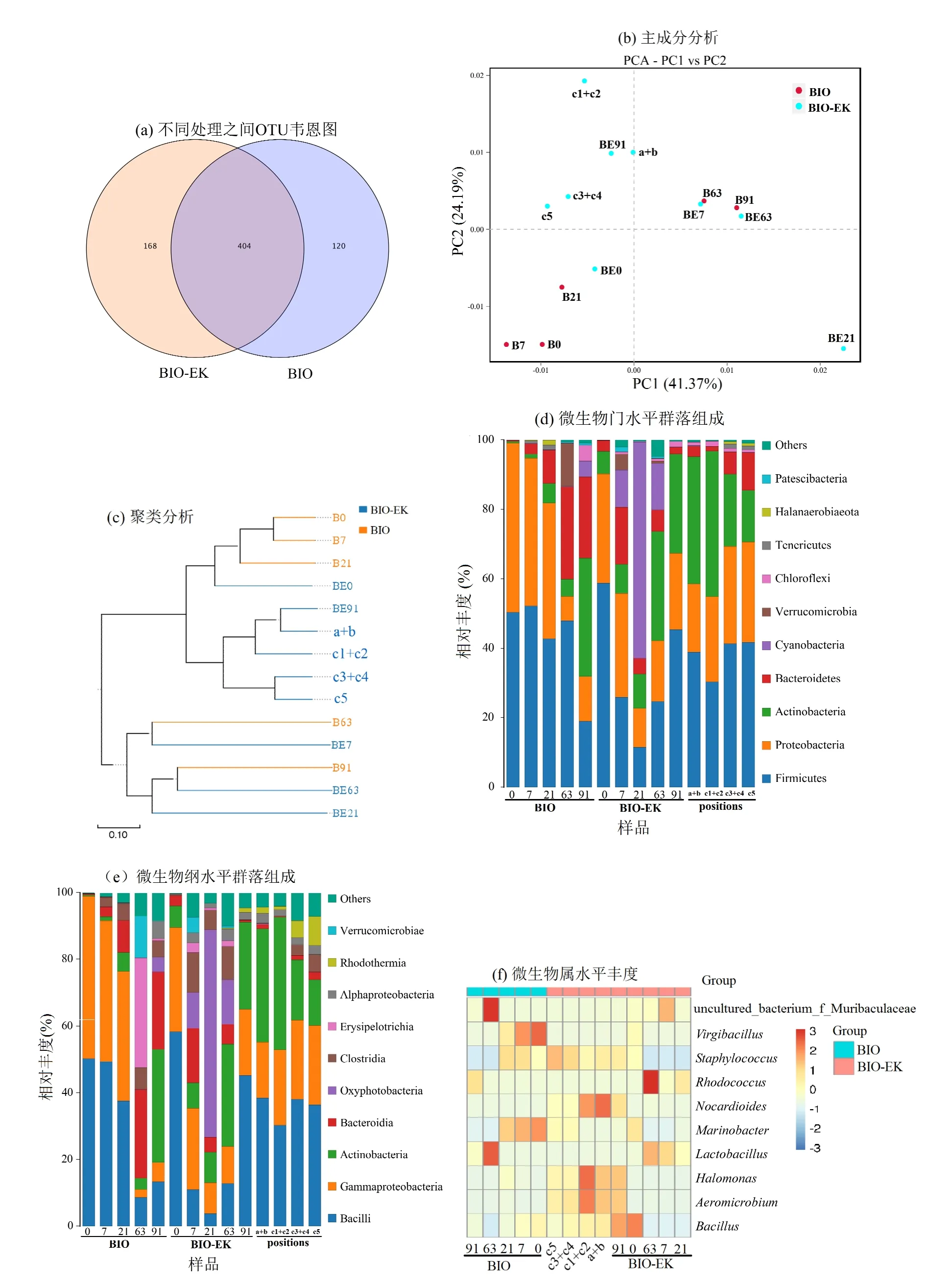
图7 土壤微生物群落变化Fig.7 Changes in soil microbial community
2.7 土壤环境因子与微生物群落结构的关系
土壤中污染物浓度的降低以及营养物质的消耗使得土壤营养比例发生变化,可能导致微生物群落结构改变,除此之外,BIO-EK 修复过程中,电场的施加引起土壤性质如pH 值、含水量、温度等发生变化,也可能导致土壤微生物群落的改变,进而影响到污染物的降解效率[27,35].为分析BIO 和BIO-EK处理过程中土壤环境因子与微生物群落结构的关系,以土壤中芘浓度、pH 值、土壤湿度(土壤含水量占最大持水量的比例)和温度为土壤环境变量,以微生物群落在属水平上的相对丰度为物种数据,作典型对应分析(CCA)(图8).根据图8a,前两个排序轴分别解释了BIO 处理土壤中微生物群落变化的48.5%和40.5%,前两轴总共解释了89.0%,轴1大部分被芘浓度、温度所解释,与Staphylococcus、Bacillus 呈正相关;轴2 主要被pH 值所解释,与Rhodococcus 呈正相关.根据图8b,前两个排序轴分别解释了BIO-EK 处理土壤中微生物群落变化的45.4%和24.1%,前两轴总共解释了69.5%,对微生物群落结构影响最大的因素为土壤pH 值,其次为芘浓度和土壤温度, 其与 Marinobacter 、Staphylococcus、Bacillus、Aeromicrobium 呈正相关,尽管BIO-EK 中土壤湿度有较大幅度的波动,但其对土壤微生物群落结构未产生重大影响.结果表明,土壤pH 值、芘浓度以及温度的变化是引起BIO 和BIO-EK 处理土壤中微生物群落结构发生变化的主要原因,而微生物群落结构的变化又可能是造成芘不能持续高效降解的重要原因.
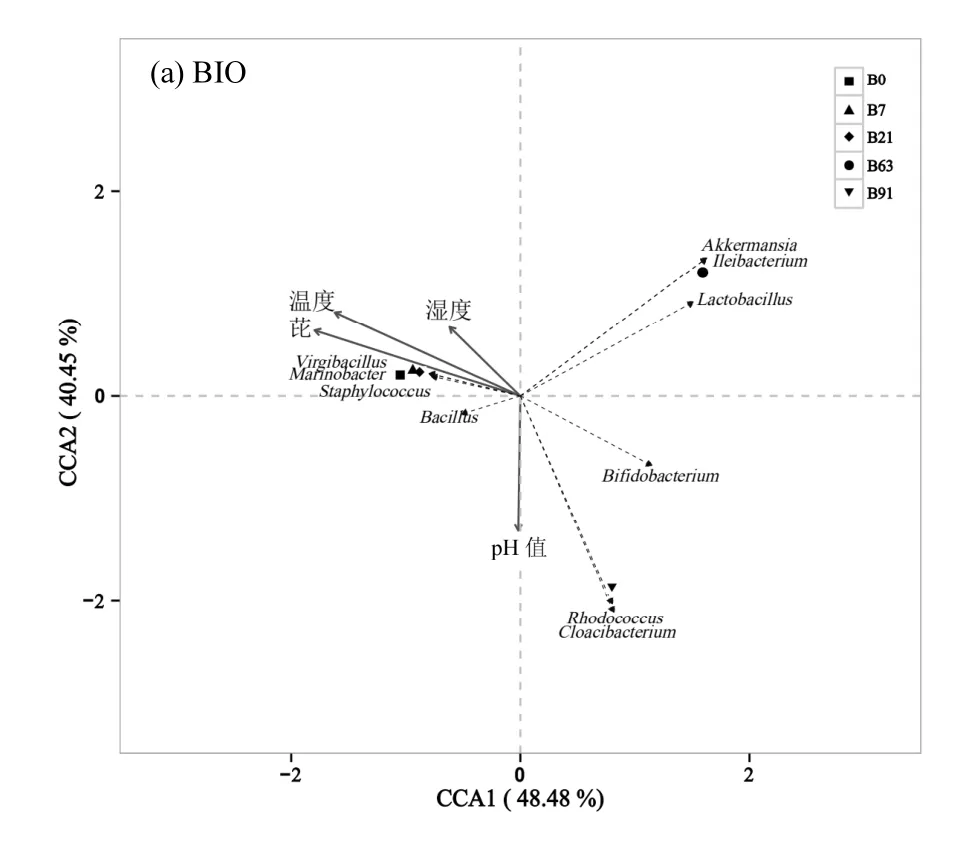
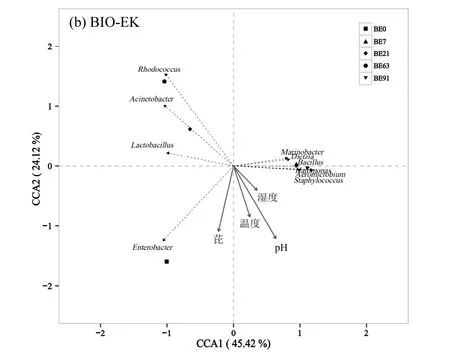
图8 BIO 和BIO-EK 处理过程中微生物群落结构与土壤环境因子的典型对应分析Fig.8 Canonical correspondence analysis (CCA) of microbial community composition and soil environmental factors in the treatments of BIO and BIO-EK
3 结论
3.1 BIO-EK 联合修复有利于促进土壤中芘的降解.在91d的处理过程中,BIO-EK中芘的降解速率常数为0.0151d-1,半衰期为45.90d,而单独的BIO 和EK修复中芘的降解速率常数分别为0.0111和0.0078d-1,半衰期分别为62.45 和88.87d;采用一级动力学模型拟合不同处理过程中石油的降解,回归方程的相关系数为0.9678~0.9827,模拟效果较好.
3.2 BIO-EK 处理过程中芘的降解不能持续高效地进行.CCA 分析表明,电场的施加所引起的土壤pH 值和温度的变化,修复过程中芘浓度的变化,以及由此引起的微生物群落结构的变化可能是导致芘不能持续高效降解的重要原因.
3.3 通过调节土壤微环境、构建高效降解菌剂等方式对BIO-EK 修复过程进行调控,有望达到持续高效降解污染物的目的.
