白背飞虱取食后水稻幼苗内源激素变化研究
2021-03-17韦雪露卢柏亦黄福钢李发活刘芳邱永福
韦雪露 卢柏亦 黄福钢 李发活 刘芳 邱永福
白背飞虱取食后水稻幼苗内源激素变化研究
韦雪露#卢柏亦#黄福钢 李发活 刘芳 邱永福*
(广西大学农学院,南宁 530004; #共同第一作者;*通信联系人, E-mail: yfqiu@126.com)
【】研究白背飞虱取食后苗期水稻内源激素含量变化规律及其合成途经相关基因的差异表达,为进一步解析内源激素调控水稻白背飞虱抗性机理提供参考。利用UPLC-MS方法测定了白背飞虱敏感材料9311与抗性近等基因系(NIL)在白背飞虱取食0、24和48 h后植株水杨酸(SA)、脱落酸(ABA)、茉莉酸(JA)和生长素(IAA)4种激素含量的变化;qRT-PCR分析5个与激素合成途径相关基因在抗、感植株中表达水平的差异。激素含量测定结果表明,白背飞虱取食的48 h内,NIL中SA含量先升后降,而在9311中先降后升;ABA的含量在NIL中波动较小,而在9311中先升后降;IAA和JA在抗、感植株中均持续上升。激素合成途径相关基因、、和在接虫后24 h的表达量差异在抗、感植株中均达到显著或极显著水平,而在0 h和48 h差异不显著。则在接虫后48 h的表达量差异在抗、感植株达到显著水平,而接虫0和24 h后差异不显著。在接虫或者对照处理中,JA和ABA含量在抗性植株中均高于感虫植株,可能与抗性基因有较大关系;而SA含量和基因表达水平均表明抗性植株对白背飞虱的取食响应更迅速,在抗虫过程中能够起到明显的调控作用。
水稻;白背飞虱;内源激素;qRT-PCR
白背飞虱[(Horváth)]是威胁水稻生产的重要害虫之一,能影响水稻生理代谢过程,导致植株生长缓慢,分蘖延迟,瘪粒增加,植株黄化、矮缩,甚至枯死,进而严重影响水稻的产量和品质[1, 2]。
植物内源激素指植物自身合成的,微小剂量即可对植物的生长发育、抗逆性以及衰老等过程进行调控的生物活性物质[3]。研究表明,水杨酸(SA)、茉莉酸(JA)、脱落酸(ABA)等植物激素在植物与害虫互作体系中发挥重要作用[4-5]。烟粉虱取食能显著诱导拟南芥或番茄植株内源SA含量增加[6];而当它取食不同抗性的辣椒后JA含量均呈现先降后升的趋势,JA合成相关基因和的表达上调[7]。另外,蚜虫的取食均能提高不同钾水平处理的小麦植株中JA含量[8]。巢豆油壶菌的侵害能明显提高蚕豆病变部位的IAA含量[9]。植物内源激素含量的变化,能进一步介导植物的防御反应。例如,昆虫唾液效应因子通过激活植物水杨酸信号途径促进昆虫存活和繁殖[10]。损伤累积的JA能够诱导相关防御基因的表达,并诱导植物产生具有挥发性的茉莉酸甲酯,实现植物间的远距离防御信号传播[11]。内源激素间互作调控植物抗性的研究也有报道,如SA与JA之间协同作用和拮抗作用受其自身的相对浓度调控[12-13];而JA与ABA之间能协同参与抗虫[14-15]。可见,在植物与昆虫的互作过程中,不同类型的植物内源激素起着非常重要的作用。
褐飞虱与白背飞虱同属飞虱科昆虫,它取食抗性水稻品种后叶片中ABA含量先升后降,而感虫品种持续上升[16]。类似的研究也发现褐飞虱取食后导致水稻植株中SA、JA、乙烯(ETH)的含量上升,且普遍认为SA和JA参与水稻对褐飞虱的防御反应[17-19]。在水稻与白背飞虱的互作过程中,前期研究主要关注白背飞虱所传播的病毒对水稻的影响。例如,无论携带南方水稻黑条矮缩病毒与否,白背飞虱取食后SA含量呈上升趋势而JA含量呈下降趋势[20]。总之,对水稻与白背飞虱的互作中植物内源激素含量的变化研究偏少,有利于解析内源激素在水稻抗白背飞虱调控中的作用,对综合防控白背飞虱危害具有重要的参考价值。
1 材料与方法
1.1 水稻材料
抗性近等基因系(简称NIL)由抗虫品系RBPH327与感虫品系9311杂交和多代回交获得,携带抗褐飞虱主效基因且兼抗白背飞虱[21]。白背飞虱虫源从南宁市郊区水稻田收集并在感性品种“台中本地1号”(TN1)上繁育。实验过程中采用2~3龄的若虫。
1.2 试验设计
种子经消毒、浸种催芽后播于盛有15 cm厚稻田泥的塑料桶(直径26 cm,高18 cm),每个桶平均分成两半,各播种约50粒抗、感材料的种子。待幼苗长至2叶龄,按每株平均接入8~10头2~3龄白背飞虱若虫。当>90%的9311植株死亡时,评价抗、感材料的抗性级别。评价方法参照国际水稻所和Yang等[21],根据植株生长状况分别评定为0、1、3、5、7、9 级别,每个材料所有单株的平均值为抗虫级别。实验设置3个重复。
用于苗期激素含量测定和基因定量表达分析的材料播种于塑料杯(直径10 cm,高16 cm)中,每杯播8粒。待幼苗长至4叶龄,去除弱苗,每杯仅保留5株健壮幼苗,按每株接入10头2~3龄的白背飞虱若虫。按取食时间0、24、48 h设置,每个材料的每个时间点设4个生物学重复,并在处理后48 h统一取样。剪去水稻叶片,用锡箔纸包裹叶鞘后液氮速冻,于−80℃冰箱中保存。
1.3 水稻内源激素含量测定
配置甲醇∶水∶甲酸的体积比为75∶20∶5的Mod-Bielesk溶液,每10 mL Mod-Bielesk加入0.1 g的交联聚乙烯吡咯烷酮得到提取液。样品加液氮研磨,称取0.1 g加入0.5 mL提取液中,在冰水混合条件下超声30 min,4℃条件下静置16 h;接着加入1 mL二氯甲烷,超声1 h,4℃条件下离心15 min,取下清液,氮吹至干;最后加入500 μL 50%色谱级甲醇水溶液(0.1%甲酸)复溶,溶液过孔径为0.2 μm的NYLON66有机滤膜,得到植物激素待测液。
利用超高效液相-质谱联用仪UPLC I-CLASS-XEVOG2-XSQTOF测定植物激素浓度, UPLC-MS方法所用条件如下:色谱柱(CNW Athena C18-WP),柱温40℃,流动相A为0.1%的甲酸,B为甲醇,进样量 10 μL,流速0.4 mL/min。离子源为电喷雾离子源(ESI),正、负离子扫描,多反应监测(MRM),毛细管电压为4.8 kV,锥孔电压为45 V,挡板电压为700 V,离子源温度为105℃,锥孔气体流量为72 L/h ,脱溶剂气体温度为450℃,脱溶剂气体流速为300 L/h。
1.4 总RNA提取与qRT-PCR检测
采用Up Plus RNA Kit方法提取总RNA,HiScript Ⅲ RT SuperMix反转录试剂盒将样品RNA反转录为cDNA。以反转录产物为模板,水稻为内参基因,采用TransGen Biotech公司的PerfectStartTMGreen qPCR SuperMix试剂盒及ABI-7500 荧光定量PCR仪进行qRT-PCR检测。qRT-PCR所用引物序列见表1,其中基因和参与植物体内SA合成调控[22, 23]。基因、和分别是JA、ABA和IAA合成途径相关基因[24-26]。

表1 本研究所用引物序列
1.5 数据分析
采用STST软件对表达量进行测验分析,<0.05和<0.01分别为显著和极显著差异。
2 结果与分析
2.1 抗虫鉴定结果
如图1所示,在接虫15 d后,绝大多数NIL植株表现正常的绿色,少部分植株的第一叶变黄,而9311基本枯萎,仅剩极少数单株存活;它们对白背飞虱的平均抗性值分别为3.5和8.4。可见,NIL高抗白背飞虱,而9311表现高感虫性。
2.2 内源激素含量的变化
接虫48 h内,NIL植株内SA含量先升后降,而9311中先降后升。接虫48 h时,9311的SA含量高于NIL。与0 h相比,NIL接虫24 h时SA含量上升7.4%,48 h时下降5.4%;而9311在接虫24 h时SA含量下降13.3%,48 h时上升7.3%(图2-A)。
接虫48 h内,NIL和9311的JA含量均呈现上升,24~48 h增幅明显,且NIL的JA含量均高于9311。在接虫处理48 h,NIL和9311的JA含量分别是0 h时的4倍和8倍。表明JA在NIL、9311中对白背飞虱取食的应答迅速(图2-B)。
NIL接虫后48 h内ABA的含量均高于9311,且两者在接虫和对照处理间变化较小。其中,NIL中ABA含量为8~10 ng/g,而9311中ABA的含量为5~7 ng/g(图2-C)。

A-苗期抗虫鉴定;B-抗性值。**表示差异极显著(P < 0.01)。

图2 白背飞虱取食后抗、感植株内源激素含量的变化
与0 h比较,9311植株中IAA含量在接虫处理24 h显著上升,增加24.3%,然后保持较稳定的激素含量。NIL植株中IAA含量在接虫24 h与0 h相似,而在接虫48 h含量显著增加,比未接虫处理增加了10.9%。可见,在白背飞虱处理过程中,抗、感材料中IAA含量的变化规律不同(图2-D)。
2.3 SA和JA合成途径相关基因qRT-PCR分析
接虫48 h内NIL中的表达量先升后降,而其在9311中的表达量变化较小;在未接虫(0 h)和接虫处理24 h时抗、感植株间表达量呈现显著差异(图3-A)。在抗、感材料中表达量的变化规律与相似,表达量的显著差异出现在接虫48 h(图3-B),表明和可能协同参与白背飞虱取食的响应过程。
接虫48 h内基因在NIL中的表达量先上升后下降,但变幅较小;而在9311中的表达量持续上升,且在接虫24 h与NIL相比存在显著差异。另外,该基因在未接虫处理(0 h)时,抗、感植株间的表达量也存在显著差异(图3-C)。
2.4 ABA和IAA合成途径相关基因qRT-PCR
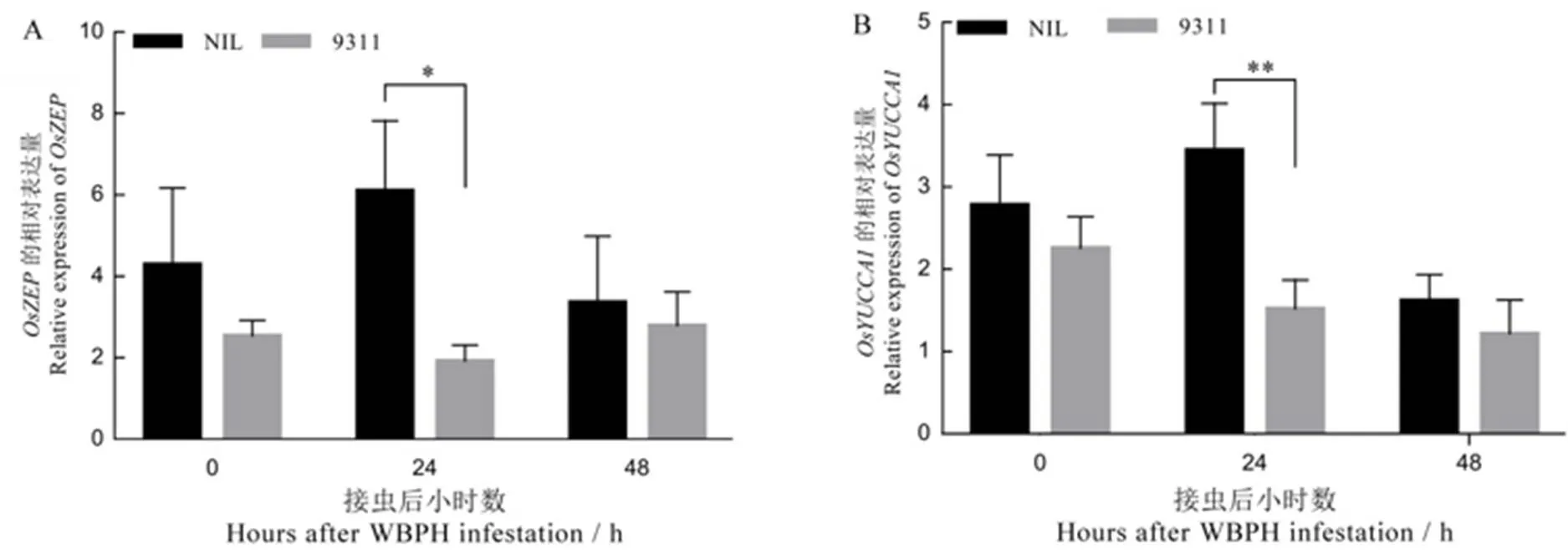
接虫48 h内,基因在NIL中的表达量先升后降,而在9311中先降后升,且在NIL中的表达量均高于9311,并在接虫24 h达到显著差异(图4-A)。表明NIL可能通过提高ABA含量来抑制白背飞虱的取食。随着白背飞虱取食时间延长,在NIL中基因的表达先升后降,而在9311中持续降低。该基因在NIL中的表达水平均高于9311,在24 h时抗、感材料间达到极显著差异(图4-B)。
3 讨论
植物的生长发育和应对外部环境的生物胁迫与非生物胁迫涉及多种内源信号分子,其中植物激素作为基础调控因子参与到植物抵御昆虫取食的调控过程,如SA作为一种重要的细胞信号分子在植物诱导抗虫反应中也发挥着重要作用[6, 15, 19]。在本研究中,接虫处理后,SA含量变化在抗、感材料中表现相反的规律,例如在抗性材料中,接虫处理的0~24 h内,SA开始累积合成,而感性材料在虫处理24 h后,SA含量才增加,这表明抗性基因可能在SA调控水稻抗白背飞虱过程中的启动更加迅速。这与SA合成调控基因表达量检测结果一致(图2和图3)。9311和NIL中JA含量在白背飞虱取食后都出现激增,基因的表达量在0~24 h也呈现递增趋势,但近等基因系NIL在48 h出现下调,下调现象是否与NIL中抗性基因的调控有关有待进一步研究。基因表达和SA合成相关基因、均出现“同升同降”的现象,可能是这两种激素间存在一种相互制约平衡的机制,这与褐飞虱取食中的研究结果一致[17]。

*和**表示在抗、感材料中表达量存在显著和极显著差异。
*和**表示在抗、感材料中表达量存在显著和极显著差异。
ABA不仅调控非生物胁迫应答,在应对各种生物胁迫反应中发挥重要的调控作用。在本研究中,NIL接虫处理48 h内ABA含量均高于9311,表明ABA正向参与水稻抗白背飞虱的调控。有研究表明,高浓度的ABA能提高胼胝质合成酶的活性,而胼胝质在水稻抗稻飞虱的抗性机理起到重要作用[27]。另外,本研究发现抗、感植株中ABA与SA的升降趋势刚好相反,推测两者在白背飞虱处理过程中可能存在拮抗作用。IAA不仅在植物生理代谢、器官发育中起到重要作用,也与植物干旱、低温、盐碱等逆境胁迫以及病原菌、昆虫等生物胁迫密切相关。它能够独立地或与SA、JA等激素互作共同参与到植物免疫调控网络[17]。与SA含量变化规律相反,IAA在应答白背飞虱取食的速度上NIL要慢于9311,表现在白背飞虱取食24 h时NIL中IAA含量与0 h基本持平,而9311有明显增加。另外,本研究结果表明,在白背飞虱处理后抗、感植株中IAA的含量均上升,而其合成相关基因的表达量却下调,这表明IAA可能在水稻抗白背飞虱的过程中未发挥调控作用。可见,在水稻与白背飞虱互作过程中植物内源激素含量的变化过程非常复杂。
综上所述,本研究通过分析白背飞虱取食后水稻苗期内源激素含量变化及合成途径相关基因的差异表达,发现在接虫或者对照处理中,JA和ABA含量在抗性植株中均高于感性植株,可能与抗性基因有一定的关系;而SA含量及其相关基因表达水平均表明抗性植株对白背飞虱的取食响应更迅速,在抗虫过程中能够起到明显的调控作用。
[1] 沈君辉, 尚金梅, 刘光杰. 中国的白背飞虱研究概况[J]. 中国水稻科学, 2003 (S1): 12-27.
Shen J, Shang G, Liu G. Management of the whitebacked planthopper,in China: A mini-review[J]., 2003(S1): 12-27. (in Chinese with English abstract)
[2] 朱永生, 白建林, 谢鸿光, 吴方喜, 罗曦, 姜身飞, 何炜, 陈丽萍, 蔡秋华, 谢华安, 张建福. 聚合白背飞虱和褐飞虱抗性基因创制杂交水稻恢复系[J]. 中国水稻科学, 2019, 33(5): 421-428.
Zhu Y, Bai J, Xie H, Wu F, Luo X, Jiang S, He W, Chen L, Cai Q, Xie H, Zhang J. Breeding restore lines of hybrid rice by pyramiding genes for resistance to white backed planthoppers and brown planthoppers[J]., 2019, 33(5): 421-428. (in Chinese with English abstract)
[3] 段娜, 贾玉奎, 徐军, 陈海玲, 孙鹏. 植物内源激素研究进展[J]. 中国农学通报, 2015, 31(2): 159-165.
Duan N, Jia Y, Xu J, Chen H, Sun P. Research progress on plant endogenous hormones[J]., 2015, 31(2): 159-165. (in Chinese with English abstract)
[4] Sugio A, Kingdom H N, MacLean A M, Grieve V M, Hogenhout S A. Phytoplasma protein effector SAP11 enhances insect vector reproduction by manipulating plant development and defense hormone biosynthesis[J]., 2011, 108: E1254-1263.
[5] Dicke M. Induced Responses to Herbivory by R. Karban and I. T. Baldwin[J]., 1998, 13(2): 83.
[6] 俞晓平, 何瑜晨, 郦卫弟, 赵婵, 赵昭, 张蓬军. 水杨酸信号路径在调控入侵生物烟粉虱诱导植物间接防御中的作用[J]. 中国计量大学学报, 2017, 28(1): 1-6, 34.
Yu X, He Y, Li W, Zhao C, Zhao Z, Zhang P. A study on the role of salicylic acid signaling pathways in mediating whitefly-induced indirect plant defense[J]., 2017, 28(1): 1-6, 34. (in Chinese with English abstract)
[7] 张海波. 烟粉虱(Gennadius)取食及外源JA处理对辣椒(L.)内源JA、SA的影响[D]. 扬州: 扬州大学, 2018.
Zhang H. Effects of(Gennadius) feeding and exogenous JA treatment on endogenous JA and SA ofL[D]. Yangzhou: Yangzhou University, 2018. (in Chinese with English abstract)
[8] 王祎, 张月玲, 苏建伟, 李慧, 王宜伦, 苗玉红, 谭金芳, 韩燕来. 施钾提高蚜害诱导的小麦茉莉酸含量和叶片相关防御酶活性[J]. 生态学报, 2014, 34(10): 2539-2547.
Wang Y, Zhang Y, Su J, Li H, Wang Y, Miao Y, Tan Y. Potassium application for increased jasmonic acid content and defense enzyme activities of wheat leaves infested by aphids[J]., 2014, 34(10): 2539-2547. (in Chinese with English abstract)
[9] 严吉明, 叶华智. 巢豆油壶菌与蚕豆相互作用下植物内源激素的动态[J]. 植物病理学报, 2013, 43(3): 328-332.
Yan J, Ye H. Dynamics of endogenous phytohormone in broad bean leaf infected by[J]., 2013, 43(3): 328-332. (in Chinese with English abstract)
[10] Xu H, Qian L, Wang X, Shao R, Hong Y, Liu S, Wang X. A salivary effector enables whitefly to feed on host plants by eliciting salicylic acid-signaling pathway[J].2019, 116(2): 490-495.
[11] Farmer E E, Ryan C A. Interplant communication: Airborne methyl jasmonate induces synthesis of proteinase inhibitors in plant leaves[J].,1990, 87: 7713-7716.
[12] Yuan H, Liu W, Lu Y. CATALASE2 coordinates SA-mediated repression of both auxin accumulation and JA biosynthesis in plant defenses[J]., 2017, 21: 143-155.
[13] 王文艳. 葡萄水杨酸和茉莉酸信号转导途径中4个重要基因的克隆及表达分析[D]. 南京:南京农业大学, 2011.
Wang W. Cloning and expression analysis of four important grapevine genes involved in SA and JA signaling pathways[D]. Nanjing: Nanjing Agricultural University, 2011. (in Chinese with English abstract)
[14] Dinh S T, Galis B I. Thegene enhances abscisic acid levels and defenses against herbivores inplants[J]., 2013, 162(4): 2106-2124.
[15] 张杰, 董莎萌, 王伟, 赵建华, 陈学伟, 郭惠珊, 何光存, 何祖华, 康振生, 李毅, 彭友良, 王国梁, 周雪平, 王源超, 周俭民. 植物免疫研究与抗病虫绿色防控:进展、机遇与挑战[J]. 中国科学: 生命科学, 2019, 49(11): 1479-1507.
Zhang J, Dong S, Wang W, Zhao J, Chen X, Guo H, He G, He Z, Kang Z, Li Y, Peng Y, Wang G, Zhou X, Wang Y, Zhou J. Plant immunity and sustainable control of pests in China: Advances, opportunities and challenges[J]., 2019, 49(11): 1479-1507. (in Chinese with English abstract)
[16] 刘井兰, 吴进才, 于建飞, 杨国庆. 褐飞虱侵害后不同水稻品种根及叶片脱落酸含量的变化[J]. 昆虫学报, 2010, 53(5): 531-539.
Liu J, Wu J, Yu J, Yang G. Changes in levels of abscisic acid in roots and leaves of different rice varieties under infestation by(Stål) (Homoptera: Delphacidae)[J]., 2010, 53(5): 531-539. (in Chinese with English abstract)
[17] ZhaoY, Huang J, Wang Z, Jing S, Wang Y, Ouyang Y, Cai B, Xin X, Liu X, Zhang C, Pan Y, Ma R, Li Q, Jiang W, Zeng Y, Shangguan X, Wang H, Du B, Zhu L, Xu X, Feng Y, He S, Chen R, Zhang Q, He G. Allelic diversity in an NLR geneenables rice to combat planthopper variation[J]., 2016, 113(45): 12 850-12 855.
[18] Cheng J. Role of ethylene signaling in the production of rice volatiles induced by the rice brown planthopper[J]., 2006(20): 2457-2465.
[19] 徐涛, 周强, 陈威, 张古忍, 何国锋, 古德祥, 张文庆. 茉莉酸信号传导途径参与了水稻的虫害诱导防御过程[J]. 科学通报, 2003(13): 1442-1446.
Xu T, Zhou Q, Chen W, Zhang G, He G, Gu D, Zhang W. Jasmonic acid signaling pathway is involved in the process of pest-induced defense in rice[J]., 2003(13): 1442-1446. (in Chinese with English abstract)
[20] Li P, Liu H, Li F, Liao X L, Shahbaz A. A virus plays a role in partially suppressing plant defenses induced by the viruliferous vectors[J]., 2018, 8: 9027.
[21] Yang M, Lin J, Cheng L, Zhou H, Chen S, Liu F, Li R, Qiu Y. Identification of a novel planthopper resistance gene from wild rice (Griff.)[J]., 2020. https://doi.org/10.1016/j.cj.2020. 03.011.
[22] Pallas J A, Paiva N L, Lamb C. Tobacco plants epigenetically suppressed in phenylalanine ammonia-yase expression do not develop systemic acquired resistance in response to infection by tobacco mosaic virus[J]., 1996, 10(2): 281-293.
[23] Verberne M C, Muljono R A B, Verpoorte R. Chapter 13: Salicylic acid biosynthesis[J]., 1999, 33(8): 295-312.
[24] Schaller F, Schaller A, Stintzi A. Biosynthesis and Metabolism of jasmonates[J]., 2004, 23(3): 179-199.
[25] Nambara E, Marion-Poll A. Abscisic acid biosynthesis and catabolism[J]., 2005, 56: 165-185.
[26] Yamamoto Y, Kamiya N, Morinaka Y, Matsuoka M, Sazuka T. Auxin biosynthesis by thegenes in rice[J]., 2007, 143(3): 1362-1371.
[27] 许有友. 脱落酸对水稻胼胝质及其酶的调节及在抗褐飞虱中的作用[D]. 扬州:扬州大学, 2016.
Xu Y. The study on regulation of abscisic acid in rice callose and enzyme and functions in rice resistance to(Stål) (Hemiptera: Delphacidae)[D]. Yangzhou: Yangzhou University, 2016. (in Chinese with English abstract)
Changes in Endogenous Hormones in Rice Seedlings Infested by White-backed Planthoppers
WEI Xuelu#, LU Baiyi#, HUANG Fugang, LI Fahuo, LIU Fang, QIU Yongfu*
(College of Agriculture, Guangxi University, Nanning 530004, China;#These authors contributed equally to this work;*Corresponding author, E-mail: yfqiu@126.com)
【】It is of great importance to study the changes of endogenous hormone concentration and relative expression level of associated genes in rice seedling after infestation by white-backed planthoppers (WBPH), which would provide reference for insight into WBPH resistance mechanism regulated by endogenous hormones.【】Salicylic acid (SA), abscisic acid (ABA), jasmonic acid (JA), and auxin (IAA) in susceptible line 9311 and near isogenic line (NIL) of resistance were quantified using UPLC-MS at 0, 24, and 48 h after infestation by WBPH; and the relative expression levels of five associated genes between resistant and susceptible lines were detected by qRT-PCR.【】SA concentration in NIL increased at 24 h after WBPH infestation and decreased at 48 h after WBPH infestation as compared to the untreated line; while it was on the contrary in 9311. ABA concentration was relatively stable in NIL after WBPH infestation, but increased at 24 h and then decreased at 48 h after WBPH infestation in 9311. Both IAA and JA concentration continuously increased in resistant and susceptible lines after infestation treatment. The result of qRT-PCR indicated that the relative expression levels of hormone pathway-related genes,,, andwere significantly different at 24 h after WBPH infestation between resistant and susceptible lines, but no significant difference was observed at 0 and 48 h after WBPH infestation. However, the relative expression level ofshowed significant difference at 48 h after WBPH infestation between the resistant and susceptible lines; whereas no significant difference was detected at 0 or 24 h after WBPH infestation.【】JA and ABA concentration in the resistant plants were higher than those in the susceptible ones, which was possibly associated with the resistant genes. SA concentration and the relative expression level of its associated genesandindicated that the resistant line responded more quickly to WBPH infestation, which suggested that it might play an important role during insect infestation.
rice;(Horváth); endogenous hormones; qRT-PCR
10.16819/j.1001-7216.2021.0815
2020-08-22;
2020-09-16。
国家自然科学基金资助项目(31360325); 大学生创新创业训练计划资助项目(20190593296)。
