加热诱导抗原修复技术对HE染色淋巴瘤核固缩的影响
2021-03-17陈余朋唐坚清
陈余朋,张 声,唐坚清
淋巴瘤的治疗效果依赖于正确的病理诊断,而正确的病理诊断离不开优良的组织切片[1]。优良的淋巴瘤组织切片表现为切片薄、细胞无重叠、细胞核及染色质形态清晰等。在日常病理诊断工作中,有少部分的淋巴瘤标本,由于前期组织处理不佳,HE染色后出现严重的细胞核固缩现象,造成病理诊断和分型困难。近年有研究采用加热诱导抗原修复来解决HE染色发灰现象。关于采用加热诱导抗原修复来解决细胞核固缩问题,目前文献报道较少。本文采用加热诱导抗原修复技术解决HE染色淋巴瘤中细胞核固缩现象,探讨其临床应用价值。
1 材料与方法
1.1 材料收集2019年1~12月福建医科大学附属第一医院外检及外院送检会诊,因组织前期处理不佳的淋巴瘤标本8例(包括组织固定欠佳5例、组织干涸1例、脱水不足2例),均为HE染色时出现细胞核固缩现象标本。
1.2 仪器设备Leica RM2245石蜡切片机、苏泊尔高压锅、耐高温塑料染色架、美的电磁炉、Leica ST5020全自动HE染色仪。
1.3 试剂柠檬酸盐缓冲液(pH 6.0)、Tris-EDTA(pH 9.0)抗原修复液、Mayer苏木精染色液、醇溶性伊红、1%盐酸乙醇。
1.4 方法(1)本实验分为五组,每一批次实验五组切片均为同一组织,第一组为对照组,脱蜡水化后组织切片无需修复;第二组为酸性高压组,组织切片置于耐高温塑料切片架上,放入已煮沸柠檬酸盐缓冲液(pH 6.0)中,盖紧锅盖,高压喷气2 min,自然冷却;第三组为碱性高压组,组织切片置于耐高温塑料切片架上,放入已煮沸的Tris-EDTA(pH 9.0)抗原修复液中,盖紧锅盖,高压喷气2 min,自然冷却;第四组为酸性水浴组,组织切片置于耐高温塑料切片架上,放入已煮沸的柠檬酸盐缓冲液(pH 6.0)抗原修复液中,电磁炉调节到保温状态,盖好锅盖,热孵育20 min,自然冷却;第五组为碱性水浴组,组织切片置于耐高温塑料切片架上,放入已煮沸的Tris-EDTA(pH 9.0)抗原修复液中,电磁炉调节到保温状态,盖好锅盖,热孵育20 min,自然冷却;(2)将五组切片放入Leica ST5020全自动HE染色仪中染色,Mayer苏木精染色液染10 min,水洗;1%盐酸乙醇分化10 s;流水冲洗返蓝5 min;伊红染1 min,梯度乙醇脱水,二甲苯透明,中性树胶封固,镜下观察。
1.5 结果判读由两位病理医师对HE染色切片进行双盲式阅片,参考《临床技术操作规范·病理学分册》[2]标准,根据实际情况制定评分标准:细胞大小合适(2分);细胞核无固缩现象(3分);肿瘤性大细胞与背景反应性小细胞分界清楚(3分);细胞核与细胞质染色对比清晰(2分)。HE染色切片优≥8分,良为6~7分,差≤5分。
1.6 统计学分析采用SPSS 19.0统计软件进行统计学分析。用Fisher精确概率法分析比较4种处理方法与对照组HE染色效果的差异,P<0.05为差异有统计学意义。
2 结果
2.1 五组切片HE染色形态观察HE染色结果,对照组8例淋巴瘤镜下HE染色形态均出现核固缩现象,严重影响正确的病理诊断(图1)。酸性高压组HE染色优良率为87.5%(7/8)(图2),碱性高压组HE染色优良率为37.5%(3/8)(图3),酸性水浴组HE染色优良率为25%(2/8),碱性水浴组HE染色优良率为25%(2/8)(图4),HE染色优良率酸性高压组优于碱性高压组,酸性水浴组与碱性水浴组染色结果较一致,酸性高压组能很好地恢复淋巴瘤核固缩现象。
2.2 Fisher精确概率法检验五种处理方法HE染色结果评分四种处理方法与对照组相比差异有统计学意义,优于对照组,以酸性高压组处理优良率最高(P<0.05,表1)。
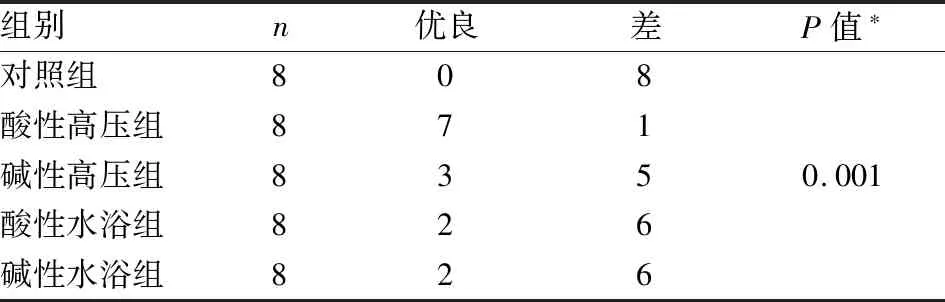
表1 五种处理方法HE染色效果差异性比较
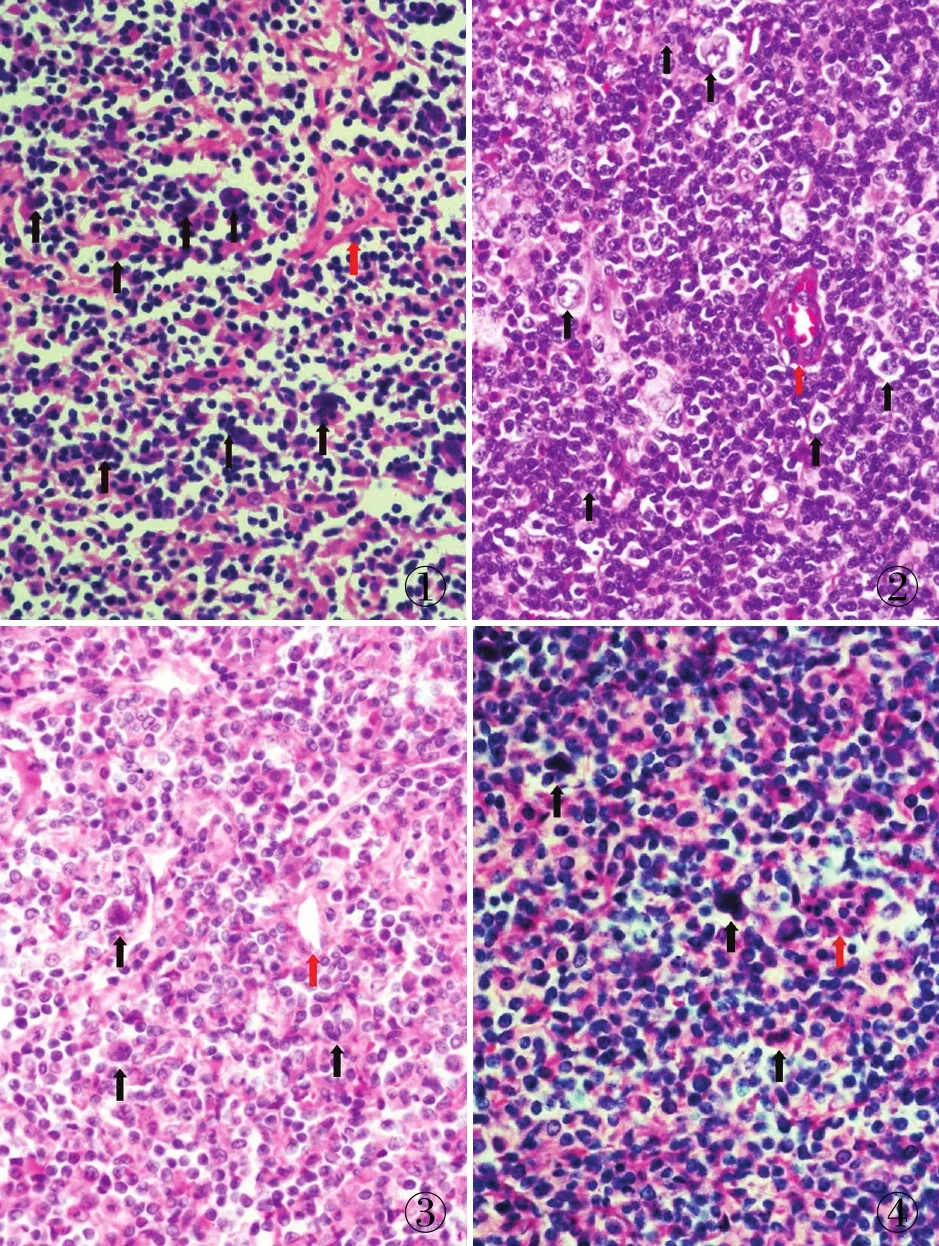
图1 对照组:组织明显固缩,肿瘤细胞及背景反应性淋巴细胞体积缩小,胞质红染,细胞核固缩,细胞核形态无法观察(红箭头为定位血管,黑箭头疑为肿瘤细胞) 图2 酸性高压组:细胞大小合适,肿瘤细胞及背景反应性淋巴细胞核染色质形态清晰,肿瘤细胞及背景细胞形态差异明显,可见泡状核及嗜酸性大核仁(红箭头为定位血管,黑箭头为肿瘤性大细胞) 图3 碱性高压组:肿瘤细胞及背景反应性淋巴细胞均呈肿胀状态,染色质形态欠清晰,肿瘤细胞及背景细胞形态差异不明显,细胞核形态观察不清(红箭头为定位血管,黑箭头疑为肿瘤细胞) 图4 碱性水浴组:肿瘤细胞及背景反应性淋巴细胞肿胀,细胞拥挤界限不清,细胞核水肿,肿瘤性大细胞与背景反应性淋巴细胞分界不清,细胞核形态无法观察(红箭头为定位血管,黑箭头疑为肿瘤细胞)
3 讨论
良好的组织切片、免疫组化染色、可靠的流式细胞学和分子遗传学检测结果是淋巴瘤诊断、鉴别诊断和WHO分子分型的重要因素和确保正确病理诊断的基础[1]。淋巴瘤的诊断和分型前提是依据细胞的形态、大小、胞质颗粒、核质比例、核分裂、核膜、核染色质、核仁等细胞的微细结构变化,因此制备一张优质的HE染色切片非常重要。在日常的病理工作中,由于组织的前期处理不佳[3],包括组织干涸、固定不及时、固定液浓度不合适、固定不充分、组织脱水、透明、浸蜡、包埋等原因,造成淋巴瘤的细胞核及染色质固缩,严重影响病理诊断和分型。
目前有研究发现,加热诱导抗原修复技术[4]除了用于恢复遮蔽的抗原外,还可以用于解决HE染色中细胞核染色淡和灰染现象。滕孝静等[5]针对骨髓活检组织HE染色时出现细胞核灰染现象,采用高压修复和微波修复后,骨髓各系细胞染色鲜艳,细胞核和细胞质形态清晰可见,对比度好。汪晓军等[6]对固定不良、浸蜡温度过高、时间过久,引起HE染色出现细胞核灰染的病例,采用热诱导修复,修复液为柠檬酸盐缓冲液、PBS、EDTA,三种修复液修复切片均能使整个组织细胞的基本形态清晰可见,核、质染色形成鲜明的对比。以PBS为修复液,HE染色效果最佳。翁密霞等[7]对组织干涸或固定脱水不足,引HE染色发灰的石蜡蜡块,经EDTA抗原修复液高压处理的切片,整个细胞的基本形态清晰可见,核、质染色对比鲜明,清晰度好,而未经处理的对照组染色灰暗。同时本实验室在免疫组化染色的过程中发现,HE染色导致细胞核和染色质固缩病例,经过柠檬酸盐缓冲液高压修复的切片,免疫组化染色结果显示细胞核很清晰,无固缩现象。上述发现给我们提供新思路,或许也可通过类似的抗原修复方法来解决由于前期标本处理欠佳引起的HE染色切片中细胞核固缩问题。
本实验分为五组:对照组、酸性高压组、碱性高压组、酸性水浴组、碱性水浴组,经抗原修复后行HE染色。实验结果显示,酸性高压组HE优良率大大高于其它组别。作者认为,其原因一方面与抗原修复温度有关[8],柠檬酸盐缓冲液和Tris-EDTA高压修复温度为120 ℃,柠檬酸盐缓冲液和Tris-EDTA水浴法温度为100 ℃,经过加热抗原修复,破坏细胞间的粘连,增加细胞间的通透性,有利于水分渗入,恢复细胞形态。另一方面与抗原修复液的pH值和离子强度有关[8],加热处理能够切断多肽和核酸中羟甲基团的分子交联,使多肽在组织中得以延伸。在碱性或酸性且低离子强度的溶液中,大多数延伸的多肽均被赋予正电荷或负电荷,相互之间产生静电排斥力,这些静电排斥力能阻止邻近的多肽随机聚集和缠结,因此有利于固缩的细胞得以舒展。五组染色结果比较分析,提示可以采用高温高压抗原修复。实验结果显示,酸性高压组优良率高于碱性高压组。同时提示修复液pH值对修复效果可能有影响,但pH值有效范围及是否与修复液的渗透压有关,待后续实验进一步探究。
本组病例数不多,只完成淋巴瘤标本细胞核固缩问题的分析,具有一定的局限性,在以后的工作中,需收集更多病例进一步验证。
总之,采用pH 6.0柠檬酸盐缓冲液高压修复,方便快捷,能有效改善由于组织前期处理不佳,包括组织固定欠佳、组织干涸、脱水不足等,而导致的细胞核固缩问题,可以推荐用于临床病理工作中。
