重组大肠杆菌发酵表达及代谢调控研究进展
2021-03-16张言慧高先岭郭青青袁建国
张言慧,高先岭,黄 魁,郭青青,袁建国*
(1.山东国力生物科技有限公司,山东 济南 250014; 2.山东国力生物技术研究院,山东 济南 250101)
由于大肠杆菌遗传学背景较清楚,生长速度快,培养基条件要求较低,容易实现高密度培养等特点,长期以来是商业生产重要目的基因的表达系统[1-2]。为了获得高水平的基因表达产物,综合考虑控制转录、翻译、蛋白质稳定性及向胞外分泌等多方面因素,设计了许多具有不同特点的表达载体,以满足表达不同性质、不同要求的目的蛋白需要[3]。此外,宿主系统本身的特性也是重要的研究对象[4]。
大肠杆菌BL21 (DE3)及其衍生菌株是目前重组蛋白表达使用最广泛的菌株[5]。与其他革兰阴性菌一样,大肠杆菌有细胞内膜与细胞外膜之分,并将细胞分成两部分空间:细胞质与细胞周质,通常重组大肠杆菌表达的重组蛋白存在于细胞质。细胞质内可溶性重组蛋白易受大肠杆菌内源性蛋白酶降解,导致表达水平低下。形成包涵体的重组蛋白可有效避免内源性蛋白酶的降解,且分离纯化方便,分离效率高,但重组蛋白的复性较困难。当含有二硫键的重组蛋白正确折叠成空间构象的时候,需利用某些信号肽和前肽序列,将重组蛋白分泌至细胞周质或细胞外的培养液中[6]。这不但有利于重组蛋白的分离纯化,也能减少内源性蛋白酶降解,周质分泌可获得具有天然一级结构的产物。同时氧化性的周质间隙可模拟真核细胞的内质网环境,便于新生肽链折叠成天然结构,从而获得具有完全生物学活性的重组蛋白。但是,由于周质空间容量有限,及重组蛋白的不完全跨膜转运,使周质分泌表达的重组蛋白表达量低,表达量稍高时容易形成包涵体,并易发生二硫键错配,而分泌到胞外可很好地解决这些问题[7]。
1 重组大肠杆菌相关产品
由于生物药有高活性、高特异性和低毒性等特点,市场发展前景广阔。2015~2019年中国生物药市场规模从1453亿元增长至3172亿元,预计2020年我国生物药市场规模将达到3870亿元。利用重组大肠杆菌可生产多种蛋白质/多肽类生物药,这些生物药被广泛用于临床治疗多种疾病,表1列举了近年以大肠杆菌作为表达宿主生产的蛋白质药物。

表1 大肠杆菌作为表达宿主生产的生物药物[1]
借助基因编辑技术,通过基因敲除,质粒导入等手段改变大肠杆菌的代谢途径,可生产大量的生物化学产品。表2列出了由大肠杆菌生产的一些生物化学产品。
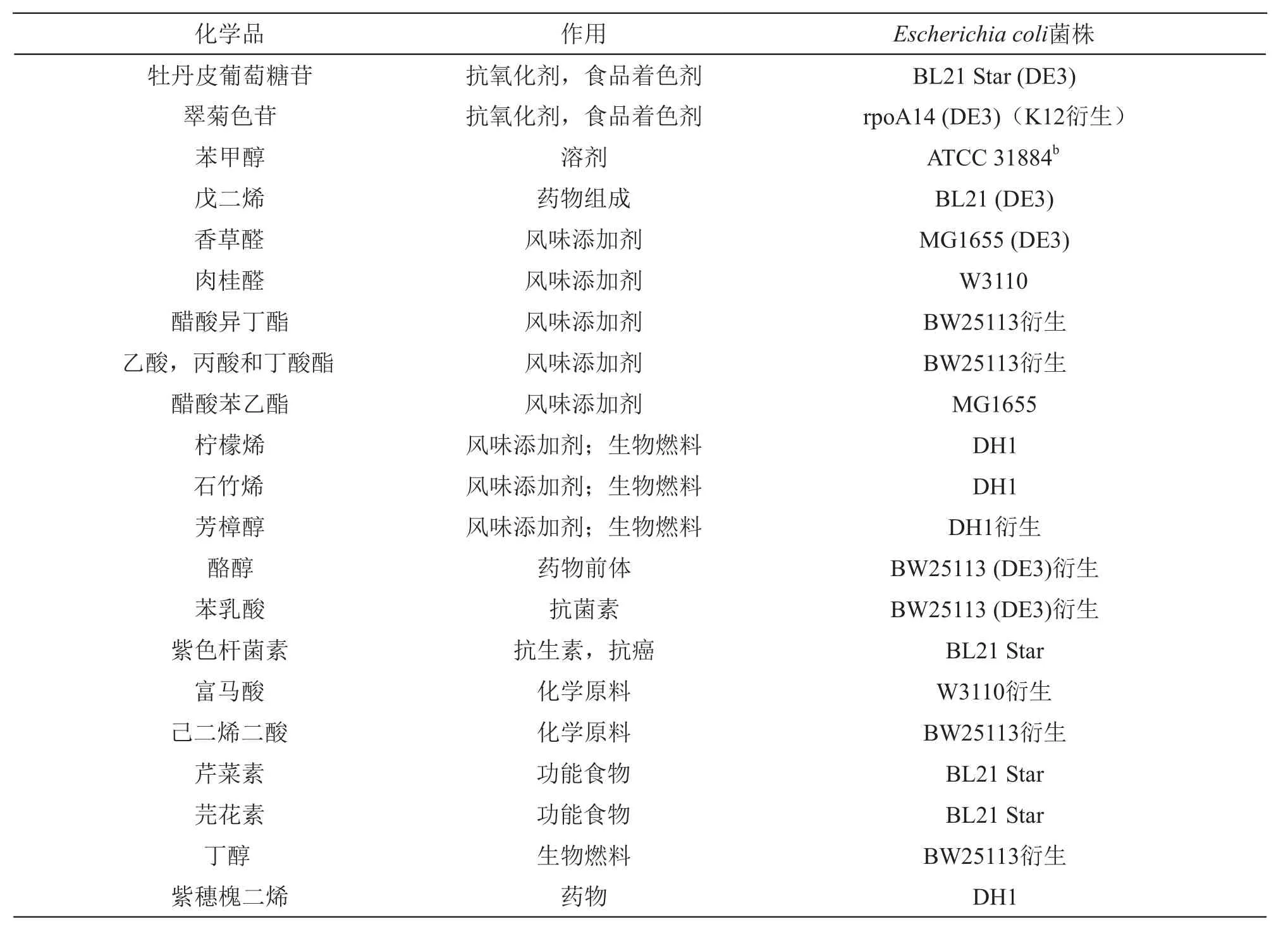
表2 大肠杆菌生产的生物化学产品[8-13]
2 重组大肠杆菌表达载体的特点
目前普遍使用的表达质粒是多个复制子、启动子、选择性标记、多克隆位点及融合蛋白移除策略组合的结果[14]。在产业化中,大肠杆菌宿主菌应用较成熟的有:BL21系列、JM109系列、W3110系列和K802系列等,常用的启动子有Ptrp、Ppho、PL、PR、Ptac、Plac等,质粒如pET、pBV220、pRK1、pRLK14等。不同宿主菌与质粒往往有一定的选择匹配性。大肠杆菌生产重组蛋白常用的启动子见表3。

表3 大肠杆菌生产蛋白药物通常所用的启动子[15-16]
目前,重组大肠杆菌的工业化发酵主要采用营养源诱导、温度诱导、IPTG(丙基硫代半乳糖苷,isopropyl β-D-thiogalactoside)和乳糖诱导3种方式,现分别概述如下。
2.1 营养源诱导
营养源诱导启动子包括phoA、ugp、mgl及araB等,此种表达方式受培养基中的营养物质无机磷浓度(Pi)、糖原或生物素调控,其调控机制类似于Plac表达系统[17]。其他尚有pH及溶氧诱导调控型,虽然其中一些表达系统的应用例子还不多,但已显示出很好的发展潜力。
2.2 温敏性启动子诱导
温敏性启动子有PL、PR或其杂合启动子PLPR等。发酵培养温度采用温度传感器检测并闭环控制。对于采用温敏型启动子的大肠杆菌重组菌,温度检测与控制十分关键。在发酵过程中温度陡然升高,使细胞内的酶活性加强,代谢加快,但当温度持续较高时,会引起细胞内一些酶活性降低或变性,细胞活力逐渐减弱,甚至死亡,即产生细胞内结构性变化。因此采用温敏型启动子菌株表达外源蛋白,诱导时间较短,适用于培养规模较小的重组蛋白发酵。
温度控制策略通常以30 ℃或37 ℃开始培养大肠杆菌到所需的细胞密度,再升温至42 ℃进行诱导培养。对于温敏型表达系统,最佳的发酵过程控制方法是在42 ℃高温诱导培养1 h后,采用温度逐渐下降的变温策略,诱导时间可明显延长,表达水平明显提高[18]。
2.3 IPTG及乳糖诱导
采用IPTG诱导发酵的重组菌,IPTG浓度应控制在亚适量水平,浓度过高导致细胞中毒,浓度过低引起启动子启动程度减弱,从而影响外源蛋白高效表达。另外IPTG存在于发酵液中时,对重组蛋白纯化亦带来一定难度。
产业化规模应用的大肠杆菌表达系统菌株绝大多数为IPTG诱导型,常用的启动子有Ptac和Plac等。当大规模生产时,IPTG的使用成本也是重组蛋白产业化主要原材料成本之一,因而发展了用乳糖替代IPTG诱导的发酵工艺。由于IPTG对细胞生长有一定的抑制作用,在使用时浓度一般只需诱导启动子(Ptac或Plac)启动则足够,启动子过度启动并不能达到高效表达外源蛋白的目的。Silaban等[19]研究认为当IPTG浓度增大时,将使细胞生长速率下降,导致细胞生长的稳定期提前到来,甚至加速细胞死亡。Luciana等[20]认为用IPTG诱导细胞表达重组蛋白将改变细胞生长过程和细胞的能量库。
由于IPTG对细胞有一定的毒害作用、大规模发酵价格昂贵和蛋白质药物纯化操作难度增加等原因,在实际大规模发酵时,一般均采用乳糖替代IPTG[21]。乳糖与其他碳源比例是关键因素,乳糖浓度过小,由于甘油等碳源对启动子产生阻遏作用或抑制作用,使启动子不能启动或启动强度不够,易造成不表达或低水平表达;而乳糖浓度过大,会使得菌体只利用乳糖,造成碳源浪费,一般乳糖浓度约为2 g/L。
3 重组大肠杆菌的代谢特性
3.1 不同大肠杆菌宿主对碳源的代谢特征
作为培养基中最广泛采用的碳源,葡萄糖和甘油在一定水平上影响大肠杆菌的生理特性[22](见图1)。葡萄糖通过磷酸葡萄糖转移酶系统(PTS)途径进入细胞内,与此同时磷酸烯醇式丙酮酸转化为丙酮酸[23]。大肠杆菌通过3个途径分解葡萄糖转变为丙糖,包括糖酵解途径、ED途径和PP途径[24]。大肠杆菌BL21和大肠杆菌JM109两种菌株利用葡萄糖做碳源时,当碳源代谢流经过丙酮酸时,若超过了三羧酸循环处理能力即产生乙酸,其聚集有培养基和菌株特异性[25]。大肠杆菌BL21作为宿主细胞表达重组蛋白有优势,JM109产生的乙酸浓度高于BL21,且当细胞密度增加时两个菌株的乙酸聚集速率均降低[26]。甘油在甘油脱氢酶(GDH)和二羟丙酮激酶(DHAK)的催化下转变为二羟丙酮磷酸进入糖酵解途径[27]。在利用甘油作为碳源转化为磷酸烯醇式丙酮酸或丙酮酸时,产生的氧化还原当量是葡萄糖的两倍。甘油转化为琥珀酸或乙醇是氧化还原平衡过程。

图1 大肠杆菌耗氧发酵条件下中心代谢途径图示[22]
3.2 乙酸与比生长速率对发酵的影响
大肠杆菌发酵过程中易产生副产物乙酸,发酵液中乙酸浓度过高将抑制细胞生长和重组蛋白生产率[28],来自于中心代谢途径的产物将与乙酸生成途径相竞争。在指数生长期乙酸激酶(ackA)是生成乙酸的主要途径,在稳定期丙酮酸氧化酶(poxB)途径占据优势[29](见图1)。由于在诱导前和诱导后不同菌体比生长速率μ值对细胞生长和蛋白表达有协同影响,可在诱导前无乙酸抑制条件下进行补料分批实验,从而避免乙酸对细胞生长和重组蛋白生产的抑制。Valiollah等[30]研究了4种不同补料分批模式中细胞生长和重组蛋白表达的变化特征,得出结论:生物质对底物的得率Yx/s受μ的影响;由于外源蛋白过量表达,生物质的生产率受诱导后μ的高度影响。
提高重组大肠杆菌的发酵水平可从两个方面入手,即提高菌体密度和单位菌体生产的外源基因产物。通过补料分批发酵可实现大肠杆菌的高密度培养。大肠杆菌高密度细胞发酵条件下的乙酸代谢,低pH培养条件下低于高pH培养条件下的乙酸浓度。在低葡萄糖浓度条件下,当葡萄糖消耗速率下降时,乙酸开始被利用,且异柠檬酸裂解酶(aceA)的活性增加[31]。另外,质粒的稳定性是影响大肠杆菌补料分批培养过程中重组蛋白生产的另一个重要的因素。研究结果表明:发酵过程中以较高的μ进行培养,可降低质粒丢失率[32],进而提高外源基因的表达水平。
3.3 丙酮酸及乙醛酸循环的代谢特征
大肠杆菌中存在磷酸烯醇式丙酮酸羧基酶(由pck基因编码)和磷酸烯醇式丙酮酸羧化酶(由ppc基因编码),二者是由多拷贝质粒上的tac启动子控制的。这两个酶同时过表达,会激发氧气和葡萄糖的消耗,并降低生长得率,导致丙酮酸和乙酸大量分泌。消除这种效应可通过敲除质粒上的pck或者ppc基因,或通过突变使这两个酶失活实现[33]。丙酮酸转化为乙酰辅酶A是通过丙酮酸甲酸裂解酶(PFL)的作用[34](见图1)。
乙醛酸循环主要的控制点是异柠檬酸脱氢酶(IDH)的激活和去激活。当大肠杆菌利用乙酸作为碳源时,约75 % IDH处于去激活状态,可导致异柠檬酸浓度增加,从而使异柠檬酸裂解酶发挥作用[35]。另外,当TCA循环通量低并有乙酸存在时,细胞内乙醛酸循环支路的异柠檬酸裂解酶也会被激活。
4 重组大肠杆菌的发酵调控
研究重组大肠杆菌培养过程中的特点,特别是重组菌和宿主菌的生长速率、底物消耗速率、产物生成速率、质粒稳定性等动力学规律,是重组大肠杆菌发酵过程优化的重要基础[36]。通过分批培养、补料分批培养和连续培养进行有关动力学研究,对制定的优化控制策略加以验证和调整改进。重组大肠杆菌的代谢活动可利用一些宏观变量观察和跟踪。虽然细胞水平代谢活动是肉眼无法直接观察的,但pH、溶氧、氧消耗速率、二氧化碳释放速率、呼吸商、菌体细胞生长、糖耗、氮耗等宏观变量的变化提供了代谢活动的线索,反映了重组菌代谢流的状况,是发酵工艺控制和干预依据,也是发酵过程放大的重要依据[37-38]。配置多种传感器、利用计算机采集数据并控制的发酵罐是进行有关研究的关键手段[39]。
重组大肠杆菌表达系统(宿主菌、外源基因、载体等)不同时,发酵培养表现的代谢过程特征也不同。有些可通过发酵过程的操作优化(补料策略、环境条件优化等)使细胞代谢正常,获得高效表达;有些可能是基因背景原因无法实现高效表达[40]。
5 结语
外源基因在重组大肠杆菌中表达水平的高低是一个综合性的问题。目的基因的选择、遗传密码的偏爱性、表达载体的选择、酶切位点的选择等这些基因层面的因素是最基础的。pH、溶氧、氧消耗速率、二氧化碳释放速率、呼吸商以及菌体细胞生长、糖耗、氮耗等宏观变量的变化及调控是大肠杆菌表达系统产业化的重要保障。而大肠杆菌代谢途径基因表达水平对于前述研究具有重要的指导意义。目前已出现多种真核表达系统,但重组大肠杆菌凭借其自身的诸多优势,仍然是基础研究和商业生产重组蛋白及生化产品的强大工具。随着分子生物学新技术的不断涌现,大肠杆菌表达系统必将在实验研究及工业生产应用中发挥更大的作用。
