ST2抗体治疗对KrasG12D非小细胞肺癌小鼠肿瘤标志物的水平和IL-33、ST2表达的影响
2021-03-15传锋彬史红阳孔振兴
传锋彬,史红阳,孔振兴
(1.渭南市中心医院呼吸与危重症医学科,陕西 渭南 714000;2.西安交通大学第二附属医院呼吸与危重症医学科;3.西安市第四医院检验科,陕西 西安 710004)
肺癌是癌症相关死亡的主要原因,患者5年平均生存率仅为约15%[1]。其中,非小细胞肺癌约占所有肺癌的80%。肿瘤标志物神经烯醇化酶(neuron-specific enolase,NSE)和癌胚抗原(carcinoembryonic antigen,CEA)可用于非小细胞肺癌的早期诊断和病理类型鉴别[2]。非小细胞肺癌常基于Kras基因的驱动突变,与吸烟相关的人非小细胞肺癌中,超过25%与活化的Kras突变有关[3]。另有研究显示,调节性T细胞(regulatory T cells,Tregss)可在人非小细胞肺癌早期和晚期中大量累积[4]。Tregss通过抑制效应T细胞,维持组织的完整性,并且短暂清除Tregss可有效降低机体的肿瘤负荷[5]。但是,完全清除Tregs也会诱发致命的自身免疫性疾病。现有Tregs靶向治疗,如CD25抗体治疗,由于特异性较低,会使活化的效应T细胞耗竭[6-7]。因此,通过局部清除Tregs或优先靶向免疫抑制Tregs亚群来促进抗肿瘤免疫的有效策略具有重要意义。本研究拟检测Kras突变非小细胞肺癌(KrasG12D)小鼠血清中NSE、CEA的水平,及其Tregs中ST2蛋白的表达;进一步探讨ST2抗体治疗对Kras突变非小细胞肺癌小鼠血清中NSE、CEA及其肿瘤负荷和抗肿瘤免疫反应的作用,以期为治疗Kras突变的非小细胞肺癌中活化的Tregs提供一定的实验依据。
1 材料方法
1.1 主要试剂
CD25(PC61)、CD4(RM4-5)、Foxp3(FJK-16s)、ST2(RMST2-2)、NK1.1(PK136)和PD1(J43)抗体购于美国BD生物科学公司。同型对照免疫球蛋白购于武汉艾美捷科技有限公司。
1.2 实验小鼠分组
40只健康雄性KrasG12D非小细胞肺癌小鼠及8只对照野生型(wild type,WT)非小细胞肺癌小鼠购于美国Jaxlab公司,在SPF清洁级环境下饲养。40只KrasG12D小鼠随机分为5组,每组8只;ST2抗体治疗实验中,随机选取2组KrasG12D小鼠在18周时分别给予腹腔注射ST2抗体(1.5 mg·kg-1·d-1)或同型对照免疫球蛋白(1.5 mg·kg-1·d-1),连续3周,WT组注射同型对照免疫球蛋白(1.5 mg·kg-1·d-1)。结束后各组小鼠处死。
1.3 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)
分别在6周、12周和18周时采用小鼠酶联免疫吸附试验试剂盒检测小鼠血清中NSE、CEA水平,操作过程严格按照说明书进行。
1.4 流式细胞术
提取小鼠肺肿瘤组织,磷酸盐缓冲溶液(phosphate buffer salin,PBS)灌洗后,用0.1 mg/mL胶原酶IV在37 ℃消化30 min,然后用70 μm尼龙网对肺组织进行机械分离,1 000 rpm离心20 min,获得单个核细胞。
对分离出的细胞进行流式细胞仪分析。采用FACSCalibur流式细胞仪(美国BD公司生产)测定Tregs细胞的表达水平,CD4-FITC+CD25-PE+Foxp3抗体标记Tregs细胞,并进一步检测Tregs细胞中CD4-FITC+CD25-PE+Foxp3+ST2、CD4-FITC+CD25-PE+Foxp3+NK1.1、CD4-FITC+CD25-PE+Foxp3+PD1的表达,调整细胞浓度,将100 μL以上荧光抗体加入对应单个核细胞内,室内避光孵育1 h,冲洗(PBS缓冲液),将破膜剂加入,再次避光孵育15 min,PBS冲洗后上机收集细胞流式细胞仪进行检测,检测过程严格按照说明书进行。
1.5 实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, RT-qPCR)
通过气管插管收集1 mL PBS液获得各组小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),1 200 rpm离心10 min后获得BALF液,并收集小鼠肺组织样本分别进行核糖核酸(ribonucleic acid,RNA)分析,用组织匀浆器在Trizol试剂中分离肺组织mRNA,BALF细胞直接置于Trizol中。采用SYBR预混料和Bio-Rad实时热循环系统进行RT-qPCR实验检测转录产物。以磷酸甘油醛脱氢酶基因为标定基因,基因的相对表达量用2-ΔΔCT表示。引物序列见表1。
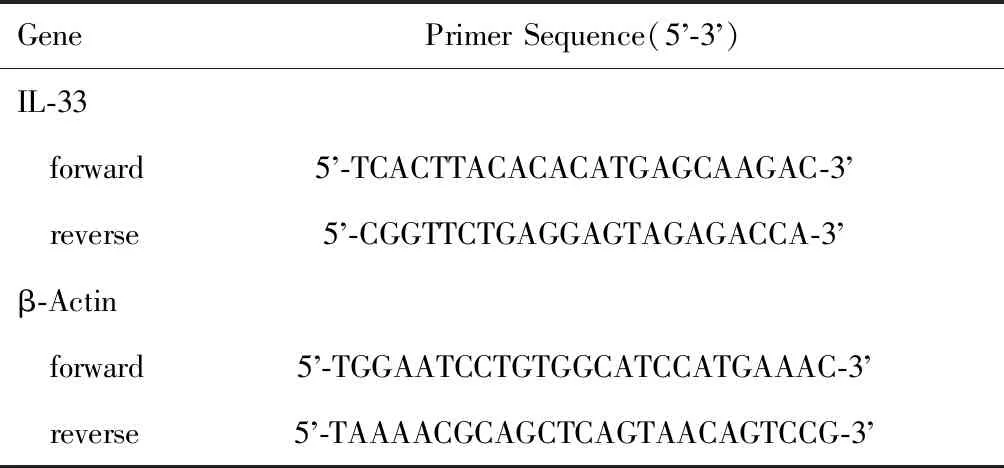
表1 RT-qPCR过程中的引物序列
1.6 统计学分析

2 结果
2.1 KrasG12D小鼠血清NSE、CEA的水平和肺肿瘤浸润中Tregs的比例
与WT组相比,KrasG12D小鼠血清中肿瘤标志物NSE和CEA的水平随着周龄的增长不断提高(P<0.05)。流式细胞术结果显示,KrasG12D小鼠肺CD4 T细胞中的Tregs比率也随着肿瘤进展的推移而不断增加(P<0.05)。见表2。

表2 KrasG12D小鼠血清NSE、CEA水平和肺肿瘤浸润中Tregs比例
2.2 Kras突变非小细胞肺癌中CD4+Foxp3+ T细胞ST2表达
KrasG12D小鼠肺肿瘤中Tregs细胞中CD25和ST2呈高表达(P<0.05),见图1A。随着周龄的增长和肿瘤的发展,KrasG12D小鼠肺组织中和BALF液中的白介素33(interleukin-33,IL-33)表达水平均显著增加(P<0.05),见图1B。

2.3 ST2抗体治疗后Kras突变非小细胞肺癌中活化Tregs的比例
与阴性对照组相比,给予抗ST2抗体治疗的KrasG12D小鼠的肺中表达ST2的Tregs显著减少(P<0.05)。见图2。

2.4 ST2抗体治疗后KrasG12D小鼠血清中NSE、CEA水平和抗肿瘤免疫反应
ST2抗体治疗后KrasG12D小鼠血清中NSE和CEA的水平显著降低(P<0.05,表3)。此外,KrasG12D小鼠肺肿瘤中NK1.1细胞比率降低,PD-1水平增加,并且经ST2抗体治疗后小鼠肺中的NK1.1细胞比率增加而PD-1水平降低(P<0.05)。

表3 ST2抗体治疗KrasG12D小鼠NSE、CEA水平和抗肿瘤免疫反应
3 讨论
致癌的Kras突变被认为是30%的非小细胞肺癌的始动因素,且在没有进行靶向治疗时与不良预后密切相关[8]。与许多恶性肿瘤一样,非小细胞肺癌是一种异质性疾病,包括多种特异组织学亚型,具有独特的分子特征[9]。由于非小细胞肺癌亚型的突变特征不同,免疫细胞组成和激活状态也不同,目前临床上尚无针对Kras突变的非小细胞肺癌靶向治疗,尽管针对非小细胞肺癌治疗的早期干预比晚期转移性肿瘤的治疗更有效。因此,探索有效的靶向治疗手段尤为困难,进而促使研究Kras突变肺肿瘤的特异免疫成分以用于临床治疗具有一定的前瞻性。
近年来,免疫治疗的进展为癌症靶向治疗提供了新思路,使用合适的临床前癌症模型开发和测试新药物至关重要。由于自发癌症的基因工程小鼠模型具有可再现人类癌症,并激活宿主免疫系统对抗内生的肿瘤等优势,本研究使用了KrasG12D肺癌小鼠模型,发现Tregs在其肺肿瘤组织中明显富集,促使小鼠的非小细胞肺癌不断进展,这可能是由于Tregs在肿瘤发展过程中与抗肿瘤的免疫反应有关Tregs[10-11]。ST2是IL-33的受体,与脂肪组织、肠和肌肉中激活的组织中的Tregs密切相关[12]。在流感感染的致病环境中,ST2表达的Tregs已被证明是维持组织完整性的关键介质[13]。人肺腺癌标本中IL-33表达水平升高,可能会诱导在肺癌中ST2表达的Tregs的水平增加[14]。在整体或Tregs特异性ST2缺失动物模型中,Tregss中ST2的表达可促进结直肠癌的免疫抑制环境[15]。本研究检测了局部消除肿瘤浸润的Tregs。结果显示,在肿瘤进展过程中,ST2表达的Tregs在肺肿瘤组织中高度富集,Tregs并且KrasG12D小鼠肺中IL-33的表达水平也显著增加。
Tregs中ST2的表达仅限于肺肿瘤组织,而在次级淋巴器官中几乎不存在,为探究局部Tregs是否可以被特异性抑制,以及KrasG12D小鼠中局部Tregs是否是肿瘤免疫监测的积极参与者,本研究还采用抗ST2抗体治疗KrasG12D小鼠3周,在肺肿瘤部位实现活化的Tregs消除,证实了Tregs中ST2对抗肿瘤免疫的阻碍作用,表明ST2抗体治疗可有效地选择性清除肿瘤浸润激活的Tregs,降低肿瘤负担,增强抗肿瘤免疫反应,并降低血清中肿瘤标志物NSE、CEA水平。因此,靶向表达Tregs中ST2可以控制KrasG12D肺癌小鼠肿瘤负担以及血清中NSE、CEA水平。
KrasG12D小鼠模型肺中ST2的表达为探讨清除肿瘤浸润的Tregs在自发性肺癌治疗中的作用提供了新的实验证据。然而,Tregs的长期缺失可诱导系统效应辅助性T细胞(helper T cell,Th细胞)反应增加,进而导致过度炎症反应和自身免疫性疾病。可是,免疫细胞的系统激活也需要持久的免疫反应。因此,应进一步研究局部Tregs的清除或Tregs的短暂抑制与全身免疫调节药物联合应用的治疗可能性。本研究显示KrasG12D小鼠ST2抗体治疗后抗肿瘤免疫反应增强,但不能排除ST2抗体治疗以KrasG12D肺癌小鼠中Tregs以外的细胞成分为靶点,从而导致肿瘤抑制和血清标志物降低的可能性,这也是本研究的局限性,后续需做进一步的探索。
综上, KrasG12D非小细胞肺癌小鼠血清NSE、CEA水平上调,肿瘤过度浸润Tregs,ST2表达增加,ST2抗体治疗可显著清除肺肿瘤中活化的Tregs,增强抗肿瘤免疫反应,降低血清中NSE、CEA水平。靶向表达ST2的Tregs可能是非小细胞肺癌潜在的新治疗靶点。
