利用CRISPR/Cas9系统构建SBNO2基因敲除细胞系及其功能研究
2021-03-15王妍鳕任亭亭孙跃峰刘磊
王妍鳕,任亭亭,孙跃峰,刘磊
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,甘肃 兰州 730046)
草莓缺口同源物2(Strawberry Notch Homolog 2,SBNO2)在Notch信号通路及NF-κB通路过程中发挥重要功能[1-2].Notch基因编码一类高度保守的细胞表面受体,调节多种生物的细胞发育过程.Notch信号影响多能干细胞的分化、细胞凋亡、细胞增殖及细胞边界的形成等过程.研究表明,IL-10以STAT3依赖的方式刺激SBNO2基因在骨髓巨噬细胞中的表达,SBNO2是IL-10下游抗炎作用通路上的重要组成部分,能够抑制炎症基因表达[3].在急性炎症反应过程中,IL-6也能够刺激乳鼠星形胶质细胞中SBNO2的表达[1].Karim等[3]发现SBNO2能够显著抑制NF-κB介导的转录并认为SBNO2可能与一系列其他蛋白相互作用,选择性地抑制巨噬细胞中的转录.然而对于SBNO2基因在病毒感染过程中的作用机制研究很少,至今尚不清楚.
CRISPR/Cas9(clustered regularly interapaced short palin-dromic repeats/CRISPR-associated proteins 9)是一种由RNA核酸酶对目的基因进行特定DNA修饰的技术[4].RNA导向的CRISPR-Cas9系统已被应用于多种细胞系和生物体的DNA和RNA编辑[5-6].能够快速且高效地进行表观遗传编辑,通过基因组位点敲除、修饰和突变,致使基因组表达受到调控,从而影响其功能[7].
口蹄疫病毒(foot-and-mouth disease virus,FMDV)基因组编码4种结构蛋白(VP1、VP2、 VP3和VP4),其中VP1作为高度可变的结构蛋白,G-H环内有最具抗原性的位点[8-9].VP1编码区的核苷酸序列因其在病毒附着、侵入、保护性免疫和血清型特异性等方面发挥重要作用,已被用于口蹄疫病毒毒株的遗传特性鉴定以及分子流行病学研究[10-11].病毒基因组RNA进入衣壳形成病毒粒子前体,再通过RNA触发VP0发生裂解反应,前病毒粒子最终被加工为成熟的病毒粒子,最终完整的病毒粒子从被感染的宿主细胞中释放出来[9].本研究利用CRISPR/Cas9技术获得SBNO2基因敲除的BHK-21细胞系,验证该基因敲除后对口蹄疫病毒复制的影响,为进一步阐明SBNO2对口蹄疫病毒调控的作用机制奠定了基础.通过深入探究FMDV感染的分子致病机制及其与宿主之间的相互作用,筛选出防控FMDV感染的新靶标,可以为新型疫苗的研发提供重要的理论依据.
1 材料与方法
1.1 主要试剂和仪器
乳仓鼠肾细胞(BHK-21)、O型口蹄疫病毒(FMDV/O/BY/2010)和pSpCas9-puro-2A质粒由家畜疫病病原生物学国家重点实验室保存;大肠杆菌DH5α感受态购自Takara公司;SBNO2抗体购自Santa Cruz公司;DMEM 培养基、胎牛血清(FBS)、胰酶、嘌呤霉素均购自Gibco公司;转染试剂Lipofectamine 2000和BCA蛋白定量分析试剂盒购自Thermo公司;限制性内切酶、T4 DNA连接酶购自NEB公司;质粒小量提取试剂盒、胶回收试剂盒、DNA提取试剂盒购自天根生化科技(北京)有限公司;山羊抗兔二抗、山羊抗鼠二抗购自Sigma公司.
PCR仪(Bio-Rad,美国);蛋白电泳装置(Bio-Rad,美国);电热恒温水浴锅(DK-8D)型(上海精宏实验设备有限公司,中国);制冰机(Scotsman,美国);立式压力蒸汽灭菌器(上海申安医疗器械厂,中国);二氧化碳培养箱(Thermo,美国);超净工作台(苏州安泰空气技术有限公司,中国);Nano Drop 2000超微量分光光度计(Thermo,美国);MX3000P 实时定量PCR仪(Agilent Technologies,美国).
1.2 试验方法
1.2.1 Western Blot方法检测BHK-21细胞感染FMDV后SBNO2基因表达水平 取3 mL 1.0×105个/mL的BHK-21细胞悬液铺在60 mm的培养皿中.待细胞生长汇合度达到80%时进行病毒感染,FMDV的TCID50为10-6.5/mL,按0.1 MOI的病毒量感染BHK-21细胞,分别于攻毒后的4、6 h收取细胞样品.加入含1%蛋白酶抑制剂的蛋白裂解液裂解细胞,制备蛋白样品.用BCA蛋白浓度测定试剂盒检测蛋白浓度,制备好的蛋白样品进行Western Blot检测.一抗4 ℃过夜孵育, HRP标记的二抗室温孵育1 h.最后用ECL化学发光法进行显影和曝光.
1.2.2 sgRNA设计及CRISPR/Cas9重组载体的构建 从NCBI中检索仓鼠SBNO2基因序列(Gene ID:216161),将序列输入CRISPR在线设计软件(http://tools.genome-engineering.org)中,设计了三组特异性sgRNA,如表1所示,送生工公司合成.

表1 靶向SBNO2基因的sgRNA序列Table 1 The sequence of sgRNA targeting SBNO2 gene
pSpCas9-puro-2A载体(Addgene公司)经BbsI酶切,放置55 ℃酶切1 h,酶切后回收线性载体.单链sgRNA序列退火后形成双链DNA,反应体系为:正向和反向sgRNA(已稀释至100 μmol/L)各1 μL,10×T4 Ligation Buffer 1 μL,T4 PNK 1 μL,ddH2O 6 μL,共10 μL.反应条件为37 ℃,30 min;95 ℃,5 min;之后以每分钟降5 ℃从95 ℃降到25 ℃.利用T4连接酶将双链DNA插入线性化的pSpCas9-puro-2A载体U6启动子的下游,16 ℃反应3 h.之后加入ATP(10 mmol/L) 1.5 μL,ATP-dependent Plasmid Safe Exonuclease 1 μL,10 × Plasmid-Safe Buffer 1.5 μL;反应时间为37 ℃,30 min;70 ℃,30 min.最后将连接好的全部产物转化至大肠杆菌感受态DH5α,培养后挑取单克隆菌落送生工测序.
1.2.3SBNO2基因敲除的细胞系制备及筛选 将BHK-21细胞铺到6孔板中,待细胞生长汇合度达到80%时,将重组质粒转染到细胞中,转染48 h后,按照3 μg/mL加入嘌呤霉素进行筛选,经过几轮筛选后,阴性细胞全部死亡,将状态良好的细胞进行传代,采用有限稀释法对细胞按比例稀释到100 mm培养皿中,将试验组细胞进行单个消化,挑取单克隆细胞并扩大培养,传代后冻存备用.
1.2.4 BHK-21-SBNO2细胞系中SBNO2基因敲除及蛋白表达检测
1.2.4.1 测序验证BHK-21-SBNO2细胞系 收取单克隆细胞株,按照基因组提取试剂盒中的操作步骤提取基因组,PCR扩增后送生工公司进行测序及序列比对,确定SBNO2基因敲除的位置.
1.2.4.2 Western Blot检测细胞系中SBNO2的蛋白表达水平 收取BHK-21-Ctrl和BHK-21-SBNO2单克隆细胞系,采用Western Blot的方法对细胞中SBNO2的蛋白水平进行检测,方法参考1.2.2.
1.2.5 敲除SBNO2基因对FMDV复制的影响 用0.1 MOI FMDV分别感染BHK-21-Ctrl和BHK-21-SBNO2单克隆细胞,感染后6 h收取细胞提取总RNA.采用qRT-PCR的方法检测细胞中结构蛋白VP1的mRNA转录水平.首先将收取的细胞用TRIzol法提取细胞总RNA,然后用Takara公司的反转录试剂盒按照说明书将提取的RNA反转录为cDNA.以β-Actin作为内参基因(β-Actin-F:GCTGGCCGGGACCTGACAGACTACC;β-Actin-R:TCTCCAGGGAGGAAGAGGATGCGGC),qRT-PCR检测VP1的相对表达水平(VP1-F:GACAACACCACCAACCCA;VP1-R:CCTTCTGAGCCAGCACTT).反应体系为:cDNA 2 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,SYBR Premix ExTaq10 μL,ddH2O 6 μL共20 μL.反应程序为:第一步:预变性95 ℃,30 s;第二步:变性95 ℃,5 s;退火/延伸60 ℃,30 s,扩增40个循环.按照2-ΔΔct法对定量结果进行统计分析.
1.3 数据分析
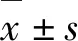
2 结果与分析
2.1 BHK-21细胞感染FMDV后SBNO2蛋白表达受到抑制
通过Western Blot方法检测FMDV感染的BHK-21细胞中SBNO2蛋白表达水平,用ImageJ软件对结果进行灰度扫描分析.如图1-A和1-B所示,与不接毒的对照组相比,FMDV感染4 h和6 h后BHK-21细胞中SBNO2蛋白表达水平显著下调,FMDV感染4 h时,与对照组相比,SBNO2表达水平下调了约1.3倍(P<0.05);FMDV感染6 h时,与对照组相比,SBNO2表达量下调了约3.5倍(P<0.05).如图1-C和1-D所示,随着FMDV感染复数的增加,细胞中SBNO2的表达量显著减少.与对照组相比,感染0.1 MOI FMDV时SBNO2表达水平下调了约3倍(P<0.05).

A图为FMDV感染不同时间点时BHK-21细胞中SBNO2蛋白水平变化情况,其中“4 h”指FMDV持续感染4 h;“6 h”指FMDV持续感染6 h;“-”为不感染FMDV的对照组细胞;“+”代表感染FMDV组细胞.B图为A图的灰度扫描结果分析;C图为不同感染复数(MOI)的FMDV感染在BHK-21细胞后,SBNO2的蛋白水平变化情况; D图为C图的灰度扫描结果分析.Figure A shows the changes of SBNO2 protein levels in BHK-21 cells at different time points of FMDV infection,in which "4 h" refers to 4 h of continuous FMDV infection;"6 h" refers to 6 h of continuous FMDV infection;"-" is the control cell that is not infected with FMDV;"+" represents infected cells in the FMDV group.Figure B analysis of gray scanning results of Figure A;Figure C shows the changes of SBNO2 protein levels after FMDV infection with different infection complex (MOI) in BHK-21 cells.Figure D shows the gray scanning results of Figure C.图1 FMDV感染后BHK-21细胞中SBNO2蛋白表达水平和灰度值分析Figure 1 Analysis of SBNO2 protein expression level in BHK-21 cells after FMDV infection
2.2 BHK-21-SBNO2细胞系中SBNO2基因及其蛋白敲除结果
2.2.1 Western Blot验证敲除细胞系中SBNO2的蛋白表达下调 收取7组不同的单克隆细胞系,通过Western Blot的方法对细胞中SBNO2的蛋白表达水平进行检测.如图2所示,与对照组相比,有两组克隆细胞株中SBNO2蛋白表达显著下调,其中SBNO2-B5中SBNO2蛋白表达量下调约4倍(P<0.05);SBNO2-D2中SBNO2蛋白表达量下调约3.3倍(P<0.05).表明SBNO2-B5和SBNO2-D2两组细胞系中SBNO2基因敲除效果明显.

A图和C图分别为BHK-21细胞在敲除SBNO2后,SBNO2的蛋白表达水平变化;B图为A图的灰度扫描结果分析;D图为C图的灰度扫描结果分析.Figure A and Figure C show the changes of SBNO2 protein expression level in BHK-21 cells after SBNO2 knockout.Figure B shows the gray scanning results of Figure A;Figure D shows the gray scanning results of Figure C.图2 敲除SBNO2蛋白的Western Blot鉴定结果和灰度值分析Figute 2 Identification of SBNO2 knockout efficiency by Western Blot
2.2.2 SBNO2-B5和SBNO2-D2两组细胞系测序结果 如图3所示,与对照组相比,SBNO2-B5和SBNO2-D2两组细胞中SBNO2基因发生移码突变,表明成功构建敲除SBNO2基因细胞系.
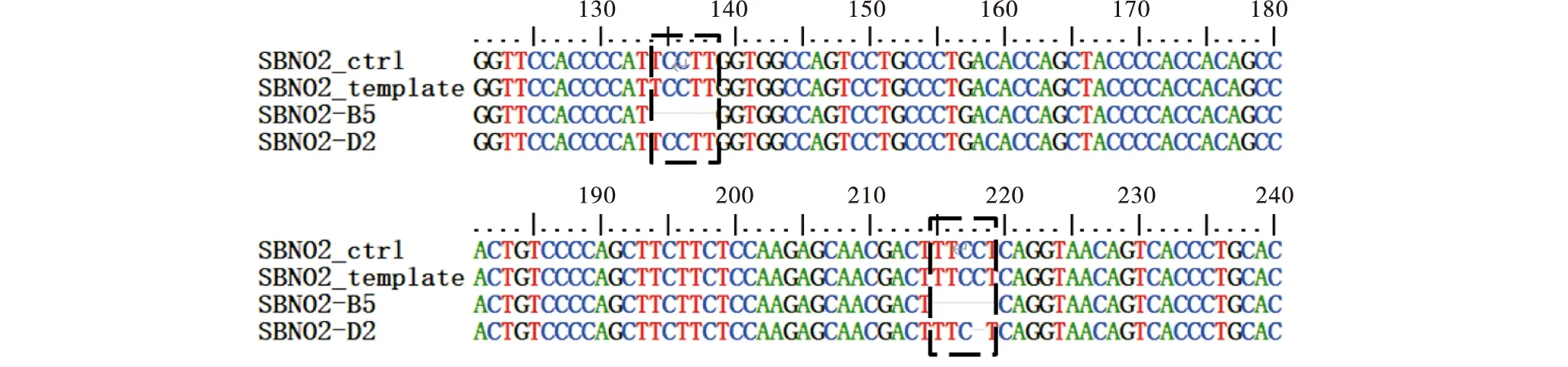
图3 SBNO2-B5和SBNO2-D2两株敲除细胞系中SBNO2基因测序鉴定Figure 3 Sequence identification of SBNO2 gene in SBNO2-B5 and SBNO2-D2 cell lines
2.3 敲除SBNO2基因对FMDV复制影响的检测结果
选用SBNO2-B5和SBNO2-D2两组SBNO2基因敲低的细胞系感染FMDV,通过qRT-PCR方法检测FMDV结构蛋白VP1的mRNA表达水平变化.如图4所示,与对照组相比,SBNO2-B5和SBNO2-D2两组细胞在感染FMDV 6 h后,VP1的mRNA表达水平显著上调,其中SBNO2-B5组上调了约3.2倍(P<0.05),SBNO2-D2组上调了约3.4倍(P<0.05).以上结果表明,与对照相比,SBNO2基因敲除的细胞系中,病毒复制加快.
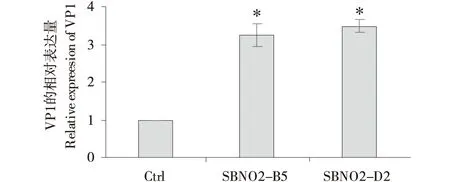
图4 敲除SBNO2基因对FMDV复制影响的检测结果Figure 4 The impact of SBNO2 gene knockout on the replication of FMDV
3 讨论
CRISPR/Cas9系统介导的基因编辑技术能够快速且高效地编辑各种生物体的基因组,已被广泛用于特定基因组位点的功能域,以探索其发育机制和基因表达调控[12-13].本试验利用CRISPR/Cas9技术针对SBNO2基因设计了3组不同sgRNA的序列,构建SBNO2基因敲除质粒,并且成功获得BHK-21-SBNO2敲除细胞系.敲除的细胞系中SBNO2基因表达被显著抑制,在FMDV感染后,与对照细胞系相比,FMDV结构蛋白VP1表达水平显著上调,表明BHK-21细胞中SBNO2基因敲除能够促进FMDV复制,具体机制还有待进一步研究.
SBNO2是抑制炎症基因表达的IL-10调节通路的组成部分,主要受IL-10信号通路的调控,并参与NF-κB的抑制.通过对IL-10诱导的巨噬细胞中特异性基因表达的验证,发现SBNO2在转录调控方面具有关键作用.研究发现,GP130细胞因子家族成员和促炎细胞因子IL-1β和TNFα也能显著上调SBNO2mRNA的表达,证明SBNO2在星形胶质细胞以及CNS中的其他细胞中起急性炎症反应基因的作用[1].在小鼠和人的星形胶质细胞中,IL-6以剂量和时间依赖性的方式显著上调SBNO2基因表达[1].随着病毒感染时间和病毒总量的增加,一些抗病毒基因会出现表达量降低的现象[15].本研究中FMDV感染BHK-21细胞后SBNO2表达水平随着时间、剂量的增加显著降低,说明FMDV能够影响SBNO2基因的表达,提示SBNO2基因可能在FMDV复制过程中发挥重要作用.Kasmi等[3]发现在293T细胞中,SBNO2能够显著地影响NF-κB的转录.NF-κB是细胞内重要的核转录因子,在病毒感染后的天然免疫应答中起重要作用[16].NF-κB和IRF3作为IFN的转录调控因子,可以通过两种不同的途径影响IFN的表达[17],从而影响宿主的天然免疫反应及抗病毒基因的表达.SBNO2可能作为天然免疫中的模式识别受体,介导NF-κB信号通路从而激活天然免疫应答机制,对病毒感染后的免疫调控具有重要意义.面对敲除细胞系在FMDV感染后,病毒复制明显增多.我们推测在本研究中SBNO2对FMDV增殖的影响也可能是通过调控宿主中IFN的表达来实现的,但仍需要进行后续研究对这一假设进行验证.天然免疫是宿主抗病毒感染的第一道防线[18],而在天然免疫过程中干扰素(IFN)的产生对于机体抗病毒感染具有重要作用.由于口蹄疫灭活疫苗需要大约7 d的时间诱导机体产生免疫保护,那么在此期间通过抗病毒干预的方法,增强机体抗病毒免疫应答,能够为机体提供早期保护、减少病毒复制从而控制口蹄疫的传播[19-20].我们推测SBNO2能够作为一种抗炎、抗病毒因子对天然免疫应答起到正反馈作用,能为疫苗接种或其他基于免疫的干预措施提供新的策略.
4 结论
本研究利用CRISPR/Cas9系统,成功构建了CRISPR/Cas9-SBNO2重组质粒,采用嘌呤霉素筛选分离出BHK-21-SBNO2稳定敲除细胞株,经过测序及Western Blot验证,获得了敲除SBNO2基因的BHK-21细胞系.FMDV感染BHK-21-SBNO2细胞系后,FMDV复制显著增多,表明敲除SBNO2可促进FMDV复制,为后续研究SBON2对口蹄疫病毒复制的分子机制奠定了基础.
