藻类捕光天线系统:结构与功能的统一
2021-03-15甄张赫李文军林瀚智秦松
甄张赫,李文军,林瀚智,秦松*
(1.中国科学院烟台海岸带研究所,山东 烟台 264003;2.中国科学院大学 资源与环境学院,北京 100049;3.中国科学院海洋大科学研究中心,山东 青岛 266071;4.广东省科学院 广东省生态环境技术研究所 华南土壤污染控制与修复国家地方联合工程研究中心/广东省农业环境综合治理重点实验室,广东 广州 510650)
1 引言
藻类是光合自养的水生孢子植物,是地球上最原始的进行放氧光合作用的植物,可分为原核藻类及真核藻类。原核藻类的成员主要为蓝藻,它通过内共生进化出各种真核藻类。最初,蓝藻的初级内共生演化出3 个分支:灰胞藻、红藻及绿藻[1]。随后,红藻及绿藻通过一系列次内共生产生了其他的真核藻类[2]。按照传统方法,真核藻类通常被分为10 个门:绿藻门、轮藻门、裸藻门、红藻门、隐藻门、甲藻门、金藻门、黄藻门、硅藻门及褐藻门[3]。
藻类可在各类地球环境中(湖泊、海洋、温泉、高山、极地等)生存,特别是水下弱光环境造就了藻类独特而高效的捕光能力[4]。为了适应各种光环境,藻类进化出了各种捕光天线(色素−蛋白复合体),包括定位于类囊体膜外的水溶性复合体,以及在类囊体膜内的疏水性复合体。这些复合体可通过调整其结合色素的数量、种类及位点,吸收环境中特定波段的光[5]。例如水溶性捕光天线复合体藻胆体(Phycobilisome,PBS),可通过共价结合的各类藻胆素,如藻蓝胆素(Phycocyanobilin,PCB)、藻红胆素(Phycoerythrobilin,PEB)、藻尿胆素(Phycourobilin,PUB)和藻紫胆素(Phycoviolobilin,PVB)等吸收460~670 nm 的可见光[6];膜蛋白捕光天线复合体(Light-harvesting Complex,LHC)可通过非共价结合的各类色素如叶绿素(Chlorophyll,Chl),及各种类胡萝卜素(Carotenoids)如岩藻黄素(Fucoxanthin,Fx)、甲藻黄素(Diadinoxanthin,Dd)和硅藻黄素(Diatoxanthin,Dt)等吸收350~750 nm的光[7-8],这些吸收的光能被捕光天线复合体以大于90%的效率传递至光合反应中心。在此过程中,类胡萝卜素可以通过淬灭激发态叶绿素的方式进行光保护。这些捕光和传能的过程之所以如此的高效,与藻类捕光天线独特的蛋白结构密不可分[9-13]。
藻类拥有的独特的捕光天线结构是其行使捕光和传能过程的基础(表1)[14-16],研究藻类捕光天线的精细结构具有非常重要的意义。其精细结构的揭示,可以帮助人们了解天线的捕光和传能机制,并为光电仿生器件提供重要的结构和功能基础[17],这对开发太阳能电池甚至人工光合作用的合成都至关重要。
但需要注意的是,藻类捕光天线结构生物学的发展非常依赖于相关的检测及解析技术。这些技术被用来分析藻类捕光天线的成分和结构,是影响结构分辨率的重要因素,因此相关的研究方法学和技术手段的进步至关重要。本文将以研究方法学和技术手段的进步为线索,回顾过去70 年藻类捕光天线结构生物学的研究历程,阐明结构生物学揭示的藻类捕光复合体结构与功能的统一性及其科学意义,并展望有关领域未来发展趋势。
2 藻类捕光天线结构解析
2.1 生化提取和成分分析阶段
生化提取是解析藻类捕光天线结构的第一步,也是后续成分分析的重要基础。自20 世纪50 年代起,人们开始通过简单易行的生理生化技术,广泛研究藻类捕光天线的组成及结构[18-20]。例如,Gantt 和Lipschultz[21]开发了从单细胞红藻紫球藻中分离完整PBS 的方法,大大推动了当时甚至后续的PBS 结构的研究进展。后续提取完整PBS 的方法均由此衍生而来,至今仍延用了其中的经典条件及步骤,例如细胞破碎缓冲液磷酸根浓度为0.6~1.0 mol/L、pH 约为7,提取温度在18°C 左右,纯化方法选择蔗糖梯度离心法等[22-25]。
随后Gingrich 等[26-28]通过改进该方法,分离纯化了蓝藻的PBS,例如聚球藻SynechococcusPCC 6301、SynechococcusPCC 7002 等,并通过蛋白电泳、吸收光谱及荧光发射光谱,对PBS 的蛋白成分及色素成分进行了鉴定(表1)。基于这些研究成果,Glazer[29]构建了聚球藻Synechococcus6 701 藻胆体结构的初始模型。在完整的藻胆体结构被结构生物学研究技术解析之前,该初始模型的建立对于分析藻胆体能量传递途径具有重要的指导意义。
2.2 利用X-ray 解析晶体局部精细结构
X-ray 晶体学是解析藻类捕光天线复合体精细结构的第一选择[30](表1)。蛋白本身的特性往往决定了其结晶的难易程度,因此水溶性捕光天线和膜蛋白捕光天线的晶体结构解析进展并不对等。大量易结晶的水溶性捕光天线蛋白以及组成PBS 的各类藻胆蛋白率先获得了原子分辨率的结构,例如多甲藻素叶绿素蛋白(Peridinin-chlorophyll-protein,PCP)(2 Å)[31]、藻红蛋白(phycoerythrin,PE)(1.85 Å)[32]、藻蓝蛋白(phycocyanin,PC)(1.35 Å)[33]和隐藻PE545(0.97 Å、1.63 Å)[34-35]等(表2)。
由于膜蛋白纯化及结晶均较为困难,因此获得LHC 家族成员的晶体结构往往需要漫长的摸索过程。幸运的是,目前已经获得了多种LHCII、FCP(Fx and Chla/cbinding protein)的高分辨晶体结构(表2),这些结构清晰地展示了色基类型及结合位点[36-38]。大量晶体结构的成功解析,为后续冷冻电镜三维重构计算奠定了重要的结构基础。
然而,由于LHC 家族成员的结构多样性,膜蛋白又较难结晶,因此大多数藻类的膜蛋白捕光天线的精细结构尚未通过X-ray 晶体学方法获得(表2)。此外,超分子捕光复合体的结构也很难通过X-ray 晶体学方法获得。一方面是由于超分子复合体的体积太大,增加了结晶难度,例如PSI(photosystem I)-LHCI,PSII-LHCII 等大体积复合物至今未见晶体结构,而其包含的体积小的PSI、PSII 以及部分LHC却早已通过结晶法获得精细结构[37,39-40];另一方面是受限于复合体的体外理化性质,例如PBS 不仅体积大,而且在体外易解聚,很难通过结晶获得完整的精细结构。由于X-ray 晶体学技术几乎没有机会完成部分藻类捕光天线的结构解析,因此开发更多的结构解析技术变得非常必要。
2.3 利用电镜技术解析捕光天线复合体结构(以冷冻电镜为技术分水岭)

表2 藻类捕光天线复合体晶体结构解析进展Table 2 Progress in crystal structure analysis of algal light-harvesting antenna complexes

表3 电镜技术解析藻类捕光复合体结构的研究进展Table 3 Advance in electron microscope analysis of algal light-harvesting complexes
电镜技术一直是生物分子结构生物学结构解析,特别是超大分子解析的重要手段,只不过早期的解析清晰度远远不如X-ray 晶体解析技术,制约了技术的应用范围。早在20 世纪80 年代起,人们便开始利用各种电镜技术对捕光天线的结构进行观察(表1,表3),例如通过透射电子显微镜(Transmission Electron Microscope,TEM)[21,68]、扫描隧道显微镜(Scanning Tunneling Microscope,STM)[69]以及原子力显微镜(Atomic Force Microscope,AFM)[70]观察到了各种不同类型的二维或三维PBS 结构。部分膜蛋白捕光天线的结构也可通过电镜观察到,如体积较小的XLH(来源于黄藻)[71]以及大体积的LHC 和光系统I 的超分子复合物(如隐藻的PSI-LHCI[72]、绿藻的PSI-LHCI-LHCII[44]等),结合已公布的晶体结构,可对这些负染图像进行三维重构计算,获得粗略结构模型。然而,由于这几种电镜技术本身的限制及获得的图像分辨率的限制,这些粗略结构相比于精细结构仅能提供复合体组成成分,丢失了大量的亚基及色基结构细节,例如PBS与PSII-LHCII(图1A,图1C)的粗略结构,无法提供确切的亚基类型及空间位置,也无法观察到结合的色基,而精细结构(图1B,图1D)却可以提供这些细节。因此,直到冷冻电镜技术发展成熟之前,人们都很难通过电镜获得捕光天线复合体完整的精细结构。

图1 捕光复合体粗略结构及精细结构对比Fig.1 Comparison of contour and fine structures of algal light-harvesting complexes
冷冻电镜技术的应用不仅使结构生物学跨入了新时代,也使藻类捕光天线的结构解析得以关键性突破,这得益于冷冻电镜技术相比较X-ray 结晶法对样品质量的依赖度更低[73]。仅2019 年,便有7 个超分子复合体的精细结构通过冷冻电镜技术获得[42,45,74-78],包括提高了分辨率的PBS 结构(红藻Porphyridium purpureum,2.82 Å)[42]、绿藻的PSI-LHCI 以及多种类型的PSII-LHCII 等。这些结构清晰的揭示了复合体组件之间的连接与排布方式。目前,冷冻电镜技术在藻类捕光天线复合体结构解析领域的应用还有很大的发展空间。例如,利用冷冻电镜技术解析的藻类捕光天线复合体结构分辨率均未突破2.5 Å(表3)。因此,未来还需要对样品纯化以及冷冻电镜解析技术继续优化提升,以提高结构分辨率。
3 藻类捕光天线蛋白结构与功能的统一
结构生物学的进步,为深刻理解藻类捕光天线复合体的功能提供了大量结构细节,例如精细结构展示的大量的精准的发色团位置,提示了捕光天线系统内部高效的能量传递发生的可能机制。目前,将结构生物学与捕光天线功能整合为一体的研究方法学如下(图2)。
(1)通过比对分析捕光蛋白的同源基因,结合其三维结构,揭示捕光蛋白结构与功能的进化关系。例如,在2006 年,Zhao 和Qin[90]对藻胆蛋白同源基因进行了进化分析,发现某些藻胆蛋白中的部分氨基酸位点表现出较高的非同义替换率(图2A),这些位点大多分布在发色团结合结构域和螺旋发夹结构域(X 和Y)内或其附近(图2B),并显示出共同进化的特征。将这些位点精确地定位在藻胆蛋白的三级结构上,发现脱辅基蛋白的发色团结合结构域为发色团创造了特定的微环境,以确保高效的能量转移效率[90]。这个研究从计算生物学的角度,证实了发色团与藻胆蛋白之间存在特定的空间环境以有效的进行共振能量转移。
(2)根据藻类捕光天线蛋白精细结构提供的发色团网络,预测能量传递的大概路径,并为利用超快时间分辨光谱研究能量传递提供结构基础。例如,通过硅藻(Phaeodactylum tricornutum)FCP 的结构解析发现,FCP 主要以二聚体的形式存在,且该结构揭示的FCP 不仅结合了含氧光合作用生物中常见的Chla,而且结合了Chlc和Fx,使它们能够捕捉蓝绿光以适应水中的光环境(图3)[36]。随后通过PSII-FCPII 的结构解析,进一步揭示了硅藻(Chaetoceros gracilis)FCPII与PSII 的连接方式及可能的能量传递模式。但是由于超分子复合体的结构过于复杂,具体的能量传递路径目前还不清晰[89]。由于复合体体积太大,色素分子较多而导致目前无法仅通过高分辨的复合体结构就准确预测能量传递路径的例子还有很多,例如,2020年解析的来自紫球藻(P.purpureum)的PBS 的结构,包含了1 598 个色素分子,且2.82 Å的分辨率足以使人们看清每个色基的结合位点[42]。然而,由于色素数量庞大,能量传递路径复杂,其中可能涉及到多个激子能量传递,甚至相干共振能量转移。因此,准确的能量传递途径还需要配合各种精确的光谱技术手段进行分析。
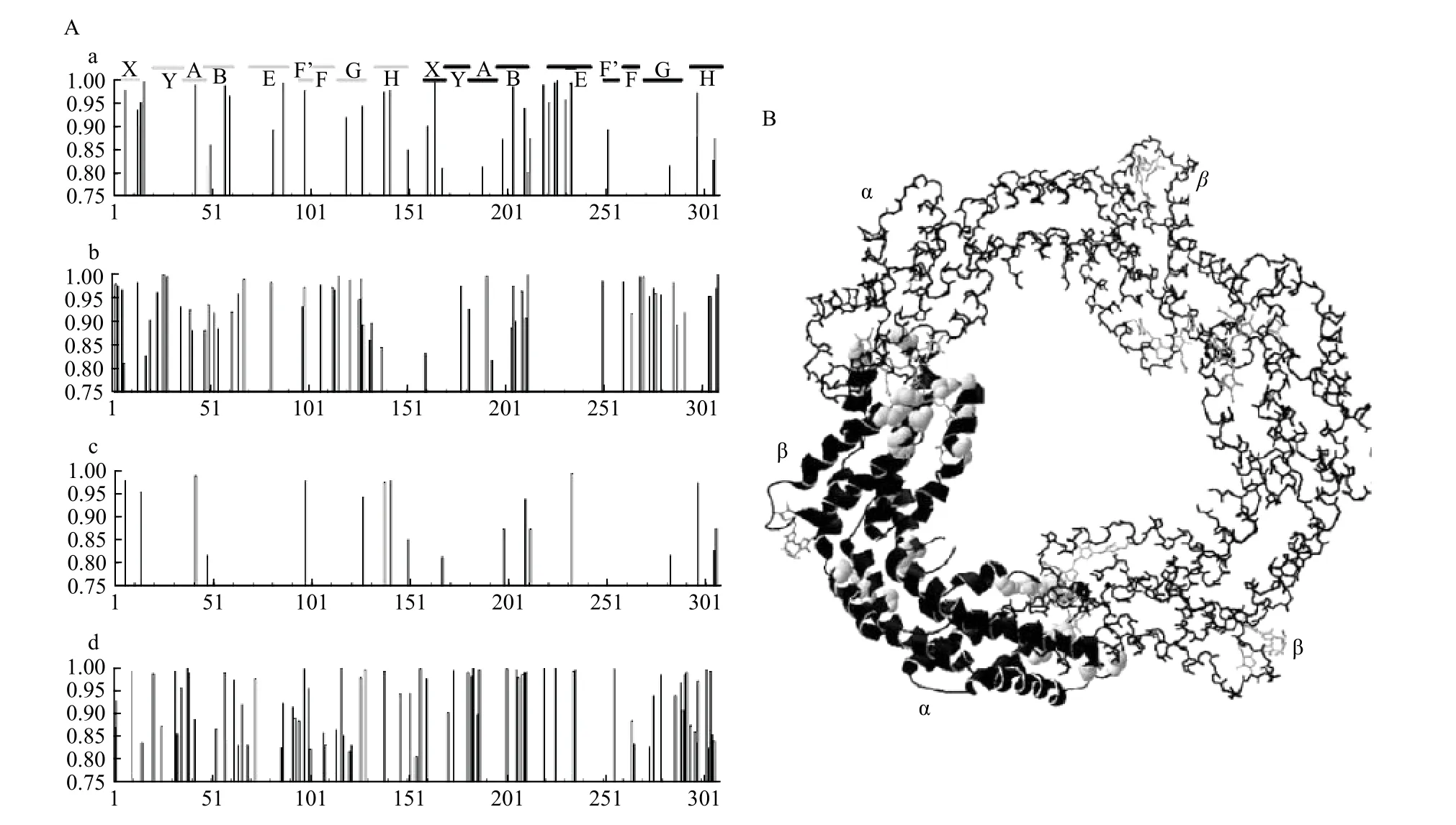
图2 计算生物学分析蓝藻藻胆蛋白同源序列及结构[90]Fig.2 Computational biology analysis of cyanobacterial phycobiliprotein homologous sequence and structure [90]
(3)光谱学是分析捕光蛋白能量传递的最佳手段,常用的有吸收光谱、荧光发射光谱、圆二色谱[91]以及超快光谱[92]。目前,超快时间分辨光谱被认为是分析捕光蛋白能量传递机制的最佳光谱学手段,超快时间分辨光谱可对飞秒(fs)内的能量传递过程进行监测[93-94]。例如,二维超快时间分辨光谱显示,隐藻捕光蛋白PC645的两组色素分子之间存在振动相干节拍以及部分离域振动,这使得能量转移速率增强[95-96]。
除了高效能量传递,藻类捕光天线系统的精细结构,为理解其光适应机制提供了更多的科学依据,例如,藻类捕光天线可通过结构的变化响应来启动各种光保护机制(如非光化学淬灭(NPQ)、状态转换等[97-98]),以保护光合反应中心免受光损伤。例如,发色团网络揭示的各类LHC 的类胡萝卜素位置,可辅助理解LHC 的NPQ 机制。近来,有研究利用时间分辨红外光谱对LHCII 的能量淬灭动力学及构象变化进行了分析[99],该研究揭示了高等植物LHCII 三聚体对多余激发能的耗散可响应温度和酸度的变化,这可通过类胡萝卜素与叶绿素612 之间的动态构象变化来调控。需要说明的是,由于植物LHCII 的结构与绿藻LHCII 的结构一样,因此,对高等植物LHCII 的研究结果均可用来分析绿藻LHCII。此外,对高等植物PSI-LHCI-LHCII 的精细结构解析,也可帮助人们深入理解绿藻捕光天线的状态转换机制。通过对比绿藻中发现的各种类型的PSII(photosystem II)-LHCII(C2S2-typePSII-LHCII、C2S2M2-typePSII-LHCII及C2S2M2N2-typePSII-LHCII 等)复合体结构差异,有助于深入理解LHCII 对不同光条件下的响应机制[45,74,77,86]。
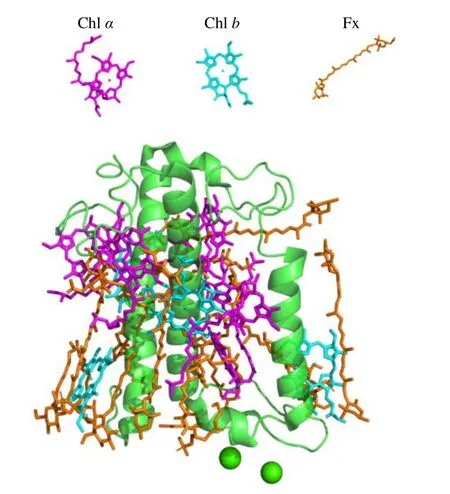
图3 FCP 单体结构及其色素组成[36]Fig.3 Monomer structure and pigment composition of FCP [36]
藻类捕光天线的结构尽管可根据生活的光环境进行变化,但是决定其结构类型的根本因素在于进化所决定的基因。因此,尽管有一些藻类生活在相似的环境中,但是其捕光天线结构却有差别,例如都生活在海表面的单细胞蓝藻和红藻,其具备的捕光天线结构并不相同。红藻的藻胆体较蓝藻藻胆体体积更大,且红藻还具有膜蛋白LHC[23,42,74]。因此,藻类捕光天线的结构与功能的统一是建立在进化的基础上的,解析不同藻类的捕光天线结构有助于理解藻类进化。
4 展望
冷冻电镜技术与超快时间分辨光谱技术的结合,初步实现了对藻类捕光天线系统结构与能量传递功能的统一认识,为深刻理解水生植物藻类为何具有高效的弱光捕获能力,极高的传能效率以及灵活的光适应能力等,奠定了坚实的结构基础。然而,清晰绘制一幅特殊水环境如何塑造了特殊的捕光结构,又如何获得高效而精准的捕光功能的系统画卷,仍旧任重道远。
捕光天线结构中复杂的发色团网络结合各类光谱技术可揭示其高效的传能过程,其中可用于解释两个相干量子系统引起的周期性振动过程的CRET 机制引起了广泛的关注和争议。CRET 过程可使能量在几百飞秒内分布在整个系统(大于分子的直径)内[100],因此部分观点认为相干共振能量转移是藻类捕光天线高效捕光的真正原因。然而,也有部分观点认为该过程的相互作用时间太短暂,在光合作用能量转移中没有任何功能意义[101]。而且,通用的物理计算模型无法可靠的解释捕光天线内复杂的能量传递过程,例如关于隐藻PC645 中量子节拍的解释仍然备受争议,因为原子振动也可呈现出相似的观测结果,而这种观测结果很难区分是由哪种机制导致的[96]。因此,需要开发更合理的计算模型(如非微扰计算模型)[102],才能清楚地阐释相干能量传递机制是否是藻类捕光天线高效捕光的“杀手锏”。另外,需要注意的是,现今发现的捕光天线内的量子节拍大多数测量于77 K,而考虑到藻类生存的温度及温度升高对量子退相干过程的加剧作用,在常温下测量量子相干的意义重大。
关于PBS 光保护机制的研究还需要依赖相关复合物的结构解析。一方面,PBS 可通过橙色类胡萝卜素蛋白(water-soluble orange carotenoid protein,OCP)依赖型NPQ 过程将多余的激发能进行热耗散(图4a)。但关于OCP 的结合位点仍存在争议,虽然普遍认为活性OCP 可以结合PBS 的核心结构[103],但至今没有相关的结构被解析,无法直观的验证该观点。另一方面,PBS 可通过状态转换机制进行光保护,其机制不同于膜蛋白LHC(图4)。为了避免PSII 能量过强导致光损伤,通常PBS 可通过移动传能机制(图4b,状态一)和溢出机制(图4b,状态二)两种途径实现多余能量在光系统之间的重新分配[104]。遗憾的是,至今,两种机制的结构仅局限于结构模型,直观的结构解析将寄希望于未来原位结构生物学技术的进步及动态结构研究方法的开发。
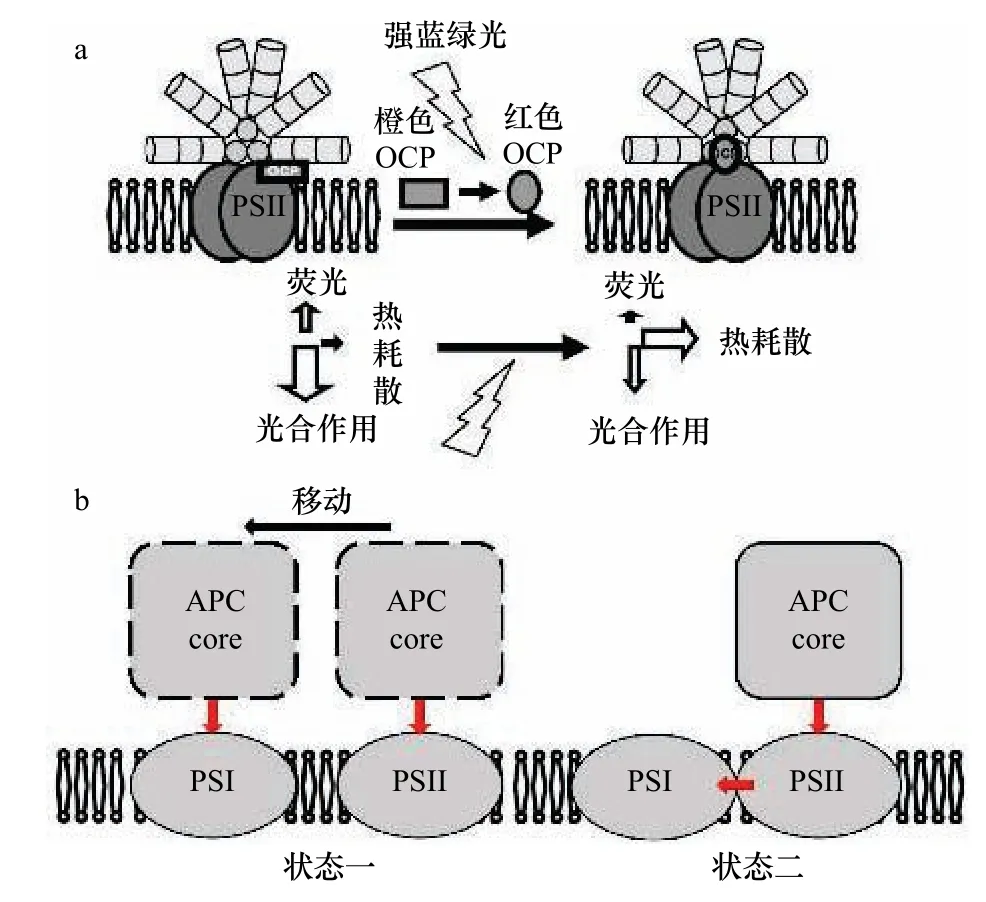
图4 藻胆体光保护结构模型Fig.4 Photoprotective structural model of phycobilisomes
目前,仍有许多藻类捕光天线的精细结构未被解析,其中不乏有一些藻类拥有特殊结构的捕光天线。例如,极端环境中的藻类为了在多变的光环境或不寻常的温度条件下,依然能维持捕光天线的结构稳定性和捕光效率,进化出了独特的捕光天线结构。已发现嗜热蓝藻的捕光天线核结构中,含有结构特殊的PC(PC612),可使藻胆体在高温条件结构依然稳定[105];南极红藻可通过转换不同的藻胆体类型来适应长期的光照环境和长期的黑暗环境[106]。但这些没有细节的粗略结构只是提供了理解适应机制的可能方向,并不能辅助人们理解其特殊的捕光及传能机制。例如,嗜热蓝藻中特殊结构的PC 在藻胆体传能过程中的具体作用还不清楚;驱动南极红藻两种藻胆体转换的具体机制以及两种藻胆体与光系统的联系仍未见报道。这些科学问题都需要通过解析精细结构,甚至是动态光环境下的精细结构来解释。
现阶段,藻类捕光天线系统结构生物学的研究已为深入揭示藻类光合作用高效能量传递机制奠定了坚实的结构基础,验证了结构生物学揭示的藻类捕光复合体结构与其功能的统一性。此外,通过特殊的捕光天线结构及其动态结构变化,进一步研究捕光天线对光环境的适应性,成为了未来的研究重点,这将为藻类捕光天线蛋白在光电器件领域的应用提供科学依据。
