电刺激通过升高细胞内游离钙激活成纤维细胞的盆腔电刺激机制研究
2021-03-15吴芳芳郁震戎
吴芳芳,郁震戎,陈 慧
胶原蛋白是盆腔组织中的主要支撑结构成分,胶原蛋白的减少和损伤等会影响盆腔组织的功能,导致盆腔组织结构的张力降低和支撑结构的松弛,最终导致盆腔相关疾病的发生[1-3]。成纤维细胞是最常见的结缔组织细胞,会分泌包括胶原蛋白和其他大分子在内的细胞外基质的成分,这些成分维持软性结缔组织的结构框架[4-5]。Ca2+在电场诱导的成纤维细胞中,主要是由Ca2+穿过细胞膜中嵌入的离子通道流入细胞内钙存储和细胞内钙存储不参与电场诱导的Ca2+变压门控钙通道和拉伸激活阳离子通道被提议通过外源电场激活,并允许Ca2+从细胞外流入空间[6-8]。本研究即探究电刺激通过升高细胞内游离钙激活成纤维细胞的盆腔电刺激机制。
1 材料与方法
1.1 实验动物 SPF 级Wistar大鼠(雌性,8周,100~120 g)购自南京君科生物有限公司,根据动物保护和使用委员会的标准在无病原体条件下饲养。所有的实验动物程序都符合动物护理和使用委员会的审查和批准。
1.2 建立慢性盆腔炎大鼠模型和分组 选取 SPF 级8周龄的Wistar大鼠150只,体质量100~120 g,随机分为3组,各50只。正常对照组:正常喂养的大鼠。压力性尿失禁模型的建立:在氯胺酮和赛拉嗪麻醉下,使用改良的10-Fr弗雷导管在球囊中注入3 ml生理盐水后插入大鼠阴道,使阴道扩张4 h。电刺激组:对模型建立成功的大鼠,并在保持麻醉的同时,通过弯曲端双极平行铂电极(PB AD08100)隔离并悬挂靠近损伤部位的阴部神经;电刺激(20 Hz,0.3 mA,0.1 ms脉冲)1 h。模型对照组:对模型建立成功的大鼠,不进行电刺激处理,进行正常喂养。
1.3 观测指标
1.3.1 盆底两侧耻骨肌组织伊红-苏木素染色 将解剖得到的大鼠盆底两侧耻骨肌固定后进行脱水,滤纸吸干残余液体,投入包埋剂中浸泡,-20 ℃恒温环境下进行冰冻切片,后经伊红-苏木素染色,梯度酒精脱水、二甲苯透明、中性树胶封片,在光学显微镜下对大鼠盆底两侧耻骨肌切片进行观察,并对每张切片进行拍照,倍数拍照尽可能容纳损伤纤维肌表达。
1.3.2 利用免疫印迹法检测各组大鼠成纤维细胞内和细胞凋亡相关的蛋白 免疫印迹法检测成纤维细胞内相关凋亡因子的变化,取适量大鼠盆底两侧耻骨肌组织样品,组织块剪碎后加400 μl单去污剂裂解液裂进行匀浆,重复几次使组织尽量破碎。裂解30 min后,在4 ℃下12 000 rpm离心5 min,取上清进行BCA检测蛋白浓度;取总蛋白样品进行SDS-PAGE电泳,至溴酚兰刚跑出终止电泳,进行转膜转印至PVDF膜,加入一抗(1∶200)进行稀释,摇床摇晃2 h;用TBST在室温下脱色摇床上洗2次,每次10 min;再用TBS洗1次,10 min,二抗孵育2 h,用0.01 M PBS洗膜3次,ECL底物发光,以目的条带表示蛋白的相对表达量。同时根据MTT法检测成纤维细胞活性,激光共聚显微镜观察细胞内Ca2+的浓度变化。
1.3.3 血管紧张素Ⅱ和钙-钙调素依赖性蛋白激酶(CaMK)Ⅱ检测 收集各组的组织样本,组织匀浆、提取蛋白,BCA 法测定蛋白浓度。采用商品化的检测试剂盒,按照说明书进行实验,最后用酶标仪于450 nm 处检测各孔的光密度(OD)值。在Laemmli样品缓冲液中裂解蛋白质,进行SDS-聚丙烯酰胺凝胶电泳,并转移到Immobilon-P Transfer Membrane过滤器(密理博公司,美国)上。利用标准品绘制标准曲线,计算回归方程,由标准曲线得到待测样本各指标的含量。
1.4 统计学处理 应用SPSS 20.0软件对数据进行统计分析;计量资料以±s表示,组间比较采用单因素方差分析或者重复测量的方差分析,组间两两比较采用LSD-t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 盆底两侧耻骨肌组织伊红-苏木素染色 正常对照组大鼠的纤维肌组织排列紧密形状完好,条理整齐清晰;电刺激组大鼠的纤维肌组织条理较紊乱,组织排列较紧密,形状较完好;模型对照组的染色结果可以清楚看出纤维肌组织排列紊乱,条理杂乱无序,组织密度降低,损伤严重(图1)。
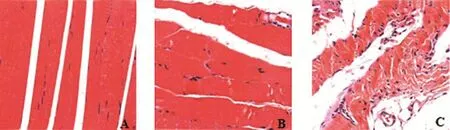
图1 盆底两侧耻骨肌组织伊红-苏木素染色(×600)
2.2 大鼠成纤维细胞内和细胞凋亡相关的蛋白分析 与正常对照组比较,模型对照组Bax和cleaved-caspase-3表达量均升高,差异有统计学意义(P<0.05)。与模型对照组比较,电刺激组促细胞凋亡的蛋白Bax和cleaved-caspase-3表达量下降(表1)。
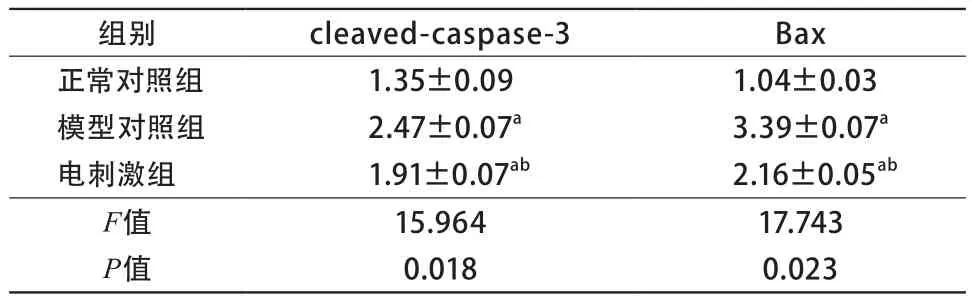
表1 cleaved-caspase-3以及Bax的蛋白相对表达量(n=50)
2.3 成纤维细胞内钙离子的浓度与细胞增殖活性的测定 与正常对照组比较,模型对照组钙离子浓度和成纤维活性细胞均下降;与模型对照组比较,电刺激组钙离子浓度和成纤维细胞活性升高;在钙离子浓度升高时成纤维细胞的活性升高(表2)。
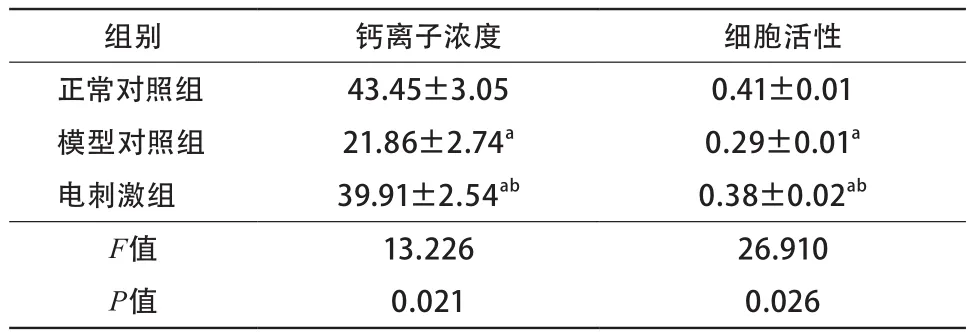
表2 钙离子浓度以及成纤维细胞活性测定结果(n=50)
2.4 CaMK Ⅱ检测 模型对照组CaMK Ⅱ浓度低于正常对照组,电刺激组CaMK Ⅱ浓度低于正常对照组但高于模型对照组(P<0.05)(表3)。
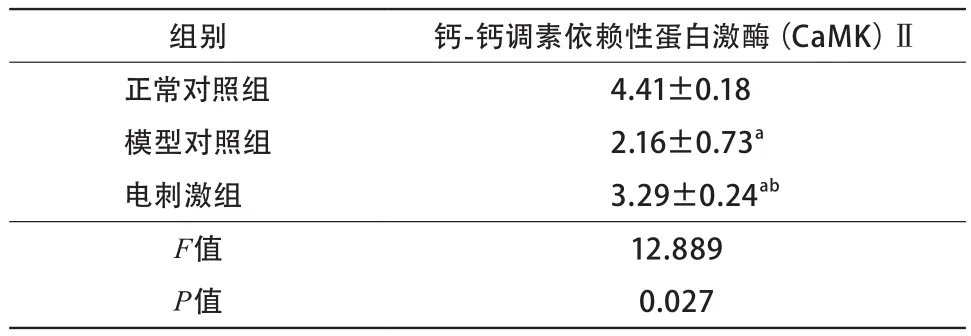
表3 CaMK Ⅱ检测结果(n=50)
2.5 血管紧张素Ⅱ蛋白相对表达检测 模型对照组大鼠体内的血管紧张素Ⅱ发生了下降,电刺激组与模型对照组相比其体内的血管紧张素Ⅱ发生了升高(表4)。

表4 血管紧张素Ⅱ蛋白相对表达检测结果(n=50)
3 讨论
电刺激可唤醒神经传导功能,电刺激治疗能够增强受试动物对盆腔肌肉的控制能力,该过程可能通过钙离子通道调控。本研究发现,与正常对照组比较,模型对照组钙离子浓度下降,电刺激组钙离子浓度高于模型对照组;与正常对照组比较,模型对照组的成纤维细胞活性下降,与模型对照组比较,电刺激组的成纤维细胞活性则升高。笔者分析认为,细胞内钙离子浓度可以调节许多重要的生物过程包括信号转导、细胞骨架重组、细胞分化和增殖、细胞粘附和细胞迁移等。细胞内Ca2+在众多细胞的调控介导中起关键作用,Ca2+调节这些细胞和相关分子效应的机制被广泛研究[9],目前有3种已知的Ca2+途径被认为参与细胞的调节:Ca2+可以通过激活电压门控的Ca2+通道而在质膜中增加;通过拉伸激活来增加Ca2+质膜中的阳离子通道;Ca2+可通过激活内部Ca2+存储[10-11]。Lookin等[12]研究表明电刺激升高细胞内钙离子浓度,并有益于周围和中枢神经系统的恢复。李素廷等[13]研究表明成纤维细胞的调节与细胞内钙离子的浓度相关。廖八根等[14]研究表明血管紧张素和碱性成纤维细胞生长因子会促进成纤维细胞的增殖。
本研究发现,CaMK Ⅱ浓度低于正常对照组,电刺激组CaMK Ⅱ浓度低于正常对照组但高于模型对照组。模型对照组大鼠体内的血管紧张素Ⅱ下降,电刺激组与模型对照组相比其体内的血管紧张素Ⅱ升高。本研究与Li等[15]研究结果一致,即血管紧张素在与受体结合后蛋白激酶C被激活,从而导致细胞膜上的钙离子通道发生共价修饰,引起细胞膜上通道蛋白发生结构的变化,导致钙离子可以由细胞膜外进入细胞内。钙离子浓度的升高能够使细胞内腺苷酸环化酶的活性升高,腺苷酸环化酶活性的升高会导致更多物质磷酸化的发生,导致CaMK Ⅱ的活性升高,CaMK Ⅱ是成纤维细胞增殖的重要标志物;细胞内钙离子浓度的升高会促进p35的表达,p35的表达会抑制促细胞凋亡因子的生成,导致细胞凋亡率降低[16]。
综上所述,细胞内游离钙升高可以促进成纤维细胞内促凋亡因子的减少同时促进CaMK Ⅱ和血管紧张素Ⅱ的表达来激活成纤维细胞活性。
