杀螟丹和Cr6+复合污染对赤子爱胜蚓的毒性研究
2021-03-15朱艳高晨昕孟雨婷肖娴刘建国赵远
朱艳,高晨昕,孟雨婷,肖娴,刘建国,赵远
(常州大学环境与安全工程学院,江苏 常州213164)
我国是农业大国,多数重金属和农药作用于土壤造成的环境污染日益加重,间接影响了农产品质量,最终危害到人体健康[1−2]。杀螟丹是使用最广泛的天然杀虫剂衍生物之一[3],有研究表明,杀螟丹的使用会导致严重的人体器官衰竭[4−5]。有些人认为杀螟丹是安全无害的,因此对其生态毒性的研究较少,但杀螟丹属于杀蚕素类农药[6],该毒素能与生物体内乙酰胆碱受体结合,阻断神经质的传递,导致神经中枢紊乱,昆虫接触药剂后会失去侵害作物的状态,虫体软化、瘫痪,直至死亡[7]。Cr作为地下水和土壤中第二常见的金属污染物,其会对土壤中酶活性及微生物活性产生影响,积累在植物中的Cr也会通过食物链进入人体或动物体造成严重伤害[8]。Cr6+是土壤污染因子中重点关注的重金属污染物之一,是公认的能威胁人体健康的毒性较大的致癌离子,可引起皮炎、视力减退和皮肤溃烂等相关病症[9]。目前关于单一污染物污染效应的研究较多,但在实际情况下大多是由多种复合污染物共同作用导致的环境污染。关于农田土壤中Cr6+与杀螟丹共存对生物的复合影响仍鲜有报道。
尽管复合污染已成为当前环境污染研究的热点问题,但依然是基于土壤中单一污染物的生态效应,实际环境中存在的大部分是多种污染物共同作用的复合污染,而有关复合污染体系的生态风险评估方法依然缺乏。目前,国内外针对复合污染联合作用的研究工作也取得了相应的进展。在研究恩诺沙星和铜复合污染后对蚯蚓的影响中发现,复合污染对蚯蚓消化酶的影响表现出抑制作用[10]。蒋曼等[11]研究表明毒死蜱和甲萘威分别对斑马鱼表现出高毒和低毒,二者协同作用于斑马鱼。在对甲酚和2,4−二叔丁基酚作用于斑马鱼的单一毒性研究中,二者分别表现为中毒和高毒,且在24、48、96 h时为协同作用[12]。复合污染物之间的联合毒性效应对于生态环境存在很大的潜在威胁。目前,复合污染的联合毒性研究成果主要集中于对生物体的急性致死层面,而在亚致死剂量下对于生物体机体损伤层面的研究甚少。
蚯蚓作为土壤系统中关键组成部分,其在土壤中长期生存,能够起到增强土壤微生物活性、影响土壤有机物转化和养分元素释放的作用[13],通常作为对土壤中物质进行毒性检测的生物之一[14−15]。目前多数生态风险评估方法集中于受试生物的个体水平,低层次的生理生化水平的效应评估相对较少。针对重金属和农药对土壤生态环境的联合毒性危害,本文选取无脊椎动物赤子爱胜蚓作为土壤生物的代表研究对象,以杀螟丹和Cr6+单一及二元复合下的混合物为样本,通过测试蚯蚓死亡率和生理生化指标的变化来表征其毒性大小,以考察重金属与农药的联合毒性效应,为深入研究重金属与农药复合污染的作用机理提供基础性的研究方法和理论依据。
1 材料与方法
1.1 受试生物
赤子爱胜蚓(Eisenia foetida)购自江苏某蚯蚓养殖场,经实验室预先培养一段时间后,选择体型相似、体质量为0.3 g左右、性成熟的成年蚯蚓进行试验。
1.2 污染物添加方法
通过预试验,依据全部致死最低浓度和全部存活的最高浓度,不断缩小浓度设定区间,最后确定正式试验浓度区间范围[16]。
空白对照(CK):准确吸取4 mL去离子水均匀淋洒于垫有双圈定性滤纸的玻璃培养皿中,空白组不进行任何染毒处理。
杀螟丹添加方法:使用杀螟丹标准品(纯度为97.8%,购于上海市农药研究所)以去离子水配制成0.5、1.0、1.5、2.0、2.5 mg·L−15个浓度。将双层双圈定性滤纸平铺在玻璃培养皿中,吸取4 mL试验用浓度的溶液均匀淋洒于双层双圈滤纸上,以单位面积滤纸上的量代表试验中蚯蚓吸收到的杀螟丹浓度,分别为0.031 5、0.063、0.094、0.126、0.157μg·cm−2。
Cr6+添加方法:使用烘干的重铬酸钾标准品(分析纯,购于国药集团有限公司)以去离子水配制成1.0、2.0、3.0、4.0、5.0 mg·L−15个浓度。在玻璃培养皿中铺双圈定性滤纸,并吸取稀释好的试验用浓度的溶液4 mL均匀地淋洒在双层双圈滤纸上,以单位面积滤纸上的量代表试验中蚯蚓吸收到的Cr6+浓度,分别为0.063、0.126、0.189、0.252、0.315μg·cm−2。
复合药剂添加方法:杀螟丹和Cr6+的复合试验中,先准确吸取2 mL试验浓度(0.1、0.2、0.3、0.4、0.5 mg·L−1)的杀螟丹溶液均匀淋洒于玻璃培养皿的双层双圈滤纸上,再加入2 mL浓度为2 mg·L−1的重铬酸钾溶液。
1.3 蚯蚓急性毒性试验
在预先培养的蚯蚓中挑取性成熟的成年蚯蚓,并将蚯蚓表面水分用纸擦干,放入底部铺有湿润滤纸的烧杯中,迅速用保鲜膜封口并扎出大小均匀的小孔。随后置于湿度为80%的恒温培养箱(20±1℃)中,于暗处清肠24 h,之后清洗干净并擦去体表水分。
将双圈定性滤纸铺于玻璃培养皿中,精确移取4mL试验浓度的溶液均匀淋洒于滤纸上,取处理好的蚯蚓在不同浓度处理中各放入一条,每浓度处理组设置10个重复,同时进行空白对照处理。玻璃培养皿用保鲜膜封口并用针扎出大小均匀的小孔,保存于培养箱中,调节温度为(20±1)℃、湿度为80%左右,于暗处培养72 h,分别在24、48 h和72 h观察记录蚯蚓的中毒症状和死亡数。
联合毒性试验以杀螟丹、Cr6+对蚯蚓的48 h的LC50值作为一个毒性单位,以等对数间距按照等毒性比为1∶1的混合比例,设置试验浓度完成联合毒性试验,方法同上。
1.4 蚯蚓生理生化指标试验
分别采集不同时间经上述3种方式不同浓度处理后的蚯蚓样本,加入蚯蚓9倍质量的生理盐水(0.86%),在冰浴条件下进行5 min匀浆,随后用冷冻离心机将匀浆好的蚯蚓组织液离心(2 500 r·min−1,10 min,20℃)。保留上清液,稀释成所需质量分数的组织匀浆后,立即测定。
蚯蚓体内蛋白含量使用考马斯亮蓝蛋白测试盒进行测定(购于南京建成生物科技研究所),参照试剂盒说明方法进行操作。试验分为空白管、标准管和测定管,空白管中加入双蒸水,标准管中加入0.563 g·L−1的蛋白标准品,测定管中加入处理过的蚯蚓组织匀浆。测定时将样品加入考马斯亮蓝显色液,混匀后静置10 min,用酶标仪(E7031,美国普洛麦格公司)在波长595 nm处测定各管的吸光度值。根据测得的吸光度,利用公式计算蚯蚓样本2%浓度组织匀浆液的蛋白含量[17],如公式(1)所示:
待测样本蛋白含量(g·L−1)=
超氧化物歧化酶(SOD)活力使用黄嘌呤氧化酶法进行测定,以试剂盒(购于南京建成生物科技研究所)说明方法进行操作。设置测定管和对照管,在测定管中加样品,对照管中加同等体积的双蒸水,室温静置10 min后,用酶标仪(E7031,美国普洛麦格公司)在波长550 nm处[18],测定各管的吸光度值。代入公式(2)计算SOD活力:
总SOD活力(U·mg−1prot)=
过氧化氢酶(CAT)采用可见光法进行测定,试验设置对照管和测定管,以试剂盒(购于南京建成生物科技研究所)说明方法进行操作。用酶标仪(E7031,美国普洛麦格公司)在波长405 nm处,测定各管的吸光度值[19]。计算方法见公式(3):
CAT活力(U·mg−1prot)=
丙二醛(MDA)含量采用TBA法进行测定,试验设置空白管、标准管、测定管和对照管,参照试剂盒(购于南京建成生物科技研究所)说明方法进行操作,用酶标仪(E7031,美国普洛麦格公司)在波长405 nm处测定各管的吸光度值[20]。计算方法见公式(4):
MDA含量(nmol·mg−1prot)=
1.5 联合毒性效应的评价
采用Marking相加指数法[21]评价杀螟丹和Cr6+对蚯蚓的联合作用类型(表1)。

表1 联合毒性评价方法Table 1 Joint toxicity evaluation method
1.6 数据处理
通过Origin 8.5对混合体系中各物质浓度与蚯蚓死亡率进行非线性拟合,并采用非线性回归方程计算得出蚯蚓的24、48 h和72 h的LC50值。
2 结果与分析
2.1 杀螟丹和Cr6+对蚯蚓的急性毒性效应
2.1.1 杀螟丹和Cr6+对蚯蚓的单一毒性
蚯蚓经杀螟丹暴露后,中毒症状主要表现为躯体颜色加深并且躯体极度延展、失去弹性,部分蚯蚓爬行缓慢、反应迟缓、对刺激不敏感。暴露于Cr6+中的蚯蚓在接触滤纸后出现持续的扭曲挣扎、躯体充血红肿,蚯蚓体表渗出黄色液体,之后躯体蜷曲,失去爬行能力,随着染毒时间延长,蚯蚓身体背部出现小泡,生殖环肿胀,甚至有糜烂现象。
杀螟丹和Cr6+对蚯蚓的单一毒性试验结果如表2所示,结果表明两种药物对蚯蚓毒性大小有差异,但均随暴露时间的延长而增强。染毒时间为24 h时,杀螟丹的单一毒性大于Cr6+,其中杀螟丹24 h−LC50值为14.30 mg·L−1,Cr6+24 h−LC50值为104.42 mg·L−1。染毒时间为48 h时,杀螟丹和Cr6+的48 h−LC50分别为12.36 mg·L−1和71.53 mg·L−1,毒性分别增强1.16倍和1.46倍,杀螟丹毒性仍较强,是Cr6+的5.79倍。染毒时间为72 h时,杀螟丹和Cr6+的毒性继续增强,其中杀螟丹72 h−LC50值为10.43 mg·L−1,杀螟丹和Cr6+的毒性分别较染毒48 h时增强1.19倍和1.79倍。
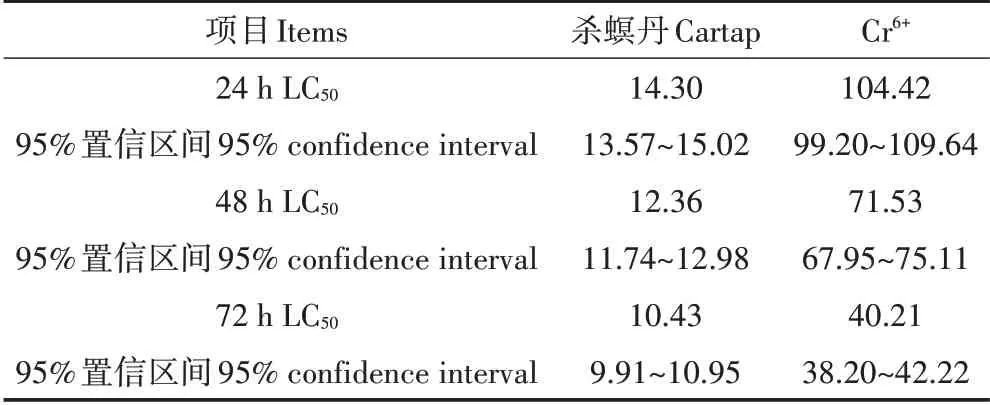
表2 杀螟丹和Cr6+对蚯蚓的单一毒性(mg·L−1)Table 2 Single toxicity of cartap and Cr6+on earthworm(mg·L−1)
2.1.2 杀螟丹和Cr6+对蚯蚓的二元联合毒性
杀螟丹和Cr6+对蚯蚓的二元联合毒性试验结果如表3所示,杀螟丹与Cr6+以等毒性比1∶1配比,暴露24 h时,两者的LC50值分别是单一暴露时的1.03、1.29倍,相加指数为−0.75,两者联合显示拮抗作用。暴露48、72 h时,相加指数分别为−0.76和−0.38,联合作用均表现为拮抗作用,并且拮抗作用在整个暴露过程中呈现先加强后减弱的趋势。

表3 杀螟丹和Cr6+二元混合体系对蚯蚓联合毒性评价结果Table 3 Evaluation of joint toxicity of binary mixtures of cartap−Cr6+to earthworm
2.2 杀螟丹、Cr6+及二元联合对蚯蚓体内蛋白含量的影响
杀螟丹、Cr6+单一染毒及二元联合染毒对蚯蚓体内蛋白含量影响如图1所示。蚯蚓体内蛋白含量在不同染毒时间(24、48、72 h)内随杀螟丹浓度增加的变化趋势均为先升高后降低,随着染毒时间的延长,蛋白含量先升高后不变(图1a),不同暴露时间内,各处理组均与CK处理存在显著差异(P<0.05)。可以得出低浓度、长时间染毒和高浓度、短时间染毒情况下蚯蚓体内蛋白含量受到的影响相似。蚯蚓经不同浓度Cr6+染毒后,CK组蚯蚓体内蛋白含量随时间的延长缓慢下降,且大多低于Cr6+染毒的蚯蚓体内蛋白含量(图1b)。暴露24 h时的蛋白含量低于48 h和72 h;暴露48 h时,蚯蚓体内蛋白含量随Cr6+浓度增加呈先降低后上升再降低趋势,在Cr6+浓度为4.0 mg·L−1时达到最大值1.52 g·L−1,是CK组蚯蚓蛋白含量的1.30倍;在暴露72 h时,蛋白含量变化趋势为先降低后升高至平稳,并且在Cr6+浓度为3.0 mg·L−1时低于CK;不同暴露时间蛋白含量最大值处理组均与CK存在显著差异(P<0.05)。蚯蚓经杀螟丹和Cr6+二元联合染毒后,CK组蚯蚓体内蛋白含量随着时间的延长呈上升趋势(图1c)。染毒24 h时,蛋白含量随染毒浓度增加呈现先升高后降低趋势,在0.2 mg·L−1杀螟丹+2 mg·L−1Cr6+时蛋白含量出现最大值,48、72 h时蚯蚓体内的蛋白含量基本表现为先降低后升高,最小值分别出现在杀螟丹浓度为0.3 mg·L−1和0.2 mg·L−1时。
2.3 杀螟丹、Cr6+及二元联合对蚯蚓体内SOD活力的影响
杀螟丹、Cr6+单一染毒及二元联合染毒对蚯蚓体内SOD活力的影响变化如图2所示。在染毒24 h时,SOD活力随杀螟丹浓度增加表现为先降低后升高,48 h时则表现为先升高后降低,染毒72 h时SOD活力持续降低,且各处理均与CK存在显著差异(图2a)(P<0.05)。可能是随着染毒时间的延长,蚯蚓体内环境遭到破坏,损伤程度增强,导致在72 h时SOD活力不断降低。蚯蚓经Cr6+染毒后SOD活力在24 h时最高(图2b),1.0、2.0、3.0、4.0、5.0 mg·L−1处理分别是CK组的145%、156%、174%、148%和133%,随着Cr6+处理浓度的增加,蚯蚓体内SOD活力呈现先升高后降低的趋势,最大值出现在Cr6+浓度为3.0 mg·L−1时,较CK增加了74.12%,可能由于高浓度污染使蚯蚓机体严重受损。不同暴露时间下,各处理均与CK存在显著差异(P<0.05),72 h时除CK外各处理并无显著差异。蚯蚓经杀螟丹和Cr6+二元联合染毒后,24 h时SOD活力随处理浓度的增加持续升高,各处理组分别较CK升高了10.79%、15.10%、22.07%、28.07%和41.89%(图2c),并在0.5 mg·L−1杀螟丹+2 mg·L−1Cr6+浓度时达到此试验浓度范围内的最大值。染毒48 h时,SOD活力随着处理浓度的增加呈现先升高后降低的趋势,在0.3 mg·L−1杀螟丹+2 mg·L−1Cr6+浓度时SOD活力达到最大值,是CK组的1.63倍。染毒72 h时,蚯蚓体内SOD总活力大幅度降低,并在浓度为0.2 mg·L−1杀螟丹+2 mg·L−1Cr6+时出现最大值。
2.4 杀螟丹、Cr6+及二元联合对蚯蚓体内CAT活力的影响
杀螟丹、Cr6+单一染毒及二元联合染毒对蚯蚓体内CAT活力的影响变化如图3所示。蚯蚓经杀螟丹单一染毒后,不同浓度处理导致其体内CAT活力变化趋势不同,CK体内CAT活力较稳定,随时间延长无明显波动(图3a)。染毒24 h时,CAT活力被诱导而迅速上升,此时蚯蚓体内氧自由基增加,减少了细胞膜的氧化损伤,属于机体对胁迫环境的适应反应。48 h时CAT活力被抑制,降至与CK相近,72 h时CAT活力相对48 h略升高。各时间峰值浓度均与CK存在显著差异(P<0.05)。蚯蚓经Cr6+染毒后在Cr6+浓度为2 mg·L−1时达到最大值,在暴露时间(24、48、72 h)内随Cr6+浓度增加CAT活力整体呈现倒“U”形变化。不同暴露时间内,各处理均与CK存在显著差异(P<0.05)。蚯蚓经杀螟丹和Cr6+二元联合染毒后,随着暴露时间的延长,CK蚯蚓体内CAT活力较稳定(图3c);各处理组CAT活力变化有明显差异。蚯蚓体内CAT活力在染毒24 h时表现为先降低后升高再降低,在0.1 mg·L−1杀螟丹+2 mg·L−1Cr6+浓度时达到最大值;染毒48 h时,各处理的CAT活力均高于CK,随浓度增加呈先升高后降低的趋势,在0.2 mg·L−1杀螟丹+2 mg·L−1Cr6+浓度时达到最大值,并较24 h升高了45.89%;染毒72 h时,蚯蚓体内CAT活力变化趋势与48 h相似,最大值在0.3 mg·L−1杀螟丹+2 mg·L−1Cr6+浓度时出现。
2.5 杀螟丹、Cr6+及二元联合对蚯蚓体内MDA含量的影响
杀螟丹、Cr6+单一染毒及二元联合染毒对蚯蚓体内MDA含量的影响变化如图4所示。蚯蚓经不同浓度杀螟丹单一染毒后,在染毒时间24、48、72 h时,其体内MDA含量整体降低(图4a)。染毒24 h和48 h时,随染毒浓度增加MDA含量表现为先升高后降低,染毒72 h时,MDA含量与CK差异不显著。除72 h外,其余暴露时间的峰值浓度均与CK存在显著差异(P<0.05)。蚯蚓经不同浓度Cr6+染毒后,染毒24 h时其体内MDA含量随Cr6+浓度增加呈先升高后降低的趋势(图4b);染毒48 h时MDA含量有所升高;染毒72 h时,MDA含量在Cr6+浓度为2.0 mg·L−1时达到最大值,高于CK组77.12%。蚯蚓经杀螟丹和Cr6+二元联合染毒后,在长时间暴露情况下,CK蚯蚓体内MDA含量整体趋势平稳(图4c)。在暴露时间内(24、48、72 h)MDA含量变化差异明显,染毒24 h时,处理组MDA含量均显著高于CK(P<0.05),在0.1 mg·L−1杀螟丹+2 mg·L−1Cr6+浓度时达到最大值,后逐渐降低。染毒48 h时,各处理MDA含量呈现先升高后降低的趋势,在0.3 mg·L−1杀螟丹+2 mg·L−1Cr6+浓度时达到最大值。
3 讨论
杀螟丹单一染毒时,蚯蚓体内蛋白变化具有规律性,杀螟丹浓度的增加使蛋白含量在染毒时间(24、48、72 h)内先升高后降低,长时间染毒后蛋白含量总体升高后趋于平稳。染毒的蚯蚓体内蛋白含量均比CK蛋白含量高,可能是由于污染物的刺激,导致蚯蚓内环境紊乱、功能受损,机体产生应激蛋白,如C−反应蛋白(CRF)、纤维连接蛋白(Fn)等会引起蚯蚓体内蛋白总量的升高[22−23]。蚯蚓体内SOD活力在低浓度短时间内被诱导,但在72 h时持续下降,原因可能是在遭受胁迫后机体激发了体内SOD酶以维持自身氧化平衡,但随着时间的延长和污染物浓度的增高,机体损伤严重,SOD活力逐渐降低[24]。本研究中蚯蚓体内CAT活力在杀螟丹染毒初期显著高于CK组,随着杀螟丹浓度的升高和时间的延长,CAT活力受到抑制,甚至失活[25]。蚯蚓体内MDA含量的变化具有规律性,随着杀螟丹浓度的增加MDA含量先升高后降低,随着染毒时间的延长MDA含量降低,原因可能是在杀螟丹染毒初期,蚯蚓体内足够的氧自由基导致膜的过氧化,致使MDA含量上升,但随着时间的延长,过剩的活性氧在抗氧化酶活性最高时得到清除,使蚯蚓体内活性氧的生成和去除达到平衡,MDA含量逐渐降低趋于平稳[26]。
Cr6+单一染毒时,蚯蚓体内蛋白含量随着Cr6+浓度的增加先降低后升高,总体大于CK组中蛋白含量,且随着染毒时间延长到48 h时蛋白含量呈降低的趋势,推测可能因为蚯蚓长时间暴露于Cr6+中,重金属染毒损害了机体功能,从而阻碍蛋白的生成来源及合成[27]。在暴露72 h时,蛋白含量变化趋势为先降低后升高至平稳,并且在Cr6+浓度为3.0 mg·L−1时低于CK,可能是机体阻碍蛋白质的产生来源,从而造成蛋白含量的降低[28]。经Cr6+单一染毒后蚯蚓体内SOD活力随Cr6+浓度增加先升高后降低,并且随着染毒时间的延长而降低,说明前期Cr6+的胁迫或代谢过程产生的超氧阴离子,提高了SOD活力[29]。但是长时间的重金属毒害作用,使蚯蚓体内细胞遭受损伤,影响了细胞正常生理代谢,导致SOD活力在后期逐渐降低[30],这与郑丽萍等[31]在研究重金属污染对蚯蚓造成的毒性效果中得出的结论一致。蚯蚓体内CAT活力随着Cr6+浓度和染毒时间的延长呈现先升高后降低的趋势。表明蚯蚓在受到低浓度重金属污染时,CAT活力会逐渐上升,足以去除机体受到污染胁迫产生的自由基,此时机体的抗氧化防御系统打开,对环境变化产生适应[32−33]。在遭受长时间染毒情况下,CAT活力得到强烈诱导,Liang等[34]在研究十澳联苯酷和纳米零价铁复合胁迫对蚯蚓体内CAT活性的诱导时也得出相似结果。蚯蚓体内MDA含量总体随着染毒时间的延长而增加,反映了机体受到污染胁迫后的损伤程度[35]。
杀螟丹和Cr6+二元联合以等毒性比1∶1配比时,拮抗作用随染毒时间的延长先加强后减弱,这可能是因为污染物对细胞膜的损伤作用,抑制了蚯蚓对杀螟丹和Cr6+的吸收,导致毒性降低[36]。有相似研究表明:草甘膦能够降低Cu对蚯蚓的急性毒性,将两者复合污染后毒性表现为拮抗作用[37]。但在对蚯蚓受到常用杀虫剂毒死蜱−噻虫胺−乙草胺3种混合物污染的研究中,毒性表现出明显的协同作用[38]。Tilton等[39]探究毒死蜱和Ni复合污染对土壤中跳虫的影响时发现,联合作用类型表现为拮抗作用,其机理为毒死蜱通过竞争重金属Ni与氨基酸的结合点位从而降低Ni的结合位点,导致Ni对土壤跳虫的毒性作用下降。由此推测,杀螟丹和Cr6+二元联合污染时二者会产生竞争作用,造成其中一种污染物的毒性受到抑制,从而产生拮抗作用。此外,在杀螟丹和Cr6+二元联合染毒时,蚯蚓体内蛋白含量变化规律不明显,可总结为染毒初期,蛋白含量随试验浓度的增加先升高后降低,染毒后期先降低后升高,蛋白含量总体呈降低趋势。以上结果说明,杀螟丹和Cr6+的联合染毒效果与染毒时间及暴露浓度之间存在极大相关性,时间和浓度的差异,决定了蚯蚓遭受外来污染物胁迫的机体损伤程度,从而导致蚯蚓体内蛋白含量有所不同。蚯蚓体内SOD活力在染毒24 h时随着污染浓度的增加而升高,48 h时SOD活力先升高后降低,总体来看SOD活力降低。研究表明细胞的抗逆性以及衰老对SOD的活力存在显著影响,通常情况下,细胞内存在固定的自由基代谢平衡,在染毒初期,机体自身能够生成大量的氧自由基来调节内环境稳定,然而在细胞受到严重污染损害或者在细胞自身衰老时,这种固有的自由基代谢平衡就会被打破,引发细胞内的过氧化反应,对细胞膜系统的结构和功能产生损害[40]。所以随着时间的推移,复合污染使蚯蚓受到的胁迫增强,过多自由基无法得到消除,导致后期SOD活力显著降低[41]。整个复合染毒过程中,不同浓度杀螟丹与Cr6+复合后CAT活力与单一杀螟丹、单一Cr6+染毒相比呈现显著变化。在染毒初期,蚯蚓体内抗氧化酶含量升高,以积极防御免受外来氧化的损伤,表明此时蚯蚓具有抵抗氧化应激的能力。高浓度染毒对CAT活力的诱导作用更强,随着染毒时间的延长,CAT活力提高,其抗氧化能力上升[42]。在研究四溴双酚A和Cd复合污染对蚯蚓和斑马鱼的影响研究中也得出相似的结论[43],联合染毒条件下,相同Cd浓度时对应的CAT活力随四溴双酚A浓度的升高呈现先升高后下降的趋势。MDA含量在染毒24 h时随着试验浓度的升高而降低,在长时间暴露后,MDA含量降低且趋于平缓,说明机体受氧化损伤逐渐减弱,活性氧的产生和清除达到平衡,或是MDA随机体代谢排出体外。在研究Cu和不同浓度La复合污染对蚯蚓MDA含量的影响中也发现了相似情况[44],MDA含量在初期呈先上升后下降的趋势,后期缓慢降低。
4 结论
(1)杀螟丹和Cr6+单一毒性结果显示,其毒性都随着暴露时间的延长而增强,单一毒性为杀螟丹大于Cr6+。当杀螟丹和Cr6+以等毒性比1∶1配比时,联合毒性最终表现为拮抗作用。
(2)杀螟丹单一污染时,赤子爱胜蚓体内蛋白含量随染毒时间的延长总体先升高后降低;SOD活力呈总体下降的趋势;CAT活力和MDA含量在染毒初期被促进,随时间延长均发生大幅度降低。
(3)Cr6+单一污染时,赤子爱胜蚓体内蛋白含量和SOD活力随染毒时间的延长总体呈现下降趋势;CAT活力和MAD含量随Cr6+浓度升高先升高后降低,随时间的延长总体呈上升趋势。
(4)杀螟丹和Cr6+二元联合作用时,赤子爱胜蚓体内蛋白含量变化趋势不明显;SOD活力在前期、中期得到促进,后期受到抑制;CAT活力随染毒浓度的升高而升高;MDA含量随染毒时间的延长持续降低。
