布莱凯特黑牛CRTC1、CRTC3 基因克隆测序及表达分析
2021-03-15刘瑞莉柏学进刘贤勋吕娟娟肖超柱董雅娟
吴 磊,刘瑞莉,柏学进,刘贤勋,吕娟娟,肖超柱,董雅娟,3*
(1.青岛农业大学动物胚胎工程中心,山东青岛 266109;2.山东省黑牛繁育工程技术研究中心,山东青岛 266109;3.山东布莱凯特黑牛科技股份有限公司,山东淄博 256306)
CREB调节转录共激活因子家族(CREB Regulated Transcription Coactivator Family,CRTCs)是由基因组高通量筛选出的一种保守的真核蛋白家族,包含CRTC1、CRTC2、CRTC3 3 个成员。CRTCs家族的卷曲螺旋结构域(Coiled-coil Domain)高度保守,与CREB的碱性亮氨酸拉链结构域(Basic Leucine Zipper,bZIP)相结合,调控CREB的转录[1]。CRTC1在大脑中主要通过调控脑源性神经营养因子(Brain-derived Neurophic Factor,BDNF)来调节树突的生长发育和糖代谢过程[2-3],此外,β-淀粉样蛋白(Amyloid β-protein,Aβ)可能通过影响CRTC1的活性来干扰与记忆相关的基因转录,从而在神经退行性疾病阿尔茨海默病(Alzheimer disease,AD)的发病过程中发挥重要作用[4-5]。CRTC3基因广泛分布于各组织细胞中,在棕色脂肪中CRTC3 蛋白通过儿茶酚胺信号通路影响脂肪代谢。可见,CREB调节转录共激活因子家族参与多种生理调控,对机体生长发育具有重要作用。
本研究以布莱凯特黑牛为研究对象,通过克隆测序检测其CRTC1、CRTC3基因的CDS 序列,并进行生物信息学分析;运用荧光定量检测CRTC1、CRTC3基因mRNA 相对表达量;并用免疫组化技术检测CRTC1、CRTC3 蛋白的表达位点,探讨CRTC1、CRTC3基因与肉牛肌肉生长发育的关系,以期为布莱凯特黑牛品种繁育提供基因储备,并为进一步研究CRTC1、CRTC3基因的功能提供理论基础。
1 材料与方法
1.1 实验试剂及仪器 氨苄、IPTG、X-Gal 购自大连宝生物工程有限公司;琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;T 载体连接试剂盒购自上海生工生物股份有限公司;反转录试剂盒购自青岛擎科生物有限公司;iTaqUniwersal SYBR Green Supermix 5 mL(5×1 mL Vials)购自青岛鑫宇恒一科技有限公司。PCR 仪购自德国Eppendorf 公司;凝胶成像系统购自Alpha Innotech 公司;荧光定量仪购自Bio-Rad 公司;Leica RM2235 切片机购自德国莱卡公司。
1.2 实验动物与样品采集 实验动物来自布莱凯特黑牛科技股份公司,是通过体细胞克隆、胚胎移植等技术培育而成的优良种质[6]。选取饲养环境相同的2、6、10、18 月龄的布莱凯特黑牛和鲁西黄牛各3 头,采集脂肪、睾丸、甲状腺、肺脏、背最长肌、心脏、胰脏、肝脏、脾脏、肾脏10 种组织置于液氮中保存,采集背最长肌置于4%多聚甲醛中保存。
1.3 布莱凯特黑牛CRTC1、CRTC3基因的克隆测序 根据NCBI 网站上的牛CRTC1(登录号:XM_010816996.2)、CRTC3(登录号:XM_010816996.2)基因序列,运用Primer Premier 5.0 设计引物,引物序列如表1 所示。提取黑牛和黄牛背最长肌总RNA,反转录成cDNA,检测OD 值处于1.8~2.0 后,可进行后续实验。以背最长肌组织cDNA 为模板,依次加入2×T5 Super Mix 12.5 µL、上下游引物(10 µmol/L)各0.5 µL、cDNA模板1 µL,置于离心机中混匀后进行RT-PCR 扩增。琼脂糖凝胶电泳后将得到的目的片段进行胶回收,并采用T 载体连接试剂盒将目的片段连接到pMD19-T 载体上,转化并筛选阳性菌落,提取目的基因重组克隆质粒后送至上海生工生物有限公司进行测序。
1.4 布莱凯特黑牛CRTC1、CRTC3基因荧光定量PCR检测 提取睾丸、肺脏、肝脏、脾脏、肾上腺、甲状腺、心脏、胰脏、脂肪、背最长肌的cDNA,以及2 月龄、6 月龄、10 月龄、18 月龄背最长肌的cDNA。以cDNA为模板进行荧光定量PCR。选取GAPDH基因(登录号:NM_001034034.2)为内参基因,根据上述序列设计荧光定量引物(表1),将96 孔板置于冰上,按滴加10 μL SYBR Green 预混液,7.8 μL RNA-free Water,上下游引物(10 µmol/L)各0.6 μL,1 μL cDNA 模板。PCR反应程序:94℃预变性10 min;94℃变性30 s,60℃退火30 s,72℃延伸40 s,40 个循环。检测数据采用2-△△CT值法计算。
1.5CRTC2基因免疫组化检测 取出在4%多聚甲醛中固定的背最长肌进行修剪。在PBS 缓冲液中浸泡10 h,用不同浓度的乙醇脱水,二甲苯透明,浸蜡1 h,待蜡块完全凝固后对背最长肌进行修整,用切片机切成5 μm厚度。置于58℃烘箱中12 h,取出后再依次用二甲苯、不同浓度的乙醇、枸橼酸钠缓冲液浸泡,用PBS 缓冲液冲洗3 次,每次7 min。用滤纸吸净玻片上的液体,滴加山羊血清,然后置于湿盒中,放在37℃的恒温箱中静置30 min。取出后拭去玻片上的血清,滴加一抗,小心置于4℃冰箱中过夜。PBS 缓冲液洗3 次后继续滴加二抗(辣根过氧化物酶),放置在湿盒中,锡纸包裹后放于37℃恒温箱中30 min,PBS 缓冲液洗4 次,每次10 min。滴加DAPI,完全覆盖组织片即可,放在湿盒中,然后置于37℃恒温箱中静置5 min。轻甩PBS缓冲液洗4 次,最后用抗荧光衰减封片剂进行封片处理,继而荧光显微镜检查以及拍片。

表1 引物序列
2 结果
2.1CRTC1、CRTC3基因克隆测序及生物信息学分析 以布莱凯特黑牛背最长肌为模板,克隆测序发现CRTC1、CRTC3基因CDS区分别为1 773 bp和1 725 bp(图1),分别编码590、575 个氨基酸,CRTC1 和CRTC3蛋白的总平均亲水性分别为-0.577、-0.559,等电点pI分别为5.50 和6.17(表2)。进化树(图2)显示与牛、瘤牛、山羊和绵羊的同源性高(>80%),二级结构(图3)显示CRTC1、CRTC3基因不规则卷曲均高于60%,其次为α-螺旋,并含有少量的β-折叠和β-转角。蛋白互作网络图(图4)显示CRTC1、CRTC3基因与盐诱导激酶、AMPK家族基因、FOXO1、FOXO3、AKT1、AKT2、AKT3、TP53、CITED2、CREBBP、CRTB1、ATF3、IRF3、RELA等基因相互作用。
2.2CRTC1、CRTC3、GAPDH基因的PCR 扩增 由图5 可知,扩增产物CRTC1、CRTC3、GAPDH基因分别为63、130、104 bp,产物与预期一致,条带清晰无杂质。
2.3 实时荧光定量PCR 结果 由图6 可知,布莱凯特黑牛CRTC1、CRTC3、GAPDH基因扩增结果良好,特异性强,无杂乱峰,数据可用于下一步分析。
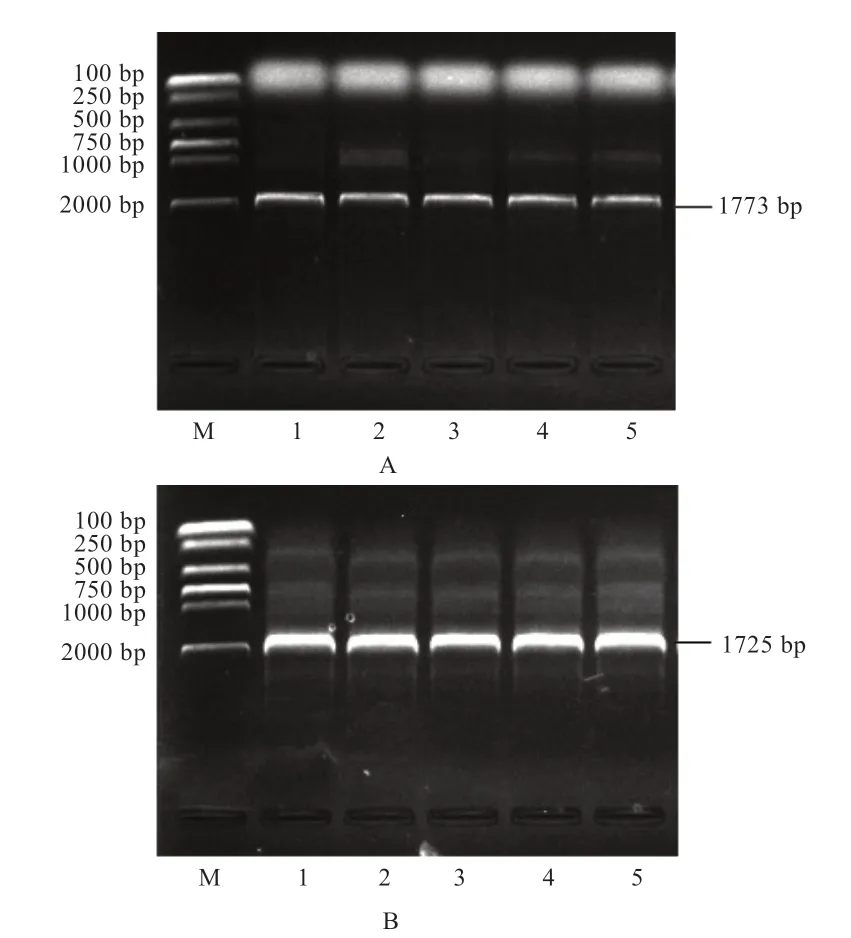
图1 布莱凯特黑牛CRTC1(A)、CRTC3(B)基因CDS 扩增产物
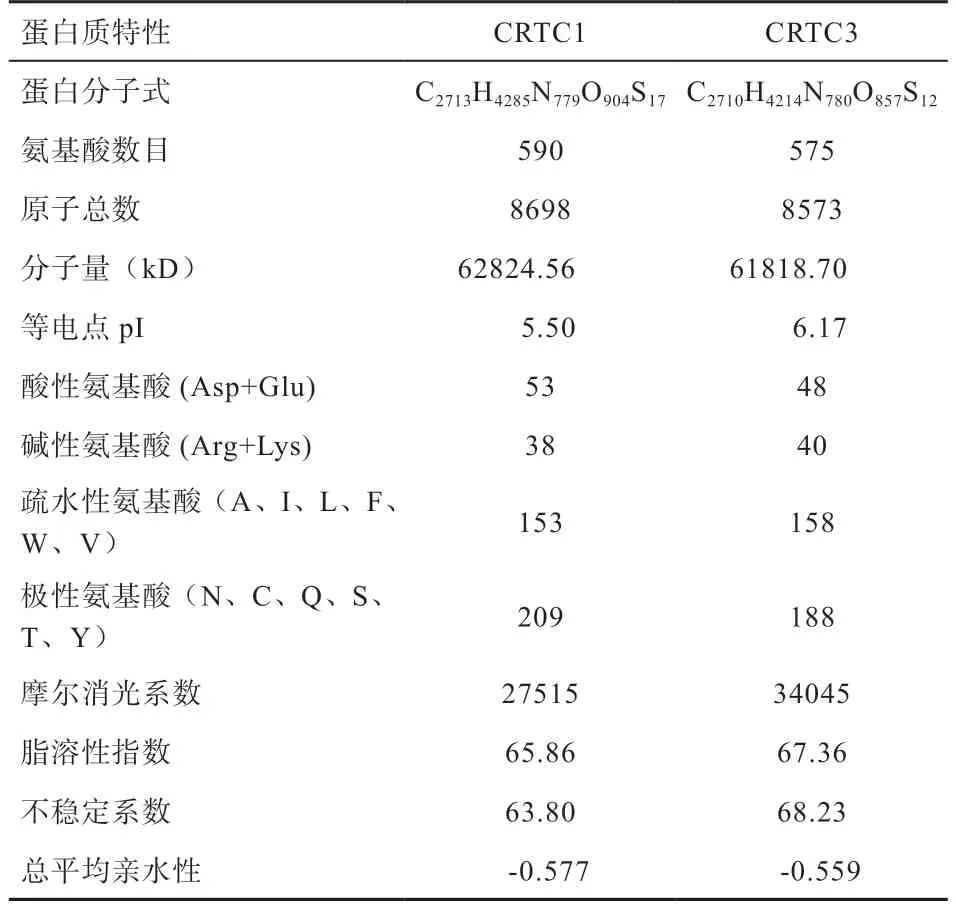
表2 CRTC1、CRTC3 蛋白基本性质
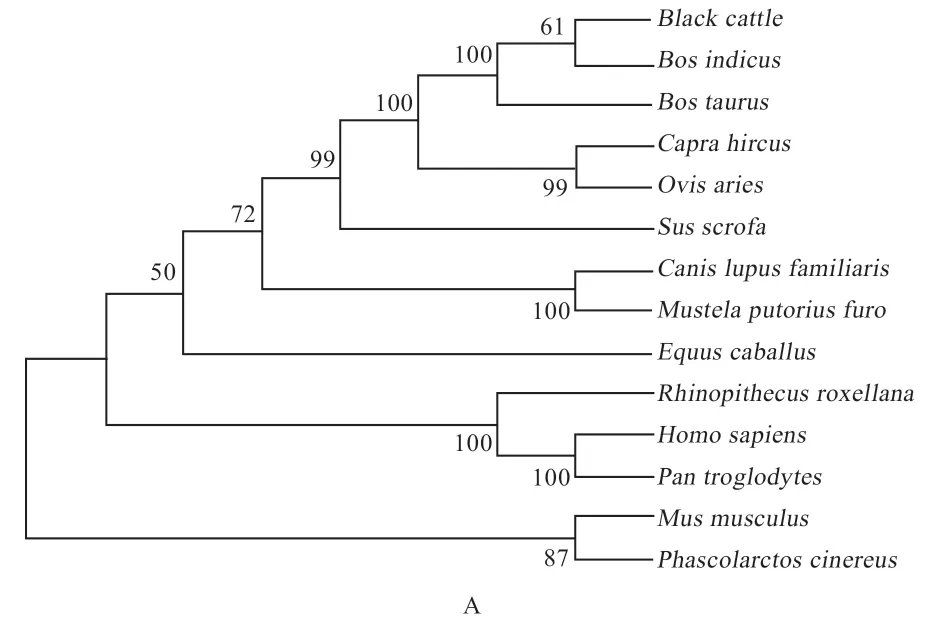
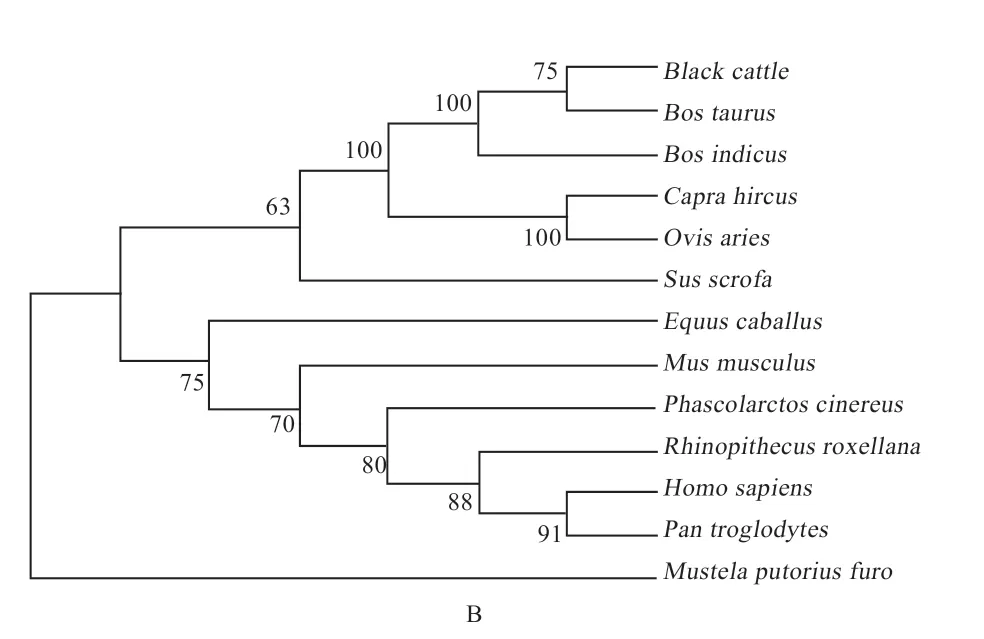
图2 CRTC1(A)、CRTC3(B)cDNA 序列构建的UPGMA 系统发生树
2.4CRTC1、CRTC3基因在不同组织中的表达分析 由图7 可知,CRTC1、CRTC3基因在各组织中均有表达,CRTC1基因在睾丸中的mRNA 相对表达量最高,均极显著高于胰脏、肾上腺、脾脏等其他组织;其次在胰脏中表达,显著高于胰脏和肾上腺组织,极显著高于肝脏、甲状腺等其他组织;在心脏中的表达量最低。CRTC3在脂肪组织中的表达量最高,极显著高于睾丸、甲状腺、心脏、肺脏等其他组织;其次在睾丸和甲状腺中表达,且极显著高于肺脏、心脏和胰脏等其他组织;在肾脏中表达量最低。
2.5CRTC1、CRTC3基因在不同月龄的表达分析 由图8 可知,布莱凯特黑牛和鲁西黄牛背最长肌CRTC1、CRTC3基因在4 个时期中均有表达,并随着年龄的增长表达量逐渐降低。布莱凯特黑牛CRTC1基因在2 月龄表达量最高,极显著高于6、10、18 月龄,在18 月龄表达量最低。CRTC3基因在6 月龄表达量最高,极显著高于10、18 月龄。鲁西黄牛CRTC1基因在2 月龄表达量最高,极显著高于10、18 月龄,显著高于6月龄;CRTC3基因在6 月龄表达量最高,高于2 月龄,极显著高于10、18 月龄。
2.6 CRTC1、CRTC3 蛋白表达分析 由图9 可知,CRTC1、CRTC3 蛋白在背最长肌中呈区域性分布,主要在肌浆内的肌原纤维中表达,横切呈椭圆形,纵切呈纺锤形。
3 讨 论
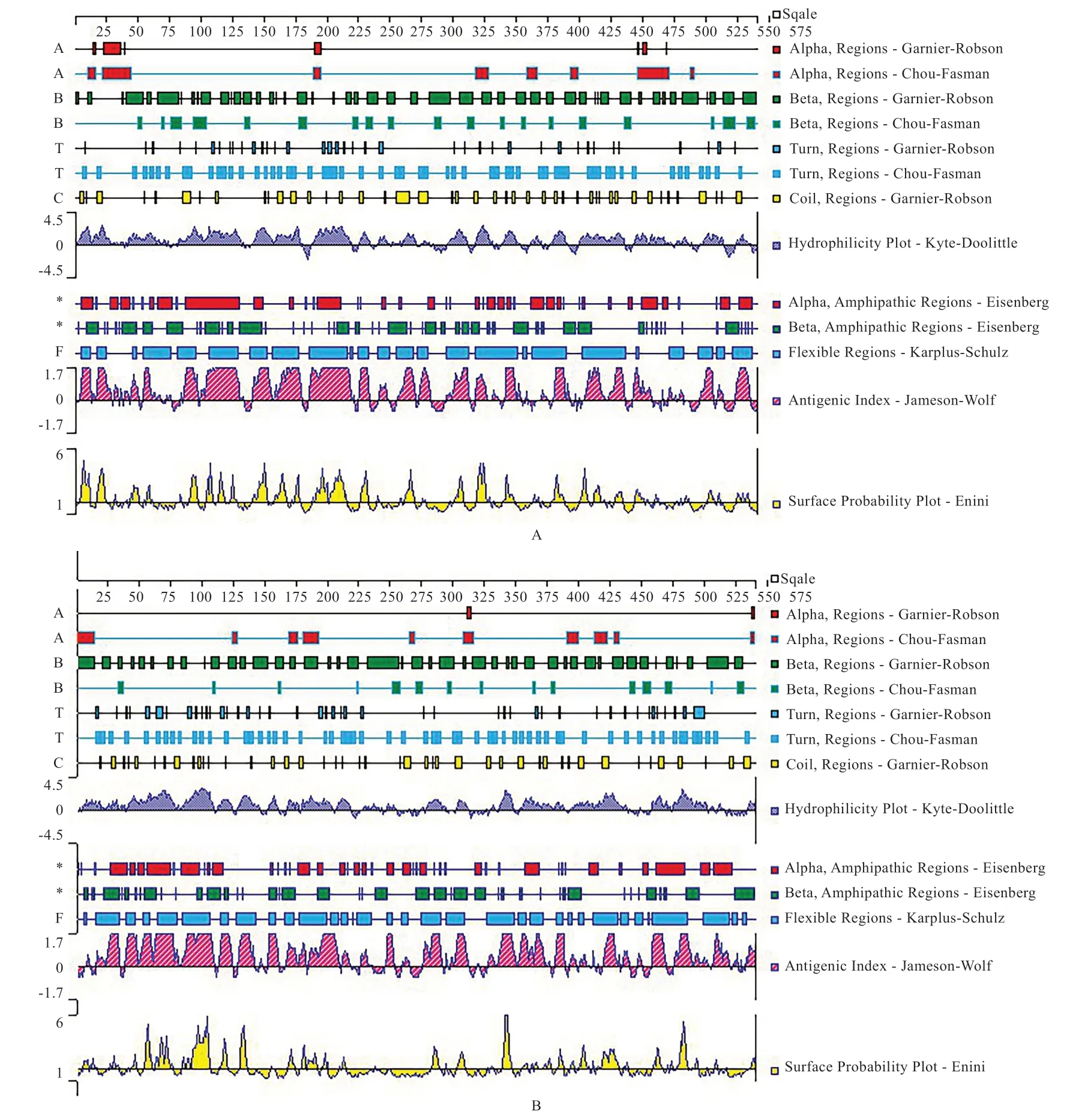
图3 CRTC1(A)、CRTC3(B)蛋白二级结构预测
3.1CRTC1、CRTC3基因CDS 序列分析 本实验利用普通PCR 法克隆了布莱凯特黑牛CRTC1、CRTC3基因序列,结果显示,CRTC1、CRTC3基因CDS 区分别为1 773 bp 和1 728 bp,分别编码575 个和590 个氨基酸,生物信息学分析发现,CRTC1 和CRTC3 蛋白质的不稳定系数分别为63.80 和68.23,均大于40,推断CRTC1和CRTC3 蛋白质的结构稳定性差。蛋白质的总平均亲水性分别为-0.577、-0.559,推断CRTC1 和CRTC3 蛋白为水溶性蛋白,表现为亲水性。CRTC1 和CRTC3 蛋白的等电点pI 分别为5.50 和6.17,均小于7,推断2种蛋白质都是偏酸性蛋白。二级结构预测显示,CRTC1和CRTC3 蛋白的不规则卷曲含量最高,其次为α-螺旋,并含有少量的β-折叠和β-转角,表明该蛋白为非常规蛋白。为揭示CRTC1、CRTC3基因在物种间的亲缘关系,本实验构建了CRTC1、CRTC3基因的系统进化树,结果发现,布莱凯特黑牛CRTC1、CRTC3基因均显示与牛、瘤牛、山羊和绵羊相距最近,与野猪、家犬等物种相距较近,与树袋熊相距最远。推断CRTC1、CRTC3基因序列在反刍动物中具有高度的保守性,进而发挥相同的功能。本实验结果发现,CRTC基因家族与盐诱导激酶(SIK1、SIK2)、AMPK家族基因(PRKAA1、PRKAA2、PRKAA1、PRKAA2、PRKAB1、PRKAB2、PRKAG1、PRKAG2)、FOXO1、FOXO3等基因互作,在与CRTC1、CRTC3互作的基因中,PRKAA1和PRKAA2是调节肌内脂肪含量、背膘厚和眼肌面积等生长性状的基因[7-9],FoxO基因家族通过多种方式调节骨骼肌的生长发育[10-12]。推测CRTC1、CRTC3基因是调控动物肌肉生长发育的候选基因,具体机制有待后续进一步验证。
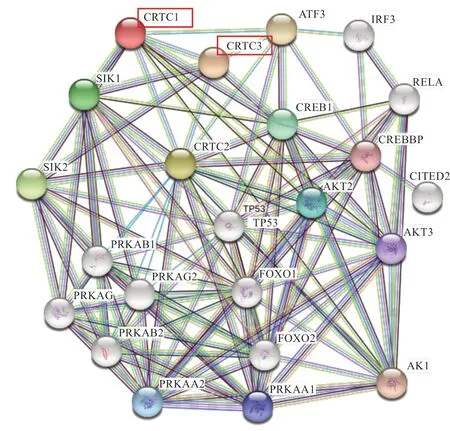
图4 CRTC1(A)、CRTC3(B)蛋白质互作网络图
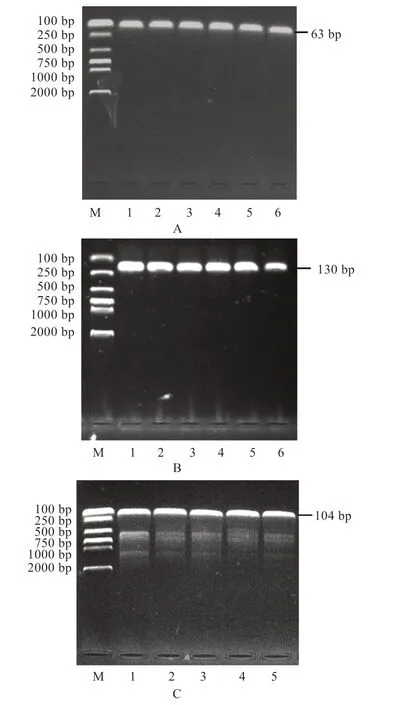
图5 CRTC1(A)、CRTC3(B)和GAPDH(C)基因PCR 扩增
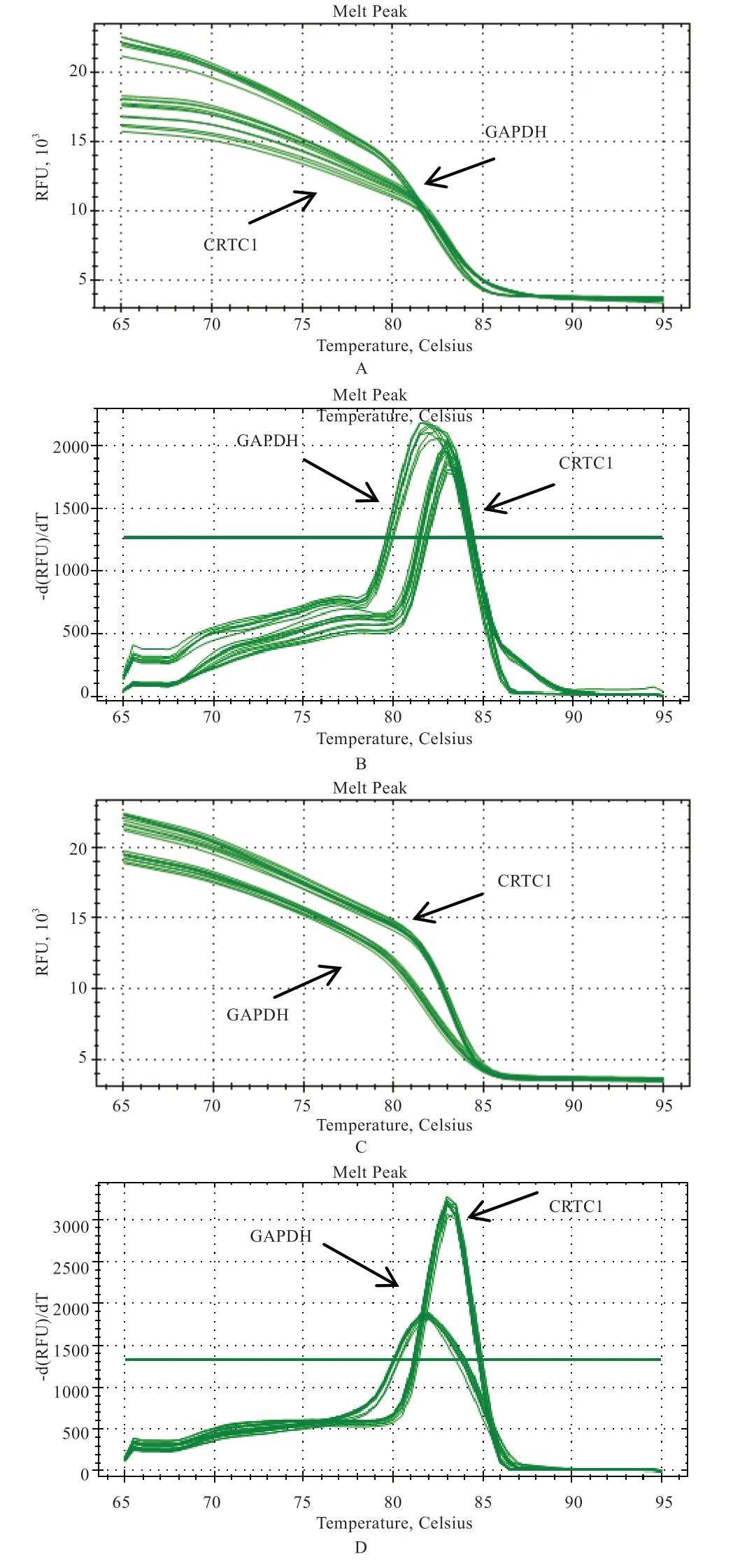
图6 CRTC1、CRTC3 和GAPDH 基因荧光定量扩增曲线(A、C)和熔解曲线(B、D)
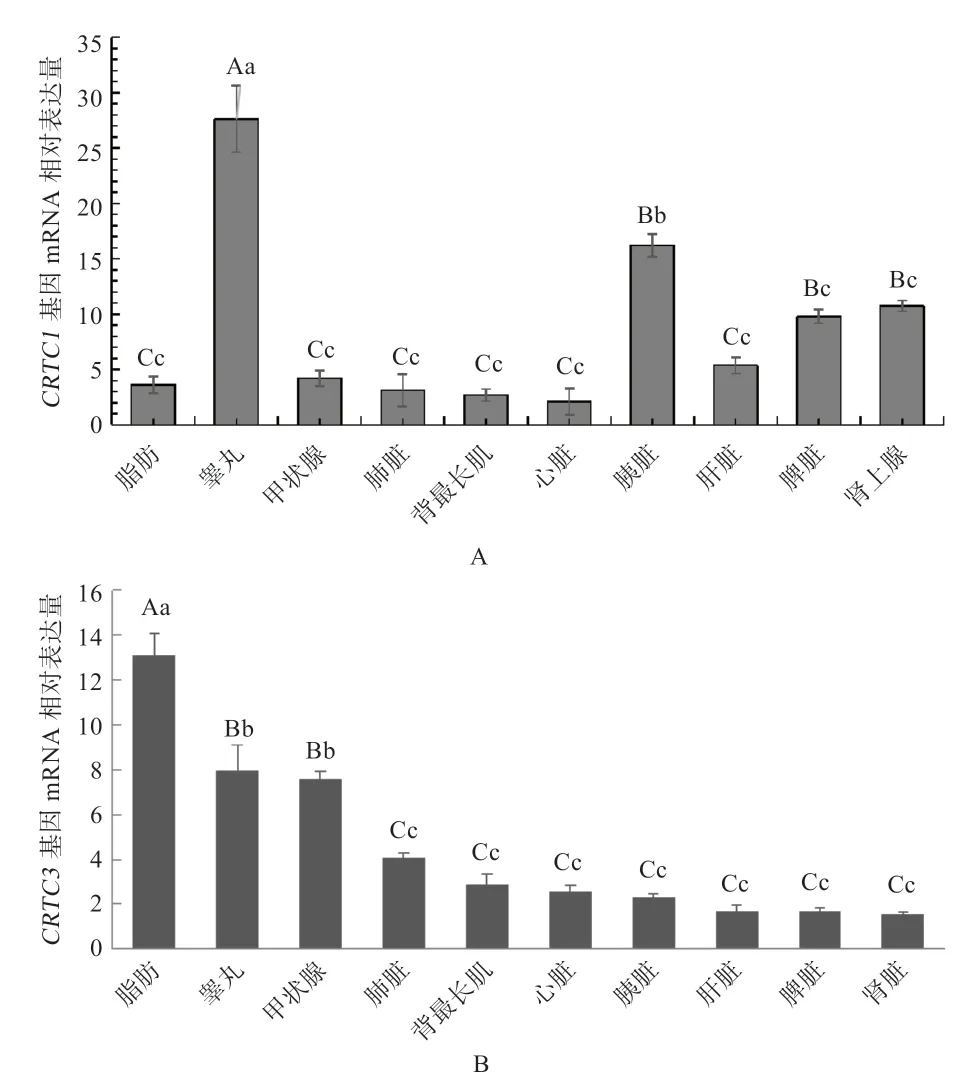
图7 CRTC1(A)、CRTC3(B)基因在不同组织的表达水平
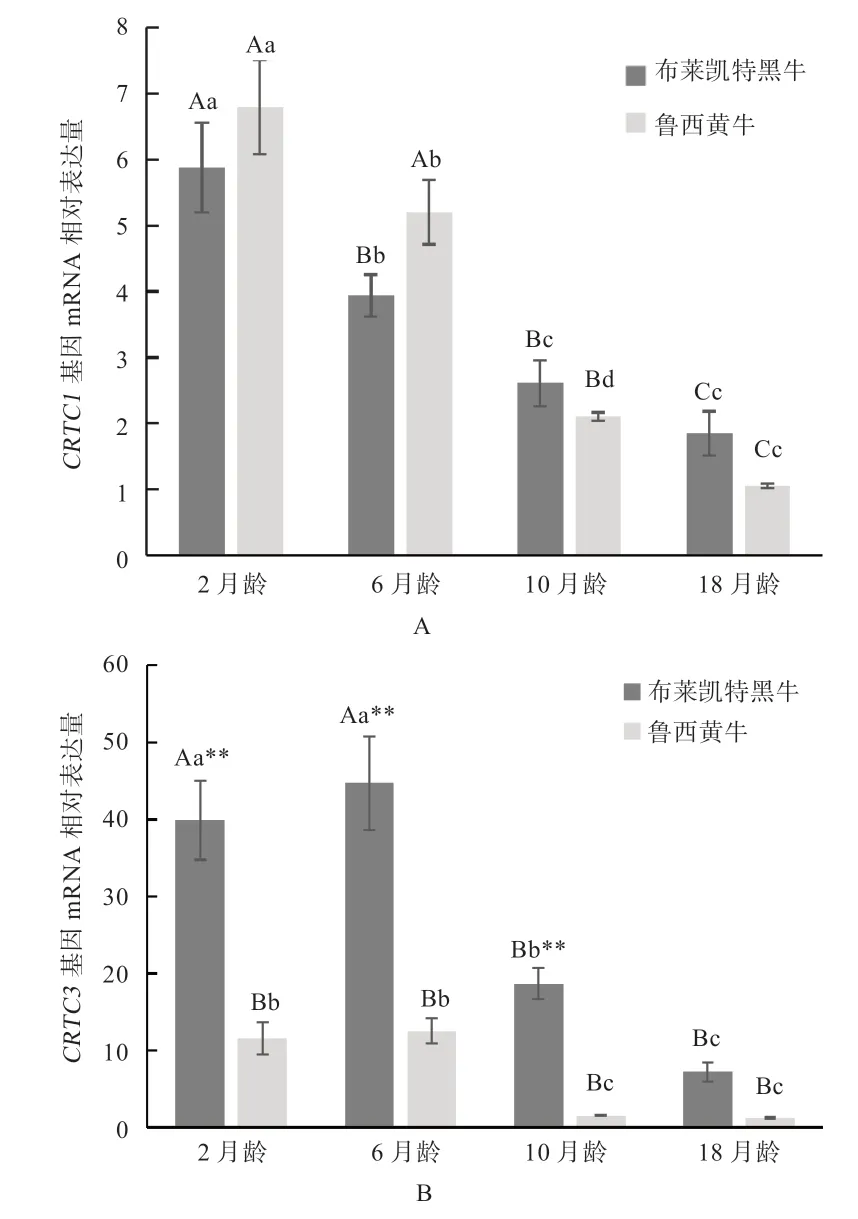
图8 CRTC1(A)、CRTC3(B)基因mRNA 在4 个不同时期的表达水平
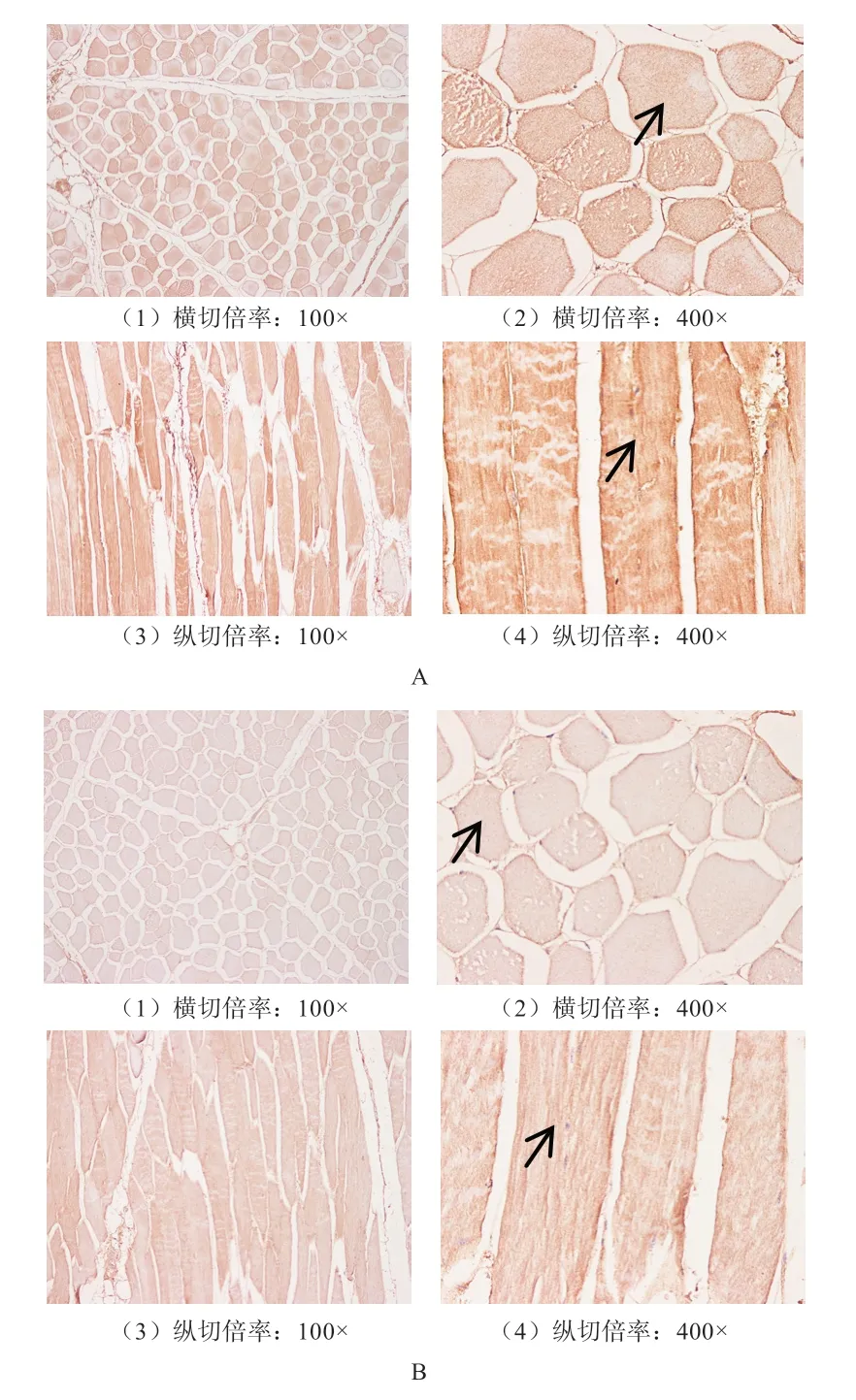
图9 背最长肌中CRTC1(A)、CRTC3(B)蛋白的表达特征
3.2CRTC1、CRTC3基因各组织、年龄分析 qRT-PCR结果显示,CRTC1基因在睾丸中表达量最高,在胰脏、甲状腺、脾脏、背最长肌等组织中表达量较高;在心脏中的表达量最低。推测CRTC1基因在睾丸中起较强的调控作用,在背最长肌等其他组织中也发挥一定作用。目前,CRTC1基因除在大脑的机制研究较为清晰外,脊髓水平CREB/CRTC1 信号活化通过启动其靶基因转录在骨癌痛的维持中也发挥重要作用[13]。本实验发现,CRTC1基因在肌肉组织中也有表达,推测CRTC1在肌肉组织中也发挥一定的调控作用,具体调节机制有待进一步研究。CRTC3基因在脂肪组织中的表达量最高,在背最长肌、肺脏等其他组织中表达量较高;在肾脏中表达量最低。有研究发现,敲除CRTC3基因的小鼠脂肪细胞会变小[14],与本实验结果均表明CRTC3基因对脂肪组织具有调控作用。qRT-PCR 结果显示CRTC3基因在脂肪组织中的表达量高于肌肉组织,这与约克夏猪中的研究结果相一致[15]。Lee 等[15]研究发现CRTC3基因p.V515F 位点的突变影响瘦肉产量、肌肉总面积。也有研究者对牛的CRTC1、CRTC3基因进行了SNP 检测,发现CRTC1基因单倍型组合H3H3(GGAA)、CRTC3基因单倍型组合H1H1(AACCCCTT)对肉牛的生长性状和胴体性状有显著影响[16]。本实验亦发现CRTC1、CRTC3基因在肌肉组织中有表达,进而推测CRTC1、CRTC3基因在肌肉组织中发挥一定的调节作用。
肥育期肌肉的发育是影响屠宰牛等级和肉质的一个重要因素,在肥育阶段肌肉的生长占主要地位[17]。本研究运用实时荧光定量方法检测2 个品种4 个不同时期的CRTC1、CRTC3基因mRNA 表达量,结果发现,2个品种的CRTC1、CRTC3基因的mRNA 相对表达量都随着年龄的增长逐渐降低。有研究者发现,在动物早期阶段,肌纤维的生长速度随着月龄增长逐渐减缓[18],进而推测CRTC1、CRTC3基因参与肌肉生长发育相关调节。
3.3 CRTC1、CRTC3 蛋白定位 本研究发现,CRTC1、CRTC3 蛋白主要定位于细胞质中,在肌浆内的肌原纤维中表达,预示着CRTC1、CRTC3 蛋白对肌原纤维的生长发育具有调控作用。此外,有研究者发现,肌肉组织中的CRTC3 结合到CREB 增加线粒体中呼吸链和三羧酸循环中下游目的基因表达,进而增强了能量代谢[19]。也有研究发现,CRTC3 具有调控小鼠骨骼肌发育和肌纤维重构的作用[20]。这与上述的免疫组化和免疫印迹实验结果相一致,均表明CRTC1、CRTC3 蛋白在肌肉组织中具有调控肌纤维生长发育的作用。
4 结 论
本研究结果发现,CRTC1、CRTC3基因在布莱凯特黑牛的各组织中均有表达,在背最长肌中的表达随着月龄的增加表达量逐渐降低,背最长肌中的CRTC1、CRTC3 蛋白在肌原纤维中表达。综上表明,CRTC1、CRTC3基因调控肌纤维生长发育,进而参与肌肉生长发育相关调节。本研究结果可为布莱凯特黑牛新品种培育提供分子方面理论依据。
