HER2靶向载HSV-TK基因纳米泡诱导胃癌细胞凋亡的体外研究
2021-03-13辛莹周厚妊张月刘慧黄驰刘治军
辛莹,周厚妊,张月,刘慧,黄驰,刘治军*
1.中国医科大学附属盛京医院超声科,辽宁沈阳 110004;2.沈阳药科大学药学院,辽宁沈阳 110016;*通讯作者 刘治军liuzj1@sj-hospital.org
纳米泡作为肿瘤诊疗载体是近年研究热点,可以特异性地靶向识别肿瘤部位,在超声介导纳米泡破坏(ultrasound-targeted nanobubble destruction,UTND)技术下使纳米泡破裂,释放携带的基因,实现肿瘤细胞的靶向治疗[1-3]。然而,外源性基因进入细胞后会被核酸酶裂解,从而丧失功效。本课题组前期研究发现,胍丁胺(agmatine,AGM)-N,N-半胱氨酸双丙烯酰胺(N,N′-cystamine bisacrylamide,CBA)与基因凝聚得到的基因载体复合物具有较高的细胞转染率及良好的核定位效应[4-5]。HER2靶向载单纯疱疹病毒胸苷激酶(herpes simplex virus-thymidine kinase,HSV-TK)基因/AGM-CBA的全氟己烷纳米泡(targeted HER2 AGM-CBA andHSV-TKgene-loaded perfluorohexane nanobubble,tHAHT NB)作为HSV-TK基因/AGM-CBA的载体,通过生物素-亲和素法与HER2抗体Affibody连接,并包载具备相变能力的全氟己烷。本研究以人HER2阳性人胃癌细胞NCI-N87细胞株及HER2阴性人胃癌细胞MGC803细胞株作为材料,探讨tHAHT NB的体外寻靶能力及核定位效应,以及联合UTND技术抑制NCI-N87细胞生长活性和诱导其凋亡的作用。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂 二棕榈酰磷脂酰胆碱(1,2-dipalmitoyl-snglycero-3-phosphocholine,DPPC)、生物素化聚乙二醇-二硬脂酰磷脂酰乙醇胺( 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000],Biotin-DSPE-PEG 2000)(西安瑞禧生物科技有限公司);全氟己烷(perfluorohexane,PFH,上海氟科技);生物素化的抗HER2 Affibody(Abcam);单纯疱疹病毒胸腺素激酶(HSV-TK)基因(Gama gene);胆固醇(CH)及更昔洛韦(Sigma);NCI-N87细胞株、MGC803细胞株(中国科学院细胞库);Annexin V、FITC凋亡检测试剂盒(东仁化学科技有限公司);MTT(大连美仑生物科技有限公司)。
1.1.2 仪器 聚碳酸酯膜挤出器(LiposoFast,AVESTIN);RE-5203旋转蒸发仪(上海亚荣生化仪器厂);低功率聚焦超声实验装置(重庆医科大学超声影像学研究所);流式细胞仪(FACS Calibur,BD);激光共聚焦显微镜(Nikon);多功能酶标仪(赛默飞世尔科技有限公司)。
1.2 纳米泡的制备
1.2.1 基因载体复合物的制备 本课题组前期采用AGM和CBA通过Michael加成法合成非病毒载体AGM-CBA[4]。以1∶9将AGM-CBA与HSV-TK质粒于37℃孵箱中孵育30 min,得到基因载体复合物。
1.2.2 纳米泡的制备 采用薄膜水化法。将8.8 mg DPPC、3.0 mg CH和2.8 mg Biotin-DSPE-PEG 2000溶于无水乙醇中,在45℃、120 r/min下,于旋转蒸发仪上旋蒸15 min,得到均匀的脂质膜。将2 ml PBS溶液缓慢加入含有脂质膜的瓶中,37℃、130 r/min水化15 min,得到脂质体悬液。加入80 μl PFH,在冰浴条件下采用声振仪振荡后,离心清洗,经1 μm和400 nm聚碳酸酯膜挤出得到空白纳米泡(perfluorohexane nanobubble,NB)。通过生物素-亲和素法连接抗HER2分子Affibody,离心清洗后得到HER2靶向空白纳米泡(targeted HER2 perfluorohexane nanobubble,tHER2 NB)。将制备的基因载体复合物溶于2 ml PBS溶液,加入含有脂质膜的西林瓶后同上述进行水化、清洗、挤出、连靶,得到HER2靶向载HSV-TK基因/AGM-CBA 的全氟己烷纳米泡(targeted HER2 AGM-CBA andHSV-TKgene-loaded perfluorohexane nanobubble,tHAHT NB)。
1.3 细胞培养
1.3.1 细胞培养 NCI-N87细胞接种于含10%胎牛血清的1640培养液中,MGC803细胞接种于含10%胎牛血清的DMEM培养液中,在37℃、5% CO2恒温培养箱中孵育,传代周期为3 d。
1.3.2 无低频超声辐照细胞转染 将细胞以5×104个/孔接种于12孔板及共聚焦培养皿,在37℃、5% CO2恒温培养箱中孵育,过夜后弃去培养液,加入900 μl培养液及100 μl纳米泡,对胃癌细胞进行转染。
1.3.3 低频超声辐照下细胞转染 胃癌细胞转染后,经体外超声辐照(频率650 kHz,强度1.5 W/cm,连续辐照30 s),4 h后更换为正常培养液,继续孵育。观察细胞活性及诱导凋亡作用时,按上述超声处理24 h后加入200 μg/ml更昔洛韦(ganciclovir,GCV)100 μl,继续孵育。
1.4 激光共聚焦显微镜检测tHAHT NB的体外寻靶能力 利用DiI染色的tHAHT NB检测其体外寻靶能力。将实验分为NCI-N87组、MGC803组。按步骤1.3.2操作,孵育45 min后用4%多聚甲醛溶液固定,在激光共聚焦显微镜下对比观察纳米泡与NCI-N87细胞和MGC803细胞的靶向结合情况。采用ImageJ软件对细胞荧光进行半定量化,并进行统计学分析。校正后累计光密度(IntDen)=(面积×平均灰度值)-(待测细胞面积×背景平均光密度)。
1.5 激光共聚焦显微镜检测tHAHT NB的核定位效应 利用DiI染色的HSV-TK基因验证tHAHT NB在NCI-N87细胞中的核定位效应。按步骤1.3.3操作,孵育48 h后,PBS清洗3遍,用4%多聚甲醛溶液固定,弃去多聚甲醛,PBS清洗3遍,加入1 ml含10 μl Hochest的PBS,避光进行细胞核染色10 min,用PBS清洗3遍,使用激光共聚焦显微镜观察各组细胞核定位情况。
1.6 细胞活性及凋亡情况
1.6.1 MTT法检测不同处理组内NCI-N87细胞活性实验分组为tHAHT NB+低频超声辐照组(tHAHT NB+US)、tHAHT NB组、tHER2 NB组、空白全氟己烷纳米泡组(NB)、低频超声辐照组(US)、正常细胞组及空白组(不接种细胞,仅添加培养液),取对数生长期的NCI-N87细胞以104个/孔接种于96孔板内,各组经处理后,每孔加入20 μl MTT,在37℃、5% CO2恒温培养箱内孵育4 h后弃去溶液,每孔加入150 μl DMSO,经旋涡振荡器振荡10 min后,用酶标仪测定各孔吸光度(OD)值,根据公式(1)计算细胞活性。

1.6.2 流式细胞术检测不同处理组内NCI-N87细胞凋亡情况 实验分组及处理同MTT法,经胰酶消化后取细胞悬液1000 r/min离心3 min,弃上清液,加入PBS溶液重悬细胞并洗涤3次,加入Annexin V结合液制成浓度为106个/ml的细胞悬液,取100 μl细胞悬液加入5 μl Annexin V,FITC结合物和5 μl PI溶液,轻轻混匀,避光室温反应15 min,加入400 μl Annexin V结合液,置入流式细胞仪进行分析。
1.7 统计学方法 采用GraphPad Prism 8.3.0软件,细胞活性及细胞凋亡率以±s表示,组间比较采用单因素方差分析,两两比较采用Sidak检验,P<0.05表示差异有统计学意义。
2 结果
2.1 tHAHT NB与胃癌细胞的靶向结合情况 激光共聚焦显微镜检测tHAHT NB与NCI-N87细胞及MGC803细胞结合情况,NCI-N87细胞周围可见大量红色荧光,MGC803细胞周围仅见少许红色荧光(DiI标记的纳米泡为红色)(图1A、B)。半定量分析结果显示,与MGC803组相比,NCI-N87组累计荧光密度显著增高(校正后IntDen=-0.24、1272.75),并且与细胞数目呈正相关(r=0.900,P<0.01;图1C),表明tHAHT NB具有良好的靶向能力。
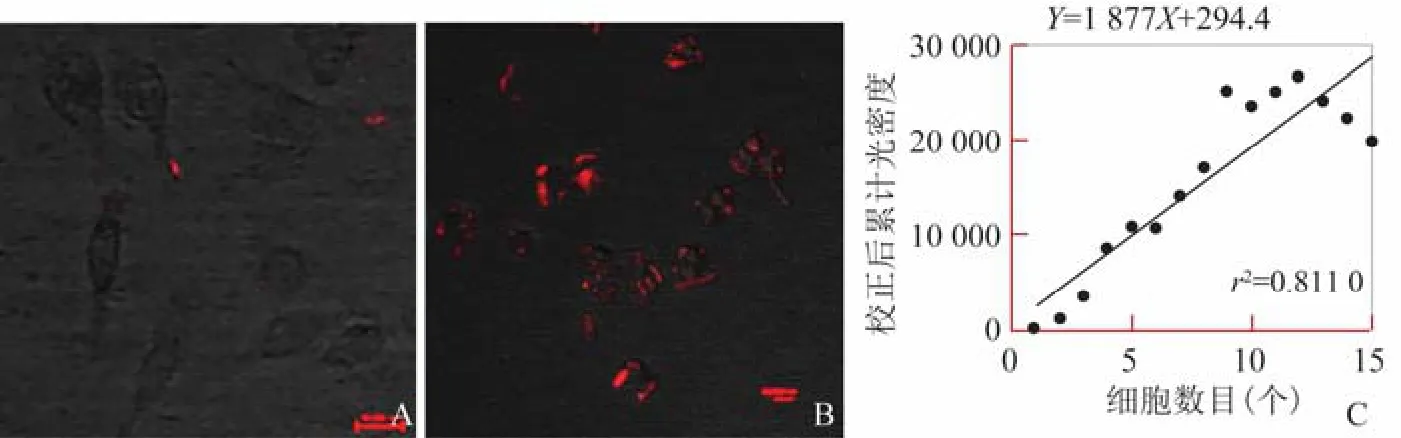
图1 激光共聚焦显微镜检测tHAHT NB与胃癌细胞体外寻靶实验及细胞荧光半定量分析。MGC803组细胞周围仅见少许红色荧光(DiI染色,×200,A);NCI-N87组细胞周围可见大量红色荧光(DiI染色,×200,B);细胞荧光半定量分析示NCI-N87组校正后累计荧光密度与细胞数目呈正相关(C)
2.2 激光共聚焦显微镜检测tHAHT NB的核定位效应 通过激光共聚焦显微镜检测tHAHT NB的核定位情况发现,NCI-N87细胞的细胞核(蓝色荧光)周围有明显的红色荧光,且多聚集在细胞质及细胞核周围(图2)。
2.3 细胞增殖活性及凋亡情况 采用MTT法检测细胞活性,Annexin V流式细胞仪检测细胞凋亡率(图3,表1),各组间差异有统计学意义(F=139.2,P<0.01);两两比较发现,NB组与US组、tHER2 NB组与US组、NB组与tHER2 NB组间差异无统计学意义(t=1.70、2.16、0.46,P>0.05);与tHAHT NB组、tHER2 NB组、US组及NB组相比,tHAHT NB+US组细胞活性明显减低,细胞凋亡率显著增高,差异有统计学意义(MTT:t=11.48、18.09、18.55、20.25,P<0.01;Annexin V:t=18.00、25.74、25.53、23.23,P<0.01)。

图2 激光共聚焦显微镜检测tHAHT NB的核定位效应。细胞核染色显示为蓝色荧光(Hochest染色,×200,A);HSV-TK基因染色显示为红色荧光(DiI染色,×200,B);C为A和B的合并

图3 细胞凋亡及细胞活性检测。A~E分别为Annexin V-FITC/PI双染流式细胞仪检测tHAHT NB+US、tHAHT NB、tHER2 NB、NB、US组细胞凋亡情况;F为MTT法检测不同处理组的细胞活性
表1 不同处理组对NCI-N87细胞活性及诱导凋亡的影响(±s,%)

表1 不同处理组对NCI-N87细胞活性及诱导凋亡的影响(±s,%)
注:与NB组比较,*P<0.01,与tHAHT NB+US组比较,#P<0.01
组别细胞活性细胞凋亡率tHAHT NB+US组 35.97±4.01* 54.3±3.5*tHAHT NB组20.7±3.1*#tHER2组 90.69±3.44# 6.2±0.7#70.70±8.00#NB组6.6±1.0#US组 97.21±2.04# 3.6±1.5#92.07±4.27#
3 讨论
胃癌是全球常见的恶性肿瘤之一,多数发现时已是晚期,寻找一种新的非侵入性治疗方法具有重要意义[6-7]。自杀基因疗法是目前肿瘤治疗领域的研究热点,其中HSV-TK基因/GCV系统较为成熟,HSV-TK基因表达后可将GCV代谢为丙氧鸟苷三磷酸形式,抑制DNA聚合酶或合并到新生DNA链中,终止DNA的复制,从而诱导肿瘤细胞凋亡[8-9]。HSV-TK/GCV系统具备两种“旁观者肿瘤细胞杀伤”机制:①局部“直接”旁观者效应,经缝隙连接转移至未转染的邻近肿瘤细胞;②非局部全身免疫介导的旁观者效应,在杀死表达HSV-TK的肿瘤细胞后,体内免疫状态被激活,刺激细胞表面表达肿瘤特异性或相关抗原[10]。
缺乏安全高效的基因输送系统是“自杀”基因治疗的一大障碍[11]。纳米泡作为肿瘤诊疗载体可以靶向识别肿瘤部位[12-13],在UTND技术的空化作用及声孔作用下可使外壳破裂,释放基因及药物,并增加血管内皮间隙和细胞膜通透性,从而弥补由于肿瘤异质性及增强渗透和保留(the enhanced permeability and retention,EPR)效应高度可变性引起的药物及基因传递效率较低[14-15]。外源性基因进入细胞后,被核酸酶裂解而丧失功效,本课题组前期研究发现,含胍基的可再生聚氨基胺类阳离子聚合物AGM-CBA可以凝聚和压缩质粒DNA,保护其不被核酸酶降解,并在胍基的作用下促进细胞摄取和核定位效应,从而提高细胞转染效率[16-17]。
本研究通过激光共聚焦显微镜和半定量分析发现,与MGC803细胞相比,NCI-N87细胞周围可见大量红色荧光,累计荧光密度显著增高,并与细胞数目呈正相关,表明经生物素-亲和素法与HER2抗体Affibody连接的tHAHT NB具备靶向性,能够特异性地识别并结合NCI-N87细胞。经UTND技术处理后,HSV-TK基因多聚集于NCI-N87细胞的胞质及细胞核周围,表明tHAHT NB具备核定位效应。MTT及Annexin V检测发现,单纯tHER2 NB、NB及US对细胞活性的影响及诱导凋亡的作用不显著;tHAHT NB和tHAHT NB+US明显减低了细胞增殖活性,并提高了细胞凋亡率;且tHAHT NB+US组较tHAHT NB组细胞活性显著减低,细胞凋亡率明显增高,表明UTND技术增强了tHAHT NB对细胞的增殖抑制及诱导凋亡的能力,其可能的机制为:①tHAHT NB在超声辐照下通过空化效应使外壳坍塌,释放HSV-TK基因/AGM-CBA;②在稳定空化作用下tHAHT NB规律性机械扰动,改变细胞膜电位促进内吞作用;③在稳定空化变为惯性空化时,血管内皮细胞遭到破坏,扩散能力增强;④在惯性空化作用下细胞产生瞬态孔隙,促进细胞内大分子的摄取。
本研究表明,载HSV-TK基因的tHAHT NB联合UTND技术能够有效地抑制NCI-N87细胞的增殖活性,诱导细胞凋亡,但是未能深入研究UTND技术对促进基因转染的机制,课题组将进一步研究UTND技术促进基因转染的机制,并探讨其是否会影响HSV-TK/GCV系统“旁观者肿瘤细胞杀伤”机制。
总之,HER2靶向载HSV-TK基因/ACM-CBA的全氟己烷纳米泡可以特异性地靶向识别NCI-N87细胞,并具备核定位效应,联合UTND技术能够有效地抑制NCI-N87细胞的增殖活性,显著提高诱导细胞凋亡的作用。
