注射用盐酸米诺环素微球贮库的制备及其性能研究
2021-03-13程玉婷吴小红
张 婷,廖 航,程玉婷,吴小红*
(1重庆医科大学附属口腔医院,重庆401147;2口腔疾病与生物医学重庆市重点实验室,重庆401147;3重庆市高校市级口腔生物医学工程重点实验室,重庆401147)
慢性牙周炎是最常见的口腔疾病之一,其导致的持续牙槽骨丢失将引起牙齿松动[1]。盐酸米诺环素(minocycline hydrochloride ,MH)是一种广谱的四环素类抗生素,用于对抗引起周期性炎症的大多数细菌[2]。除了抗菌活性外,盐酸米诺环素已被证明可以抑制骨吸收和促进骨形成[3]。研究表明这种抗生素质量浓度为1 mg/mL,即血浆中的标准治疗浓度,显著增加了人类骨髓成骨细胞的增殖[4]。但是,Almazin 等[5]发现牙周袋中高浓度的抗生素可能直接或间接影响支持性牙周组织的活细胞,尤其是骨形成的成骨细胞。此外,高水平的盐酸米诺环素会对细胞产生剂量依赖性的毒性作用,抑制成骨细胞的增殖和分化[4]。前期课题组也研究表明一定浓度的米诺环素可以促进成骨细胞的增殖,而随着浓度的增加这种促增殖作用开始下降[6]。因此,为了避免局部高浓度的抗生素,亚抗菌剂量的盐酸米诺环素及其局部释放的有效性成为最近研究的焦点[7]。前期本课题组制备盐酸米诺环素PLGA 纤维膜改善米诺环素突释,从而使其在抑菌的同时能促进成骨细胞的增殖,但它第1 天的释放仍约为20%[8]。
蔗糖醋酸盐异丁酸酯(sucrose acetate isobutyrate,SAIB)贮库是一种很有前景的注射型缓释系统[9],具有生物降解性和生物相容性[10],并且加入少量的溶剂(如乙醇),便可以显著降低SAIB 的黏度。当贮库被输送到体内时,随着溶剂从贮库扩散到周围组织,从而缓慢释放药物,它就从液态变成了半固态。但是当溶解在溶剂中的药物浓度过高时,也可能出现初始的突释[11]。Lin等[12]将PLGA微球与SAIB 贮库相结合可将利培酮在第1 天的释放降低到0.64%,前期本研究将PCL 微球与SAIB贮库结合可将柚皮苷在第1 天的释放降低到6.3%[13]。微球作为最常用的药物递送系统之一,制备它的方法有很多,其中静电喷雾具有许多优点,如改善均匀性或单分散性、减少团聚、高封装效率和制备简单[14-15]。PLGA是一种可生物降解的聚合物,应用广泛,具有良好的生物相容性和生物降解性,并且它有可能精确控制药物释放数天到数月的动力学过程[16-18]。因此,本研究旨在制备负载盐酸米诺环素的PLGA 电喷微球,并分析其形态、表面润湿性、药物释放及其降解等性质,并将微球与SAIB结合,以期获得更好的缓释作用。
1 材 料
1.1 原料与试剂
聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA,n(LA)∶n(GA)=75∶25,济南岱港生物材料有限公司;相对分子质量80 kD];盐酸米诺环素标准品、蔗糖醋酸盐异丁酸酯(SAIB,相对分子质量846.91,1.146 g/mL)(美国Sigma 公司)。其他试剂均为市售分析纯。
1.2 仪 器
静电纺丝仪(北京永康乐业科技发展有限公司);扫描电子显微镜(日本Jeol公司);偏光显微镜(日本Nikon 公司);酶标仪(美国Thermo Scientific公司);接触角测量仪(北京环球恒达科技有限公司);激光共聚焦显微镜(德国Leica 公司;图像分析软件ImageJ(美国国立卫生研究院)。
2 方 法
2.1 盐酸米诺环素微球的制备
将PLGA 溶于氯仿,得到质量分数为8%的PLGA 溶液,然后将盐酸米诺环素(相对于PLGA 的质量分数为0%,2%)加入PLGA 溶液中,用磁力搅拌器恒温搅拌2 h 充分混合。在室温下,将所配置的溶液分别装入21 号不锈钢钝性针头的5 mL 注射器,针头与高压直流电源的正极相连,与针头相距20 cm 的接收滚筒上接负极,滚筒上盖着铝箔纸,作为微球的接收器,制备得到空白微球(M)以及盐酸米诺环素微球(minocycline hydrochloride microsphere,MH-M)。制备微球的电喷参数如下:8%PLGA溶液在14 kV的高压电场中,以0.25 mL/h的推注速度,相对湿度控制在31%~33%,温度控制在21~23 ℃。铝箔纸上覆盖载玻片收集微球,然后置于倒置相差显微镜下观察其形态。电喷结束后,铝箔纸置于恒温箱中干燥48 h,挥发残留的有机溶剂,收集到的微球转移至小玻璃瓶于-20 ℃保存。
2.2 盐酸米诺环素微球的特征
2.2.1 盐酸米诺环素微球的大小与形态 收集到微球的铝箔纸剪成1 cm×1 cm,固定在样品台上,旋转蒸镀仪喷金,使用扫描电镜(SEM)进行观察;载玻片收集到的微球在偏振光显微镜下观察,用ImageJ 软件测量微球直径并计数(每个样本超过100 个),结果以表示;微球直径的单分散性即粒径分布一致性,用变异系数CV(%),CV 越低表明微球单分散性即粒径分布一致性越佳。
2.2.2 接触角测试 用铝箔纸收集到的微球直接进行接触角仪器检测,每组3 个样本,每个样本重复测量3次,结果以xˉ±s表示。
2.2.3 盐酸米诺环素微球的载药量以及包封率针对包封率测定,用超速离心法测定微球表面游离MH 的含量。称取微球5 mg,精确到0.1 mg,溶于PBS 溶液1 mL 中,混匀形成样品溶液,转移到1.5 mL 超速离心管中,然后在13 000 r/min 离心10 min。提取上清液,利用酶标仪在350 nm 波长处分析。重复3次,计算包封率。
针对载药量的测定,通过将微球5 mg 溶解在无水乙醇1 mL 中,超声处理10 min 后直至样品中聚合物完全溶解,然后在15 000 r/min离心20 min。最后提取上清液并利用酶标仪在350 nm 波长处分析,从而来测定球体中的MH 含量。重复3 次,计算载药量。
2.2.4 盐酸米诺环素微球的药物分配 盐酸米诺环素属于第二代半合成的四环素族药物,具有在一定条件下能够被激发出绿色荧光的特性。因此,将电喷微球样品置于玻片上,在激光扫描共聚焦显微镜下,使用375 nm的激发波长进行观察。
2.3 盐酸米诺环素/SAIB以及盐酸米诺环素微球/SAIB的制备
将SAIB 与EtOH 混合得到透明的SAIB-EtOH溶液(SAIB 质量分数为80%)。使用前,将盐酸米诺环素0.1 mg 分散在上述SAIB-EtOH 系统中以产生盐酸米诺环素/SAIB(MH-SAIB)贮库。类似地,将盐酸米诺环素微球5 mg在SAIB-EtOH溶液50 mg中旋转5 min均匀混合,以获得盐酸米诺环素微球/SAIB(MH-M-SAIB)混合贮库(约含盐酸米诺环素0.1 mg)。
2.4 体外释放
取盐酸米诺环素微球5 mg(约含盐酸米诺环素0.1 mg)以及MH-M-SAIB(约含盐酸米诺环素0.1 mg)50 mg 分别 加入 含 有PBS 溶 液1 mL 的1.5 mL EP 管(pH 7.4,0.02% NaN3)。所有的样本置于摇床中恒温37 ℃水浴。于定点时间取样,将各样本溶液进行13 000 r/min离心10 min后取上清液,采用酶标仪测量药物吸收度。所有的实验重复3次。
2.5 体外降解
体外降解率是通过测定微球在PBS 中浸泡过程中的失重进行测定[8]。因此,分别将空白微球以及盐酸米诺环素微球5 mg 浸泡在PBS 1.5 mL中,并在37 ℃恒温箱中保存60 d。在特定的时间间隔内测定PBS 溶液pH,并与新鲜PBS 交换溶液,以确保pH 恒定为7.4。每个降解期后(7,15,30,45,60 d),样品用去离子水洗涤,在冷冻干燥箱中干燥2 d,电子天平秤重,计算降解实验后的体外降解率。降解率(%)=(W0-Wt)/W0× 100。其中,W0和Wt分别是降解期前后电喷微球的干燥重量。每个样本组至少重复3次。
2.6 孔隙率
将SAIB 溶液注入水相,外水迅速扩散到贮库中,而溶剂则从基质中扩散到水相中。这导致富水区域的多孔网络的形成,周围是一个富含SAIB的系统。孔隙率是通过测试扩散到贮库的液体的体积来确定的。将约分析样品50 mg 注入PBS 1.5 mL 中,并置于37 ℃恒温箱中。在特定时间(2,8,15,30,45 d)取PBS。然后,贮库被冻干以除去吸收的液体。通过测量冻干前后的水位差,可以方便地确定贮库吸收的液体量。因此,孔隙率可用公式(1)计算:
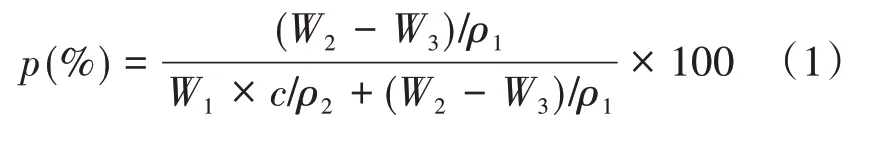
式中:p为孔隙率,W1为SAIB 溶液的质量,W2为吸收液体后贮库的质量,W3为贮库冻干后的质量,c为SAIB溶液中SAIB的浓度,ρ1为液体的密度,ρ2为SAIB的密度。每种溶液的试验重复3次。
2.7 统计分析
数据以表示。单因素方差分析(ANOVA)和SNK-q 测验用来确定统计显著性。所有计算均使用SPSS软件20.0版进行,P<0.05被认为具有统计学意义。
3 结果与讨论
3.1 盐酸米诺环素微球的特征
图1-A 及图1-B 分别是微球的光学及电子显微镜图。由图可见微球大多数呈球形,较均匀,且表面相对光滑。同时,用ImageJ 测得微球直径为(5.294 ± 1.222)μm,变异系数CV 为11.22%,微球的尺寸分布较窄,分布图如图1-D所示。
接触角测试是材料亲水性能表征的重要指标之一,经测量微球接触角为(95.98 ± 0.67)°(图1-C),表明该材料表面较疏水,并且微球的载药量和包封率分别为(1.689 ± 0.005)%和(69.57 ± 0.23)%,有研究表明亲水性药物与具有末端亲水基团的PLGA 结合所制得的载药微球具有较高的包封率[19],因此有望通过增加该材料的亲水性来增加盐酸米诺环素的包封率。激光共聚焦显微图像见盐酸米诺环素均匀分布于微球内(图2)。
3.2 盐酸米诺环素微球及微球贮库的体外释放
盐酸米诺环素微球的体外释放曲线如图3-A所示。微球第1 天的药物释放达60%,前3 天释放接近66%,随后每天以约2.7%的释放速率持续至第7天。
MH-M-SAIB 和MH-SAIB 贮库在PBS 培养基中的体外药物释放曲线如图3-B 所示。由图可知,将盐酸米诺环素微球装入SAIB 贮库后,第1 天药物释放率从61.24%下降到3.27%,然而MH-SAIB 贮库仍然显示出明显的突释(高达24.79%)。在最初的7 d里,MH-M-SAIB以及MH-SAIB都显示出高浓度药物释放率,累计释放18.15%和56.16%,前7 天的平均释放率分别约为2.59%和8.02%(图3-B)。7 d 后,药物从MH-M-SAIB 以及MH-SAIB 贮库中以约每天1.03%的释放速率持续释放,直至第42 天,总共释放55.29%以及91.09%。体外药物释放实验数据用常用的4 种释放动力学模型拟合,即零级(方程式:Q= a + Kt)、一级(方程式:ln(1-Q)=a+Kt)、Higuchi(方程:Q=a+Kt1/2)和Ritger Peppas(方程:Q=Ktn)模型[20-22],研究了基于SAIB 贮库的MH 药物释放动力学,得到的模型方程以及参数见表1。在所有模型中,Ritger-Peppas模型具有较好的一致性,因此用于拟合MH-MSAIB 以及MH-SAIB 的溶出曲线,以评估MH 的药物释放,良好的拟合反映在表2 中。SAIB 贮库MH释放曲线的线性拟合表明存在两个释放阶段(表2),斜率代表药物释放速率,从第1 天到第7 天,MH-SAIB 的药物释放速率大于MH-M-SAIB 贮库,差异有统计学意义(P<0.05),而第7 天后,MH-MSAIB 的药物释放速率稍大于SAIB 贮库,但差异无统计学意义(P>0.05)。
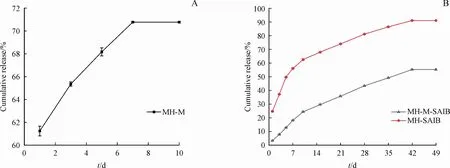
Figure 3 Release curves of MH-M(A)and sucrose acetate isobutyrate(SAIB)-based depot MH-SAIB and MH-M-SAIB(B)(xˉ± s,n = 3)

Table 1 Parameters obtained by fitting four different models to the release data for SAIB-based depot drug release kinetics
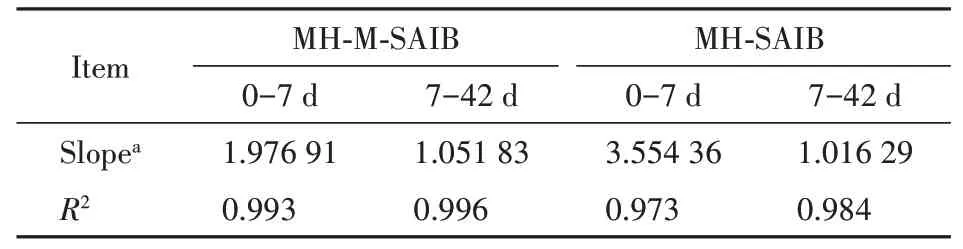
Table 2 Evaluation of drug release kinetics of SAIB-based depot according to the Ritger-Peppas equation
局部应用抗生素治疗牙周炎的成功主要依赖于抗菌药物的持续释放[23],并且盐酸米诺环素在适宜浓度内能有效促进成骨细胞的增殖,而高浓度反而会抑制成骨细胞的增殖。盐酸米诺环素对密螺旋体的最小抑制浓度小于0.125 μg/mL[24],对放线杆菌的最小抑制浓度为0.25 μg/mL[25],同时,Almazin 等[5]发现盐酸米诺环素质量浓度为0.5 mg/mL 时,对成骨细胞产生了毒性作用,本课题组前期研究发现米诺环素质量浓度为10 μg/mL 时,对成骨细胞的增殖作用开始下降[6]。总之,一个有效的药物传递系统通常是将一种治疗物质引入体内,通过控制药物在体内释放的速率、时间和位置来提高其有效性和安全性,并避免不良反应[26]。因此,本实验将盐酸米诺环素第1天的释放率降低到了3.7%,以后以约1.03%的释放速率缓慢持续至42 d,不仅能达到盐酸米诺环素的有效抑菌浓度,而且该浓度也未对成骨细胞产生毒性作用,可做进一步实验验证其成骨及抑菌效果。
3.3 空白微球以及盐酸米诺环素微球的降解
已知PLGA降解遵循伪一级动力学[27]。由表3可知,降解曲线的方程拟合表明盐酸米诺环素微球存在3 个降解阶段,空白微球存在2 个降解阶段,盐酸米诺环素微球和空白微球的降解与伪一级方程拟合都得到了较好的一致性。由图4可知,盐酸米诺环素微球降解速率由大到小依次为45~60 d、0~7 d、7~45 d,空白微球的降解速率由大到小依次为45~60 d、0~45 d。这主要是因为,PLGA 体外降解是通过酯键的水解进行,然而分子链上酯键的水解断裂是无规则的,每个酯键都可能被水解,被水解的部位越多,相对分子质量降低也就越快,然而PLGA 相对分子质量只有降低到某一临界值,才能溶解于水。因此在降解前期,微球表层分子链无规断裂,形成极少量能溶于水的小分子链断,相对分子质量显著降低,而微球无明显质量下降现象,但是随着降解时间的延长,大量的小分子链断开始在微球中形成,并扩散溶解进模拟体液,微球质量损失速率加快。所以表现为体外降解前期相对分子质量降低幅度较大,后期质量损耗幅度大[28-30]。同时,在0~7 d,盐酸米诺环素微球以及空白微球的降解率分别为8.66%和6.66%,盐酸米诺环素微球的降解率大于空白微球,盐酸米诺环素微球在0~7 d 的药物释放率(70.26%,约0.07 mg)表明,在0~7 d 时药物大量释放(由图3-A 可知);而在7~45 d 以及45~60 d,盐酸米诺环素微球以及空白微球的降解率都分别为21.34%以及18.66%,两者之间无差异,这表明微球的降解速率与所含药物与否没有相关性。空白微球及盐酸米诺环素微球在60 d 内降解约50%,表明当盐酸米诺环素释放结束后,该材料仍存于体内,因此有望进一步研究得到释放与降解时间的统一。

Table 3 Evaluation of degradation kinetics of microspheres according to pseudo-first order equation

Figure 4 Degradation image of MH-M and blank microspheres(M)(xˉ± s,n = 3)
3.4 MH-M-SAIB以及MH-SAIB的孔隙率
当微球分散在基质丰富的相并扩散到PBS 缓冲液中时,贮库显示出不同的孔隙率(代表不同的扩散速率)。图5显示了MH-M-SAIB以及MH-SAIB在PBS 介质中的孔隙率变化。从2~45 d,MH-MSAIB 的孔隙率始终高于MH-SAIB,这可能是由于微球本身具有吸水性,从而导致更高的孔隙率。此外,在2~15 d 时,MH-M-SAIB 的孔隙率增长迅速,15 d 后则相对稳定;而MH-SAIB 在2~8 d 时增长迅速,8~15 d 增长稍慢一些,15 d 后相对稳定,这表明释放行为可能与孔隙率的变化有关。在15 d 之前观察到一个相对陡峭的变化率,这和MH-SAIB 和MH-M-SAIB 的快速药物释放有关,而在15~45 d 之间观察到缓慢的速率变化,对应于稳定和长期的释放。并且MH-M-SAIB的孔隙率一直大于MH-SAIB,但是MH-M-SAIB 的药物释放速率却低于MH-SAIB,这表明在SAIB 贮库中,药物释放速度主要受溶解于SAIB贮库中的药物浓度影响。MH-M-SAIB 里的药物大部分位于微球内部以及表面,溶解于SAIB贮库中的药物浓度较低,并且药物从SAIB 释放出来扩散路径较长;而MH-SAIB所含药物仅位于SAIB 贮库内部以及表面,溶解于SAIB 贮库中的药物浓度较高,并且药物从SAIB 释放出来的扩散路径较短,从而导致MH-SAIB 较MH-M-SAIB更快释放[31]。

Figure 5 Porosity of MH-M-SAIB and MH-SAIB(xˉ± s,n = 3)
4 结 论
本实验通过静电喷雾的方法,成功制备表面光滑,尺寸分布均匀的盐酸米诺环素PLGA 微球,并将其与SAIB混合成功制备盐酸米诺环素微球贮库。同时,研究结果表明,盐酸米诺环素微球贮库能显著降低药物的突释,达到持续稳定的长期释放,为后续进一步研究盐酸米诺环素微球贮库的成骨效果及抑菌实验奠定了基础。
