脱驯化时长对烟草幼苗抗旱性的影响
2021-03-13张璐翔陈思蒙郑聪金伊楠韩艺许自成黄五星邵惠芳
张璐翔, 陈思蒙, 郑聪, 金伊楠, 韩艺, 许自成, 黄五星, 邵惠芳*
(1.河南农业大学烟草学院, 郑州 450002; 2.福建省烟草公司南平市公司, 福建 南平 354300; 3.河南省灵宝市五亩乡农业服务中心, 河南 灵宝 472500)
大量研究及气象观测发现,气候变化使得干旱这一世界性难题愈发严重[1]。正如人体通过锻炼来增强身体机能,为适应日益加剧的干旱环境,植物能够在干旱驯化中逐步提高自身抵御干旱胁迫的能力。有研究表明,经历驯化的植株抗逆性、成活率及多种胁迫相关的基因表达都会显著升高[2-3]。此前已有大量关于干旱及复水相关的研究,但多集中在多次驯化及复水对植株抗逆性的影响方面。随着气候变化的加剧,温度及降水随季节变化的规律愈发模糊,生长在自然环境中的植物面临干旱胁迫的情况愈发普遍,而通过适宜锻炼提升植物抗逆性逐渐进入研究者的视线。
干旱后复水导致植物抗旱性逐渐降低的过程被称为脱驯化。与驯化过程需要较长时间不同,脱驯化通常在较短时间内就会产生[4]。因此,即使短暂的脱驯化也会对驯化效果产生较大影响。植株在经历适宜时长的干旱驯化后及时复水能够恢复正常生长,而长时间的干旱将会对植株产生不可逆的负面影响[5]。在低温驯化中也有类似的研究结果[6]。因此掌握适宜的驯化及脱驯化时长是保证驯化效果的关键。
干旱胁迫产生后恢复正常水分供给对作物提升水分利用率、光合效率、气孔导度及作物产量品质等方面有显著影响[7-9],而关于恢复正常水分供给的时长对干旱驯化效果的影响却鲜有报道。随着气象学的发展,对未来短时间内干旱状况的预测愈发准确。为防止干旱对作物产生不利影响,在播种或移栽前对植物进行适当的干旱驯化是十分必要的,而如何保证或优化锻炼效果,目前仍然不知。为探究脱驯化时长对植株抗逆性的影响,本研究以模式植物烟草为研究对象,以脱驯化时长为变量,将驯化、脱驯化和再驯化三者相结合。将经历不同时长脱驯化的烟草幼苗移入干旱环境进行再驯化后,测定烟草幼苗光合色素含量、渗透调节物质含量、根系活力、抗氧化酶活性、丙二醛(malondialdehyde,MDA)含量等指标来探究不同脱驯化时长对植株抗逆性的影响。
1 材料与方法
1.1 供试材料
选取广泛种植的烟草品种‘K326’作为试验材料,由河南农业大学烟草学院育种实验室提供。
1.2 试验设计
试验采取水培法,驯化过程包括驯化—脱驯化—再驯化三个阶段。设置0(CK)、24(D1)、48(D2)、72(D3)h 4个脱驯化时间处理,各处理的驯化和再驯化处理一致,以正常培养作为处理N,5个处理具体试验设计见表1。

表1 试验设计Table 1 Experiment designation
试验于2018年5—9月在河南农业大学品质生态实验室人工气候室内进行。光照强度为400 μmol·m-2·s-1,昼/夜温度28/18 ℃,昼/夜时长14/10 h,湿度70%±5%。试验用种子以10%过氧化氢消毒10 min,超纯水冲洗并浸种8 h,随后于育苗海绵上发芽。试验所用Hoagland营养液为实验室自配[10]。待烟苗长至4片叶时,选取长势一致的幼苗,移至装有蛭石的1.5 L黑色塑料盆并用1/2 Hoagland营养液浇灌,每3 d换1次培养液。待长至4片真叶时移至盛有Hoagland营养液的5 L水培盒中,每3 d换一次营养液,在更换营养液后第2 d对盒中营养液通氧。预培养3 d,选取长势一致的烟苗进行处理。
干旱处理时,使用质量体积比为10%的聚乙二醇(PEG-6000,天津市科密欧化学试剂有限公司)模拟干旱环境,培养液水势约为-0.15 MPa,属轻度干旱。除脱驯化时长外,其余条件均保持不变。为避免光照对试验的影响,设置每日7:00—21:00为人工气候室光照时间。
1.3 检测指标及方法
同一处理不同植株为1个重复,每个处理设置3次重复。干旱处理72 h后自上而下取完全展开的第2、3片叶混合作为取样样品。取样时迅速取下烟草叶片冷冻于液氮中,移入-80 ℃超低温冰箱保存。参照李合生等[11]方法测定叶片叶绿素、类胡萝卜素含量;采用氯化三苯基四氮唑(TTC)法[11]测定植株根系活力;分别采用氮蓝四唑光还原法[12]、愈创木酚法[13]测定超氧化物歧化酶(superoxide dismutase,SOD)活性及过氧化物酶(peroxidase,POD)活性;采用氮蓝四唑(nitro-blue tetrazolium, NBT)染色法[14]、二氨基联苯胺(3, 3-diaminobenzidine, DAB)染色法[15]定位叶片· O2-及H2O2;分别采用硫酸蒽酮比色法[11]、酸性茚三酮法[16]、考马斯亮蓝G-250法[11]测定可溶性糖含量、脯氨酸(proline, Pro)含量及可溶性蛋白含量;MDA含量测定参照陈建勋等[17]方法。
以上各指标均采用Spark多功能微孔板检测仪(瑞士TECAN公司),按照使用说明及试验设定相应参数进行检测。
1.4 数据统计与分析
采用Microsoft Excel 2013初步整理各项数据,并使用DPS 7.05通过最小差异显著法(LSD)进行差异显著性分析。
2 结果与分析
2.1 不同脱驯化时长对烟草幼苗光合色素含量的影响
不同处理的光合色素含量结果(图1)显示,除空白对照(N)外,各脱驯化处理中D2处理的总叶绿素含量最高,类胡萝卜素含量则在D1处理中达到峰值,含量稍低于处理N且差异不显著。总体上,总叶绿素和类胡萝卜素含量均随脱驯化时间延长呈现先上升后下降的变化趋势。经历驯化处理的植株总叶绿素含量均显著高于CK,D1、D2、D3分别较CK上升120.65%、158.15%和113.95%,但3个处理间差异不显著。而类胡萝卜素含量则在D1处理中最高,且随脱驯化时间延长,类胡萝卜素含量呈现出明显的先上升后下降的变化趋势。处理D1、D2、D3相较CK类胡萝卜素含量分别上升71.16%、34.05%和25.56%。说明驯化后的脱驯化时间能够影响烟草植株的光合色素含量。

注:不同小写字母表示同一指标不同处理间差异在P<0.05水平具有显著性。Note:Different small letters of the same index indicate significant difference among treatments at P<0.05 level.图1 不同处理的烟株幼苗光合色素含量Fig.1 Photosynthetic pigment contents of tobacco seedlings under different treatments
2.2 不同脱驯化时长对烟草幼苗根系活力的影响
干旱胁迫除导致叶片萎蔫外,还能提升植株根系活力以增强植株吸取土壤水分的能力。因此,根系活力的强弱是直观反映植株抗旱性的重要指标之一[18]。根系活力测定结果(图2)可见,根系活力随脱驯化时间延长呈先升高后降低的趋势,在脱驯化48 h处理(D2)中达到峰值后下降。经历脱驯化的幼苗根系活力显著高于CK,D1、D2、D3处理较CK的根系活力分别上升120.60%、132.90%和86.30%。
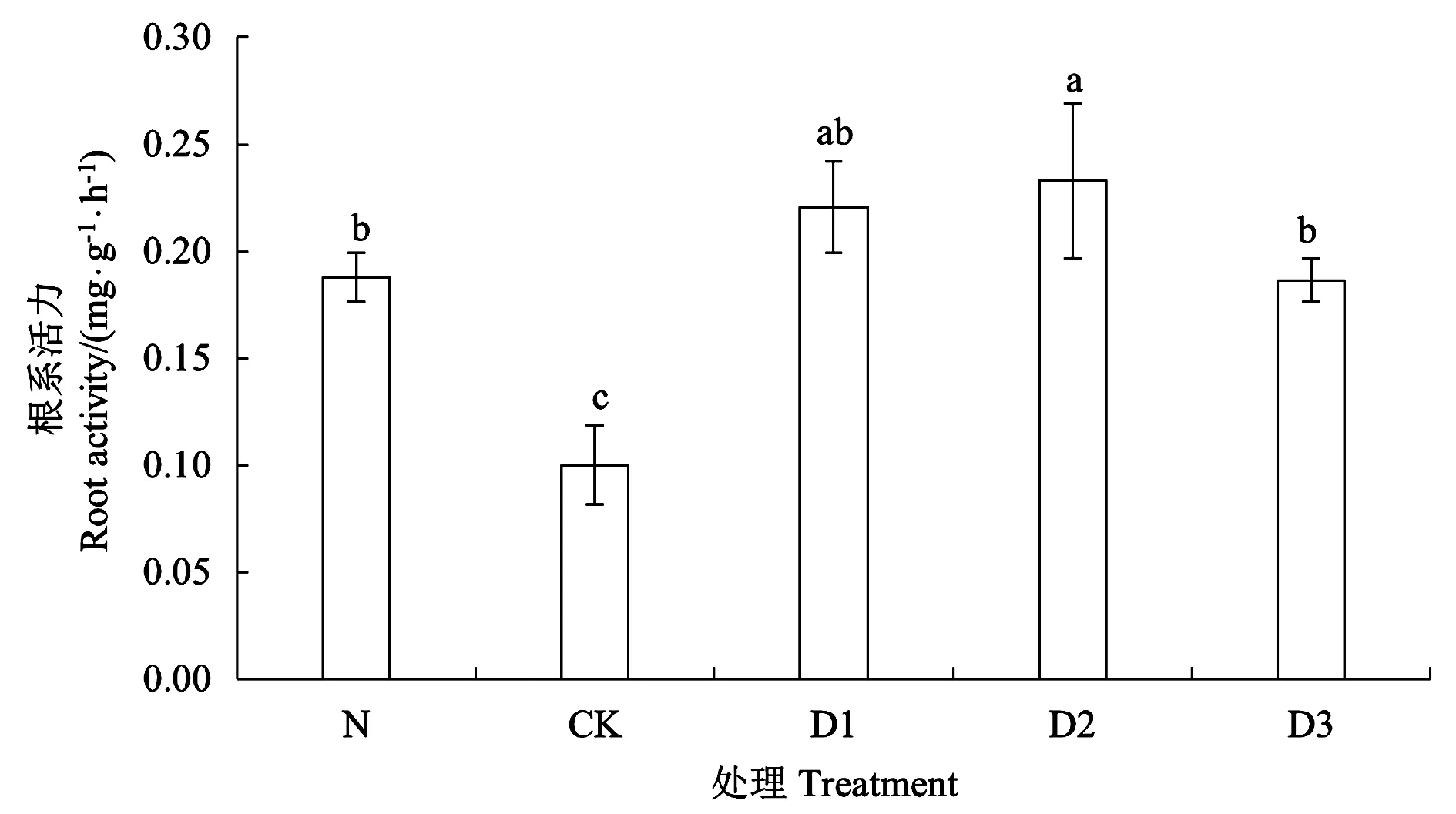
注:不同小写字母表示不同处理间差异在P<0.05水平具有显著性。Note:Different small letters indicate significant difference among treatments at P<0.05 level.图2 不同处理的烟株幼苗根系活力Fig.2 Root activities of tobacco seedlings under different treatments
2.3 不同脱驯化时长对烟草幼苗渗透调节物质的影响
植株通过累积渗透调节物质来应对逆境胁迫。逆境胁迫条件下,可溶性糖在叶片中的积累大于茎和根[19],因此叶片中可溶性糖含量可以用于表征植物对胁迫的响应。由表2可知,烟草叶片可溶性糖含量随脱驯化时间延长而降低,D1、D2、D3处理的叶片可溶性糖含量分别较CK显著下降44.94%、67.26%和81.53%。脯氨酸含量常与植物的逆境胁迫程度呈正相关[20-21]。CK处理相较N处理脯氨酸含量上升,表明干旱胁迫诱导烟叶中脯氨酸累积,24 h的脱驯化处理(D1)使得烟株脯氨酸含量显著升高,但脱驯化时间延长处理(D2、D3)的脯氨酸含量显著下降,平均降幅为59.34%。CK处理的可溶性蛋白含量较N处理显著升高,其随脱驯化时长有明显的先降低再升高的趋势,D2处理达到最小值,相较CK下降69.98%,与N处理差异不显著,但D3处理的可溶性蛋白含量又升高,达到与CK类似水平。

表2 不同处理的烟株幼苗渗透调节物质含量Table 2 Osmoregulation substance contents of tobacco seedlings under different treatments
2.4 不同脱驯化时长对烟草幼苗抗氧化酶活性的影响
SOD通过清除细胞内多余的超氧根阴离子(·O2-),从而使得细胞免受逆境导致的氧化损伤。SOD催化产物H2O2等则主要通过POD清除[22]。SOD及POD活性测定结果见图3,可见,SOD和POD活性均随脱驯化时间增长,呈先上升后下降的趋势。SOD和POD酶活性在D2处理中达到峰值,且与处理N无显著差异,但相较CK分别显著升高40.02%、85.74%。D1、D3处理酶活性与CK差异不显著。NBT可以将细胞内的· O2-染成蓝色,DAB则与叶片中的H2O2反应呈现红褐色,以此直观地显示叶片活性氧含量并反映抗氧化酶活性。NBT染色结果(图4)表明,各处理着色情况与酶活性检测结果具有良好的反向一致性。
2.5 不同脱驯化时长对烟草幼苗MDA含量的影响
非生物胁迫会导致植株产生氧化应激反应从而导致叶片MDA含量升高。由图5可知,烟草幼苗MDA含量随脱驯化时长呈先降低后升高的变化趋势。叶片MDA含量以D2处理最低,比处理CK和D1分别显著下降79.91%和77.78%,与N处理的幼苗MDA含量无显著差异。并且MDA含量与抗氧化酶活性有相反的变化趋势。
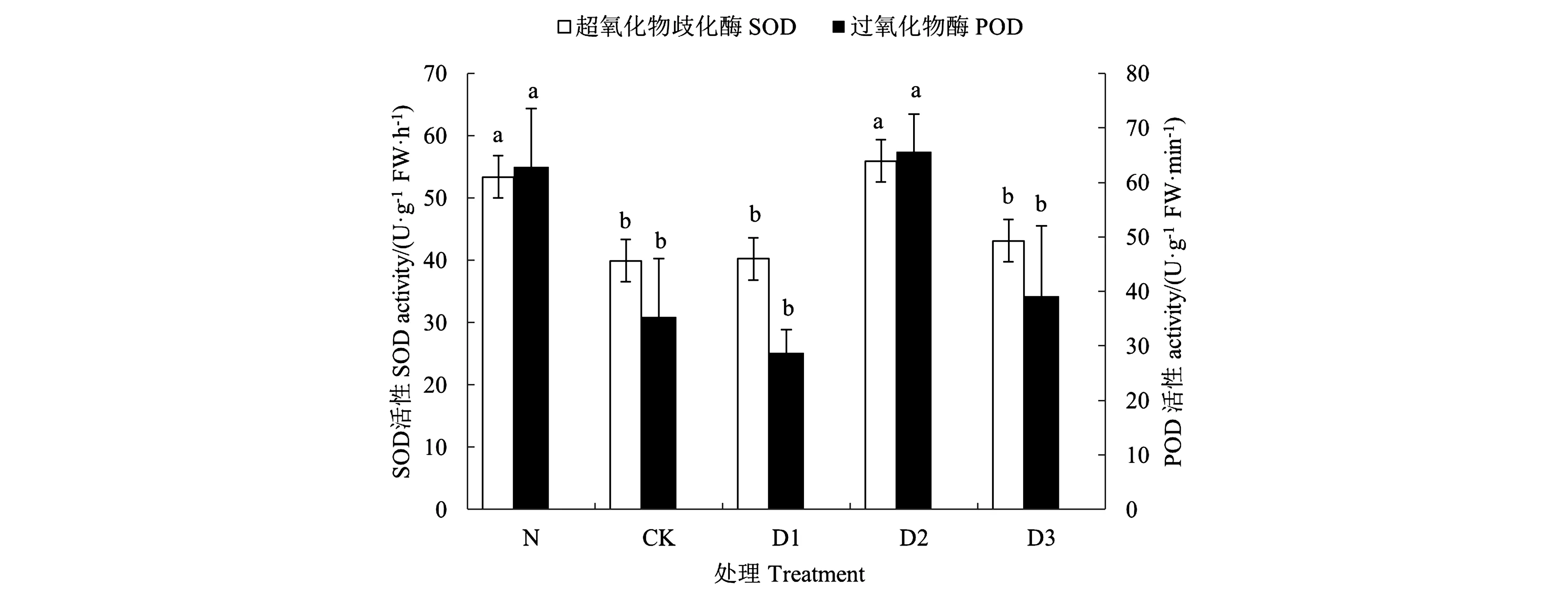
注:不同小写字母表示同一指标不同处理间差异在P<0.05水平具有显著性。Note:Different small letters of the same index indicate significant difference among treatments at P<0.05 level.图3 不同处理烟株幼苗的SOD和POD活性Fig.3 SOD and POD activities of tobacco seedlings under different treatments

图4 不同处理的NBT和DAB染色叶片Fig.4 Dyed leaves by NBT and DAB under different treatments
3 讨论
若植物一直处于干旱环境中则发生持续的干旱胁迫,只有给予一定周期的正常生长环境后植物再次接触逆境才能验证驯化的效果。对日本白桦树(Betulaplatyphyllavar.japonica)研究表明,脱驯化环境差异越大,时间越长,植物再次受到胁迫时的损伤程度越严重[23]。本研究将0~72 h的脱驯化分为4个时间点,发现D3处理与CK处理差异不显著,D2处理再次经历干旱时各生理指标能够基本达到N处理水平,表明脱驯化对植株抗旱性有促进效果。
逆境胁迫程度的加深常伴随植株叶绿素含量的降低[24-26]。类胡萝卜素具有保护叶绿素免受非生物胁迫伤害的作用[27-28]。本研究结果显示,脱驯化时长能够影响植株的光合色素含量。48 h的脱驯化会使干旱胁迫下烟草叶片维持较高水平的叶绿素及类胡萝卜素含量,使光合作用正常进行,避免过剩光能造成的损害[29]。
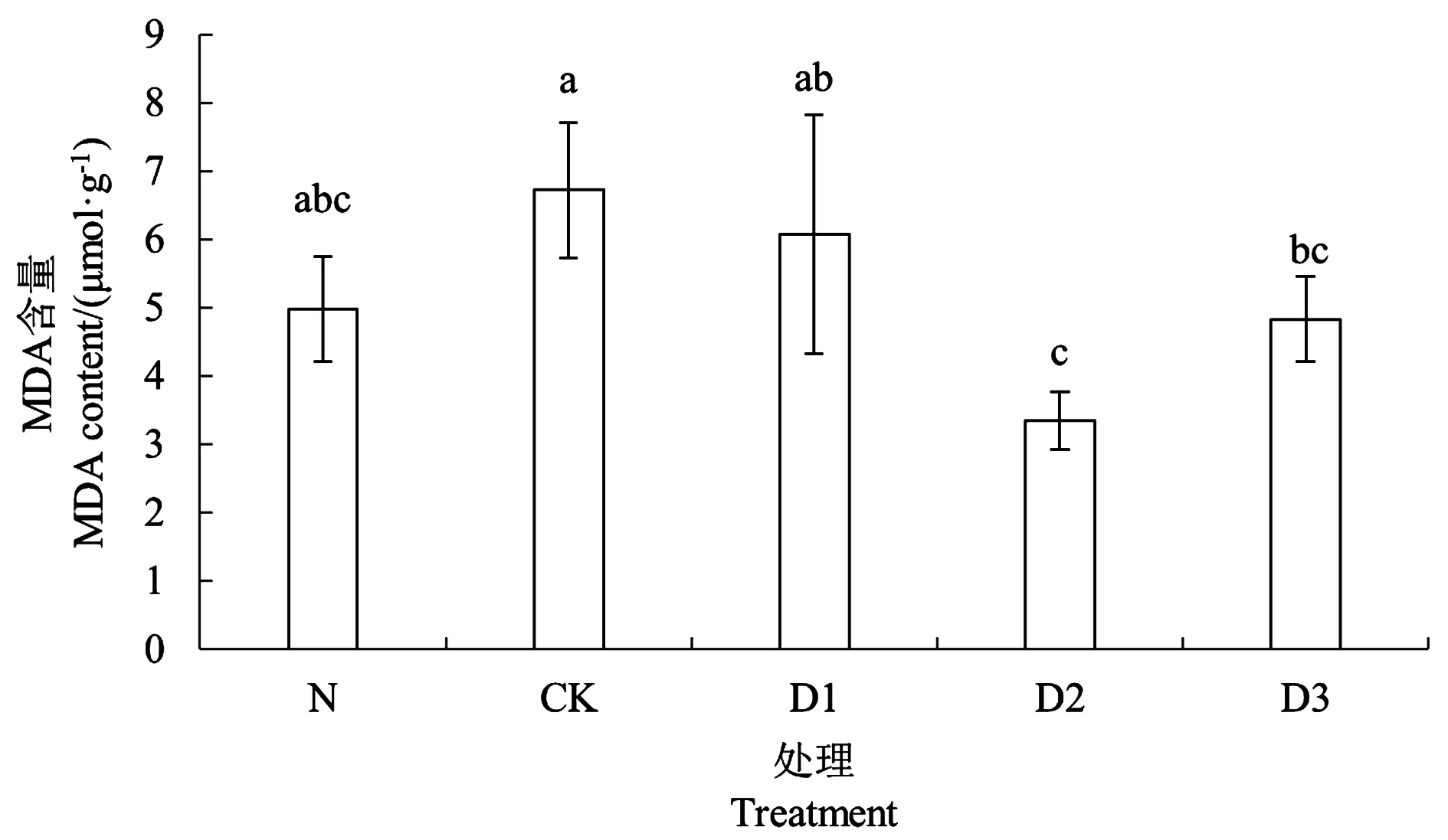
注:不同小写字母表示不同处理间在P<0.05水平具有显著性。Note:Different small letters indicate significant difference among treatments at P<0.05 level.图5 不同处理的烟株幼苗MDA含量Fig.5 MDA content of tobacco seedlings under different treatments
根系吸收外界营养物质的能力由根系活力反映[30],适度的干旱胁迫能够刺激根系生长,从而提升植株根系活力[31]。经历不同时长脱驯化的植株幼苗根系活力有先升后降的趋势,48 h脱驯化使得根系活力有显著的提升。证明适宜时长的脱驯化是确保驯化效果的关键。
可溶性糖是重要的渗透调节物质,并通过糖代谢作为各种生理生化反应的能量来源或前体物质[19]。脯氨酸含量通常报道与植物抗逆性之间存在相关性,但是相关关系尚不统一[32-33]。可溶性蛋白含量是衡量逆境胁迫中蛋白质受损程度的重要因素[34]。本研究发现,可溶性糖及脯氨酸含量随脱驯化时间延长有下降的趋势,表明植株渗透调节平衡未被破坏,但短时间内快速改变生长环境会引起植物生长代谢紊乱。可溶性蛋白含量随脱驯化时长有明显的先升高后降低再升高的趋势,表明干旱会促使植物合成适应逆境的蛋白质,而长时间的脱驯化会造成驯化效果减弱,从而导致植株再次进入胁迫环境后可溶性蛋白含量上升[35]。

综上所述,驯化可以类比为人体接种疫苗来获得对某种疾病抵抗力的过程,将脱驯化比作为获得性免疫免疫力上升的过程,将再驯化比作免疫作用下降需要补种疫苗的过程。众所周知,人体具有免疫记忆能力[41]。已有研究表明,拟南芥关键酶基因P5CS1的转录表达在再次响应盐胁迫时具有“记忆”功能[42]。因此推测,植物响应干旱胁迫也有类似机制,并能够通过驯化—脱驯化相结合的方式锻炼这种“记忆”能力,从而可以遵从“绿色农业”的理念,在自然状态下提升植株抗逆性而不依靠人工施用外源添加剂。
