耐辐射异常球菌黄嘌呤脱氢酶在氧化胁迫反应中的作用
2021-03-12陈晓楠高丽华周正富张维陈明
陈晓楠, 高丽华, 周正富, 张维, 陈明
(中国农业科学院生物技术研究所, 北京 100081)
众所周知,过渡元素钼是植物、动物和微生物的必需营养素。海洋中大量的钼以阴离子形式存在。土壤中,钼酸盐阴离子是植物和细菌唯一可利用的钼形态。钼酶在生物地球化学氧化还原循环以及有机体代谢中具有关键作用[1],根据钼中心剩余配体的不同,钼酶可分为AOR/XDH家族、亚硫酸盐氧化酶家族和二甲基亚砜还原酶家族。同一钼酶家族成员间具有明显的序列相似性,不同家族成员间没有明显的同源性[2]。此类酶可在各种生理条件下以不同氧化态存在,具有多种功能,但都涉及氧化或还原反应。
黄嘌呤脱氢酶(EC 1.17.1.4, xanthine dehydrogenase,XDH)是一种古老、典型、复杂的钼酶,已有100多年的研究历史,是迄今为止被研究得最深入的单核钼酶,也是目前发现的四种钼酶之一[3-4]。该酶催化次黄嘌呤氧化为黄嘌呤,黄嘌呤经氧化为尿酸。此外,XDH还能催化杂环化合物嘌呤、喋呤和醛sp2杂环上碳原子的羟基化反应[5]。XDH由3个氧化还原中心结构域组成:铁硫簇([2Fe-2S])、黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)和硫化钼辅因子(molybdenum cofactor,Moco)。XDH的三个氧化还原中心构成一个内电子转移链(electron transport chain,ETC),在硫化钼辅因子中心发生催化作用时,从底物中提取电子,然后转移到铁硫团簇的FAD上,最后转移到电子受体NAD+上形成NADH。在电子还原反应中,反应体系的完整性必不可少[6]。XDH广泛分布在真核生物、细菌和古细菌中,并且在各种细胞过程中发挥重要作用,参与嘌呤代谢,催化黄嘌呤和次黄嘌呤生成酰脲类物质,且与氮同化、激素代谢、衰老的调控及活性氧产生等过程相关。
1902年,Schardinger[3]首次证明新鲜牛奶XDH可氧化甲醛,开启了XDH结构和功能的研究。1960年,Bradshaw和Barker[7]首次从梭状芽胞杆菌中纯化出细菌中XDH,随着基因组测序技术的发展,越来越多XDH被发现[8-11]。但仅对少量的XDH进行了功能研究,如在固氮菌苜蓿中华根瘤菌中发现了与饥饿相关的XDH,在天蓝色链霉菌中发现了在应激反应过程中维持GTP稳态的XDH等[12-13]。至今,仍有很多XDH尚未被鉴定,它们的生理功能不详。
耐辐射异常球菌(D.radioduransR1)是目前已知物种中辐射、氧化抗性较强的生物[14-16]。D.radioduransR1基因组分析显示,该菌含有完整的黄嘌呤脱氢酶基因簇,即铁硫簇([2Fe-2S])编码基因DR_A0233(xdhA)、黄素腺嘌呤二核苷酸(FAD)编码基因DR_A0232(xdhB)和硫化钼辅因子(Moco)编码基因DR_A0231(xdhC)。已报道的黄嘌呤脱氢酶均涉及氧化或还原反应,因此,推测D.radioduransR1黄嘌呤脱氢酶在氧化胁迫抗性过程中发挥重要作用。本研究构建了黄嘌呤脱氢酶铁硫亚基编码基因xdhA的缺失突变株(ΔxdhA),分析其在氧化胁迫条件下的表达情况,以及菌株的生存率和总抗氧化能力,探索黄嘌呤脱氢酶在氧化胁迫反应中的功能,为充分了解耐辐射异常球菌氧化胁迫抗性及其机制奠定基础。
1 材料与方法
1.1 试验材料
1.1.1菌株及培养条件 耐辐射异常球菌R1野生型由本实验室保存;高频转化受体菌株大肠杆菌E.coliTop10购自康为世纪公司;pRADZ3质粒由本实验室保存。
大肠杆菌用LB培养基(10 g·L-1胰蛋白胨、5 g·L-1酵母提取物、10 g·L-1氯化钠,固体培养基含15 g·L-1琼脂)在37 ℃下培养;耐辐射异常球菌用TGY培养基(10 g·L-1胰蛋白胨、5 g·L-1酵母提取物、1 g·L-1葡萄糖,固体培养基含15 g·L-1琼脂)在30 ℃下培养。突变株在含有卡那霉素(Km)的TGY培养基中培养。抗生素卡那霉素(Km)和氯霉素(Cm)终浓度分别为50 μg·mL-1和17 μg·mL-1。
1.1.2主要试剂 T4-DNA连接酶及限制性内切酶购自NEB公司,RNA消化反转录试剂盒购自TaKaRa公司,琼脂糖凝胶DNA回收试剂盒购自Magen公司,Taq酶及SYBR Green Mix购自Vazyme公司,质粒提取试剂盒购自Magen公司,RNA提取试剂盒购自Analytik Jena公司。总抗氧化能力检测由碧云天公司完成。基因测序及引物(表1)合成均由华大基因完成。

表1 PCR扩增所用引物
1.2 试验方法
1.2.1xdhA基因的生物信息学分析 从NCBI数据库获得D.radioduransR1的xdhA基因(NC_001264.1)及蛋白(Q9RYS5)序列信息;使用KEGG数据库(https://www.kegg.jp/)查看并分析xdhA基因参与调控的代谢途径及发挥功能的相关基因;利用Blastp(https://blast.ncbi.nlm.nih.gov/Blast.cgi)以及Uniprot(https://www.uniprot.org/)数据库在线比对与XdhA蛋白相似性较高且已确定功能的蛋白,初步判断该蛋白所属的家族及其生理功能。
1.2.2缺失突变株和回补株构建 构建各菌株所需引物如表1所示。根据xdhA及其上下游序列、pKatAPH3以及pRADZ3载体序列设计所用引物,同时利用DNAMAN软件分析xdhA及pRADZ3内存在的酶切位点。
采用融合PCR法构建xdhA缺失突变株:以D.radioduransR1基因组DNA为模板,利用引物xdhA-U-F/R扩增xdhA上游序列xdhA-U(304 bp);利用引物xdhA-D-F/R扩增xdhA下游序列xdhA-D(350 bp)。以pKatAPH3质粒为模板,利用引物Km-F/R扩增抗性盒序列Km(920 bp)。将扩增产物分别回收纯化后进行融合PCR,以等摩尔质量的三个片段为模板,利用引物xdhA-U-F和xdhA-D-R进行扩增,得到融合片段UKD。融合PCR反应体系:2×Mix 25 μL,模板xdhA-U 2 μL,模板Km 2 μL,模板xdhA-D 2 μL,引物xdhA-U-F和xdhA-D-R各1 μL,ddH2O 17 μL。融合PCR反应程序:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 40 s,72 ℃ 2 min,10个循环;暂停,冰上添加引物,反应继续;96 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,25个循环;72 ℃ 10 min,10 ℃保温。纯化后的融合片段转化野生型D.radioduransR1,用含Km的抗性培养基进行筛选,随后进行PCR验证。以突变株基因组为模板,利用引物YZ-F/R,Km-F/R分别扩增融合片段和Km抗性盒片段,同时设置野生型D.radioduransR1基因组为对照。
采用质粒回补的方式构建回补株cmxdhA:以D.radioduransR1基因组为模板,利用引物xdh-SpeI-F、xdh-BamHI-R扩增xdhABC基因簇Pcm(3 820 bp),回收纯化后进行酶切连接,构建重组载体Pcm-Z3,转化大肠杆菌进行富集,随后将从大肠杆菌中提取的质粒转化xdhA缺失突变株。用含Km、Cm的抗性平板进行筛选,并进行PCR验证。以回补株基因组DNA为模板,利用引物Z3-F/R、xdhA-F/R以及Km-F/R(表1)扩增片段,同时设置野生型D.radioduransR1基因组和突变株ΔxdhA基因组作为对照。得到回补株,命名为cmxdh。
1.2.3荧光定量PCR 生长到稳定期的野生型菌株D.radioduransR1转接到新鲜的200 mL TGY液体培养基中,初始OD600为0.1,30 ℃、220 r·min-1培养至对数初期(OD600=0.6~0.8)。菌液中加入相应体积的30% H2O2,使其终浓度为80 mmol·L-1,避光处理30 min。将菌液转移到无菌的50 mL离心管中,4 ℃、6 000 r·min-1离心10 min收集菌体,PBS(0.24 g·L-1KH2PO4,1.44 g·L-1Na2HPO4,8 g·L-1NaCl,0.2 g·L-1KCl,pH 7.4)洗涤菌体。随后将菌体用等体积新鲜的TGY培养基重悬,30 ℃、220 r·min-1孵育,每隔1 h收集菌体。
为分析xdhA基因缺失对氧化胁迫抗性相关基因表达的影响,依照上述方法处理D.radioduransR1、ΔxdhA菌株,同时设置不添加H2O2的对照。4 ℃、6 000 r·min-1离心10 min收集菌体,利用试剂盒提取总RNA,消化反转为cDNA,利用实时荧光定量PCR,对氧化胁迫条件下基因表达情况进行分析。
1.2.4腺嘌呤及甲醛毒性检测 将活化野生型D.radioduransR1及突变株ΔxdhA分别按照OD600为0.1转接到加入相应抗性的20 mL新鲜TGY培养基中,30 ℃、220 r·min-1震荡培养至稳定期。将菌液转移至50 mL无菌离心管中,4 ℃、6 000 r·min-1离心10 min收集菌体;随后用PBS洗涤菌体(两次)。用基本培养基重悬菌体,按照OD600为0.1将菌悬液转接到基本培养基或添加0.1%腺嘌呤的基本培养基中(每个样品设置三个重复),使得初始OD600为0.1。30 ℃、220 r·min-1震荡培养,每隔2 h取样,测定OD600值。
检测甲醛毒性的过程与检测腺嘌呤毒性的过程相似,用PBS洗涤菌体后,用20 mL 0.1×TGY重悬。按OD600为0.1将菌悬液转接到0.1×TGY或添加甲醛(400 μmol·L-1)的0.1×TGY中,用芬兰BioScreenC全自动生长曲线分析仪(Oy Growth Curves Ab Ltd)对其生长趋势进行测定,每个样品设置4个重复。
1.2.5菌株生存能力及总抗氧化能力测定 培养到稳定期的野生型D.radioduransR1、突变株ΔxdhA、回补株cmxdh按OD600为0.1分别转接到新鲜无抗生素的100 mL TGY液体培养基中,待其生长到对数初期(OD600=0.6~0.8)进行能力测定。①菌株生存能力:分别取1 mL菌液,4 000 r·min-1离心5 min收集菌体,随后用1 mL PBS重悬。避光条件下,分别加入相应体积的30% H2O2,使其终浓度为60 mmol·L-1。30 ℃、220 r·min-1避光处理30 min。设置不添加H2O2溶液的CK组作为对照。处理后的菌液进行倍比稀释(100 μL菌液+900 μL 1×PBS),至10-5。充分混匀,每个梯度取菌液8 μL,按顺序点在TGY固体培养基上,每个样品平行三次,30 ℃、220 r·min-1倒置培养2~3 d后对比生长状况,判断菌株的生存能力。②总抗氧化能力测定:避光条件下,分别加入相应体积的30% H2O2使其终浓度分别为80 mmol·L-1。设置不添加H2O2溶液的CK组作为对照。30 ℃、220 r·min-1避光处理30 min后4 ℃离心收集菌体。收集的菌体用5 mL PBS重悬,随后利用超声细胞破碎仪进行细胞破碎,直至溶液澄清。离心除去残渣,回收上清,考马斯亮蓝法[17]测定上清中总蛋白浓度。
1.2.6数据分析 相关数据用Microsoft Excel 2016进行数据分析;用GraphPad Prism 8软件作图。
2 结果分析
2.1 xdhABC基因簇组成分析和鉴定
KEGG结果显示,xdhABC基因簇(DR_A0233、DR_A0232、DR_A0231)编码功能性XDH。Blast与Uniprot在线预测结果显示,XdhC蛋白与天蓝色链霉菌XDH蛋白钼结合亚基具有53%的相似性(41%),XdhB蛋白与黄素腺嘌呤二核苷酸(FAD)结合亚基具有60%的相似性(51%),XdhA蛋白与[2Fe-2S]结合亚基具有71%的相似性(58%)。预测结果显示,xdhABC基因簇编码功能性黄嘌呤脱氢酶。
利用在线工具Biocy对三个基因间关系进行分析,预测xdhABC三个基因位于同一操纵子,为确认三者间存在共转录关系,以野生型D.radioduransR1基因组及cDNA为模板,设计跨基因引物对xdhA、xdhB和xdhB、xdhC间序列进行扩增,结果(图1B)显示,在不同模板中两段序列都能扩增出来,表明xdhA与xdhB、xdhC三个基因间存在共转录关系。

注:黑色方框表明与参考基因的相似性在70%以上,灰色的方框表示与参考基因的相似性为50%~60%。M为Trans2K Plus Ⅱ marker;甬道1、4、7: D.radiodurans R1基因组为模板;甬道2、5、8: D.radiodurans R1 cDNA为模板;甬道1、2: 验证xdhB、xdhC间是否共转录;甬道3、6:阴性对照,以H2O为模板;甬道4、5:阴性对照;甬道7、8:验证xdhB、xdhA间是否共转录。
2.2 xdhA基因的生物信息学分析
进一步对同一操纵子xdhABC的三个基因的转录表达进行分析,结果表明,野生型菌株D.radioduransR1中xdhABC相对表达量无明显差异,ΔxdhA菌株中,xdhBC几乎不表达(图 2),由于xdhA片段被Km抗性盒替换,而Km抗性盒上游启动子的转录方向与xdhABC的转录方向相反,从而造成xdhBC基因簇均无表达。因此,敲除xdhA基因,导致xdhABC基因簇不能表达,即ΔxdhA菌株不能形成XdhABC蛋白。

图2 xdhABC基因簇相对表达量
采用质粒回补的方法构建xdhA的回补株cmxdh,利用酶切连接的方法构建重组载体Pcm-Z3,该载体包含完整的xdhABC基因序列。Km抗性盒鉴定结果表明,在cmxdh基因组中存在Km抗性盒基因;载体上引物Z3-F/R扩增结果显示回补株cmxdh基因组中重组载体的存在。以上结果表明,带有目的片段的质粒已经成功转入ΔxdhA中,获得回补株cmxdh。
2.3 xdhA基因缺失菌株对腺嘌呤及甲醛敏感性分析
为研究xdhABC编码蛋白的功能,本研究尝试在大肠杆菌中表达该蛋白,并获得三条大小相符的蛋白带,但未能测定到相应酶活。由于黄嘌呤脱氢酶可催化嘌呤及简单醛类的降解,对醛类物质具有一定的解毒作用。因此,本研究通过体内实验来探究xdhABC编码蛋白的功能。结果(图3)表明,基本培养基中添加0.1%腺嘌呤时,菌株的生长明显受到抑制,野生型与突变株间具有差异;添加甲醛后ΔxdhA生存能力下降,16 h时到达稳定期,随后细胞逐渐死亡;而野生型D.radioduransR1生存能力较突变株强,32 h时到达稳定期。以上结果说明,xdhA缺失导致细菌对外源性腺嘌呤及甲醛的敏感性,该操纵子xdhABC编码蛋白参与嘌呤代谢及甲醛解毒过程,符合前面预测的结果,即xdhABC基因簇编码功能性黄嘌呤脱氢酶。
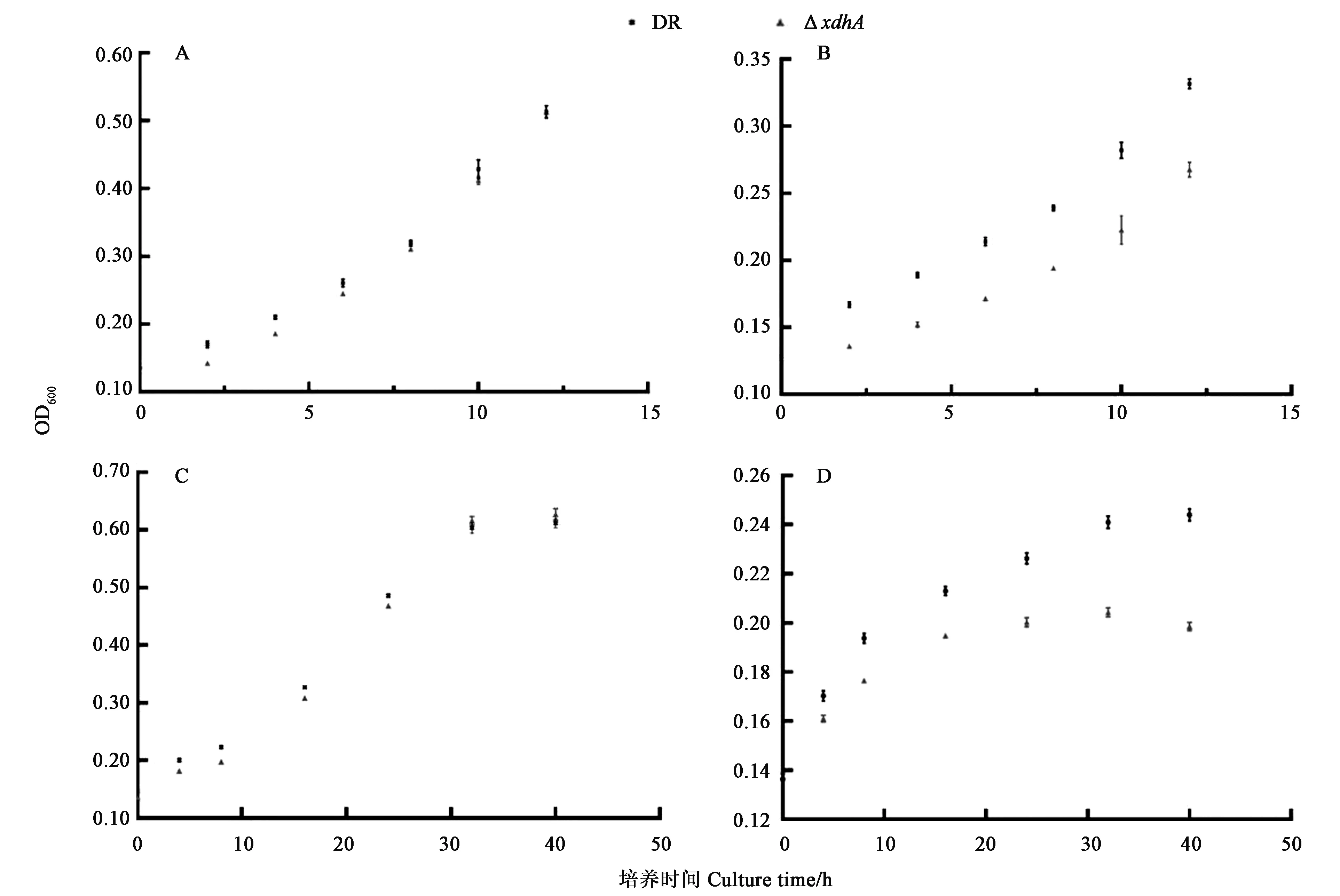
A:基本培养基中生长曲线;B:基本培养基添加腺嘌呤后生长曲线;C:0.1×TGY培养基中生长曲线;D:0.1×TGY培养基中添加400 μmol·L-1甲醛后生长曲线。
2.4 氧化胁迫条件下基因表达水平分析
非生物胁迫条件下目的基因的相对表达水平如图4所示,氧化处理孵育两小时xdhA的表达量达到最大,较未孵育前上调约7倍,随后降低至未孵育前的水平。表明xdhA基因的表达受到氧化胁迫条件的诱导。
过氧化氢酶、超氧化物歧化酶以及过氧化物酶等均在D.radioduransR1发挥氧化胁迫抗性中具有重要作用。上述结果表明,xdhA基因在D.radioduransR1的抗氧化机制中具有功能,参与氧化胁迫抗性相关基因表达情况(图4)表明,xdhA基因的缺失使得氧化胁迫相关基因的表达量发生不同程度的下调,转录调控因子DrRRA下调幅度较小。
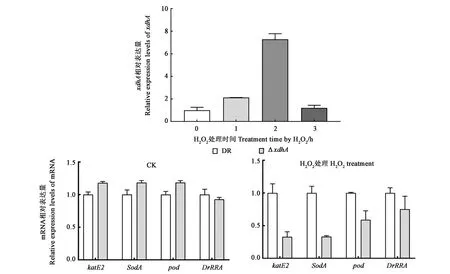
图4 H2O2处理30 min后不同孵育时间xdhA基因及氧化胁迫相关基因的表达情况
2.5 xdhA基因缺失菌株对氧化胁迫抗性分析
为研究氧化胁迫条件下XDH的功能,对野生型D.radioduransR1、突变株ΔxdhA、回补株cmxdh进行了H2O2冲击试验及总抗氧化能力测定实验。从图5可以看出,在正常培养条件下(不添加H2O2),D.radioduransR1、ΔxdhA、cmxdh生长保持一致;60 mmol·L-1H2O2处理30 min后,突变株ΔxdhA的氧化耐受能力较野生型D.radioduransR1减弱2个数量级,回补株cmxdh可以完全恢复突变株的氧化抗性。在未处理条件下,各菌株细胞内总抗氧化能力没有明显的差别;而经氧化处理后,野生型D.radioduransR1、突变株ΔxdhA以及回补株cmxdh菌体的总抗氧化能力均有所下降,其中突变株ΔxdhA总抗氧化能力明显减弱。
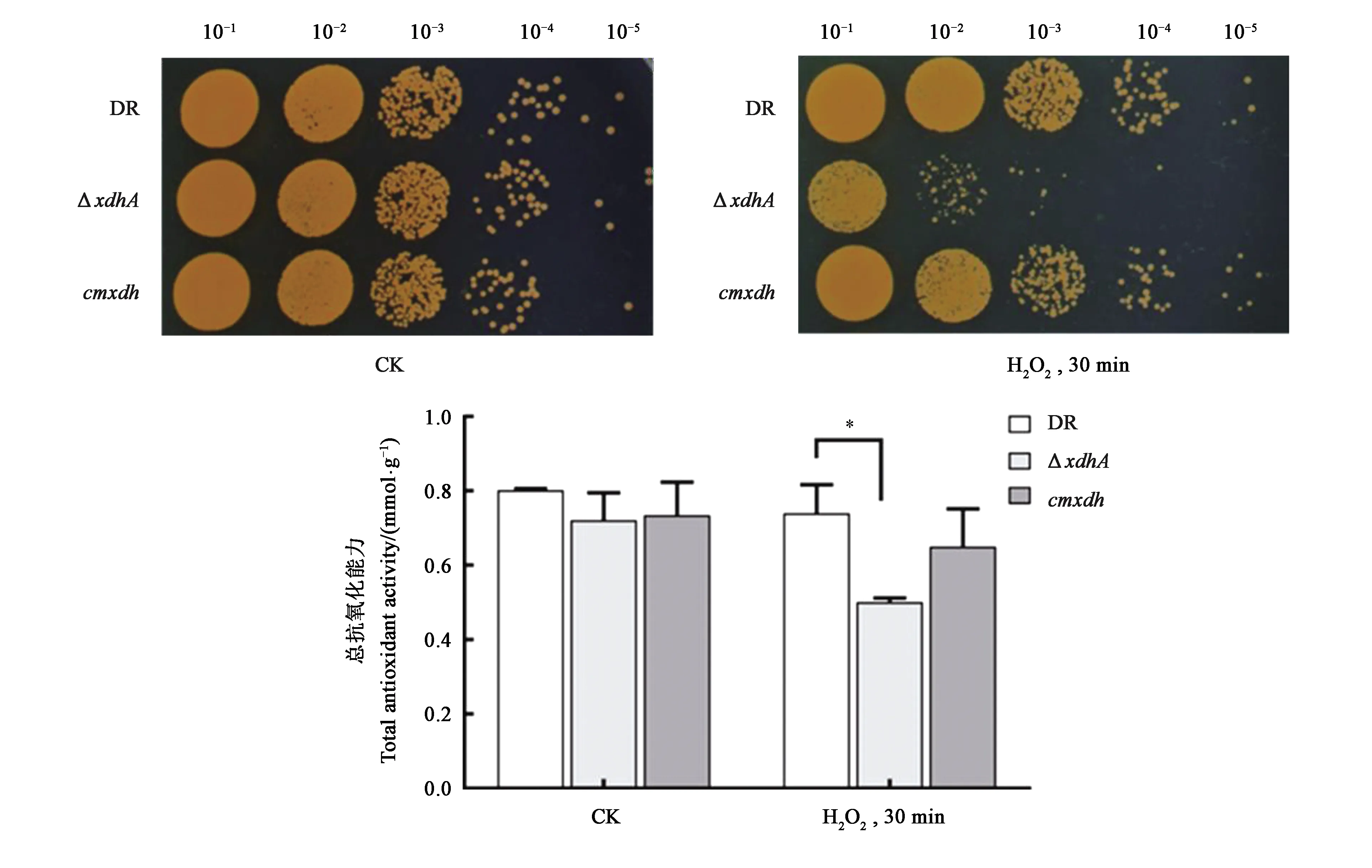
注:*表示差异显著(P<0.05)。
由此可见,xdhA基因缺失使得菌株对氧化胁迫更加敏感。表明xdhA基因的缺失使得细菌的氧化胁迫抗性减弱,推测黄嘌呤脱氢酶在D.radioduransR1超强氧化胁迫抗性机制中发挥重要作用。
3 讨论
Xi等[18]对大肠杆菌黄嘌呤脱氢酶功能研究表明,xdhA对于XDH产生活性是必要的。Moco中心产生的底物羟基化后产生的电子通过2Fe-2S到达FAD,随后在FAD位点将电子转移到NAD+形成NADH[19],电子传递过程需要整个电子传递链的完整性。本研究在进行回补株构建时发现,仅用xdhA基因进行回补时,不能恢复ΔxdhA氧化胁迫抗性,其细胞总抗氧化能力与ΔxdhA相当;而用含有完整的xdhABC基因进行回补ΔxdhA,能完全恢复突变株氧化胁迫抗性的表型,其细胞的总抗氧化能力与野生型菌株无差异。表明在耐辐射异常球菌中,xdhA是黄嘌呤脱氢酶活性所必需的,完整的xdhABC基因簇的产物共同构成一个完整的黄嘌呤脱氢酶,发挥其功能。
细菌黄嘌呤脱氢酶具有广泛的底物特异性,能够氧化各种嘌呤和醛类化合物。黄嘌呤转化为尿酸的反应是嘌呤分解代谢的第一步[18,20]。黄嘌呤脱氢酶缺失突变的菌株不能正常代谢嘌呤,使腺嘌呤合成鸟嘌呤核苷酸途径受阻,导致细胞对腺嘌呤产生敏感性[21]。醛类化合物对细胞具有毒害作用,包括化学损伤、对细胞糖酵解和发酵过程的直接抑制以及质膜损伤[20]。黄嘌呤脱氢酶能氧化醛类化合物,有效降低醛类化合物对细胞的毒害作用。本研究结果显示,xdhA基因缺失导致细菌对外源性腺嘌呤及甲醛的敏感性,表明基因xdhA编码的蛋白参与嘌呤代谢及甲醛解毒过程,其与xdhBC编码的蛋白组成的酶具有黄嘌呤脱氢酶的特性。
黄嘌呤脱氢酶是一种高度保守的管家酶,嘌呤类底物氧化产生的尿酸可作为ROS清除剂来维持氧化还原的稳态[22]。尿酸是一种高效的活性氧清除剂,可清除细胞内羟基自由基、超氧阴离子和单态氧,被认为是生物重要的抗氧化剂[23-24]。尿酸也可能有助于D.radioduransR1抵抗高水平氧化应激[25-26]。SOD暴露于H2O2时由于产生SOD-Cu-·OH而被灭活,生理水平的尿酸可以保持SOD酶的活性,阻止氧自由基的产生[24]。本研究结果显示,编码黄嘌呤脱氢酶铁硫亚基的xdhA基因的缺失导致菌株对腺嘌呤、甲醛及H2O2胁迫敏感,同时导致菌株细胞内总抗氧化能力下降。推测D.radioduransR1黄嘌呤脱氢酶通过嘌呤代谢途径产生尿酸抑制氧自由基形成,并维持SOD酶的活性,提高细胞氧化胁迫抗性。此外,转录分析结果显示,在氧化胁迫条件下,xdhA基因的缺失导致参与氧化胁迫反应重要的酶和转录因子,如过氧化氢酶基因(katE)、过氧化物酶基因(pod)及超氧化物歧化酶(sod)表达发生明显的下调,转录因子DrRRA表达量也有较小幅度的下调。xdhA基因产物是黄嘌呤脱氢酶氧化还原中心重要的组成部分,其缺失直接影响嘌呤代谢途径。同时xdhA基因缺失可能通过未知的途径间接地影响到氧化胁迫反应相关基因的表达,其作用机制尚需进一步研究。
