金黄色葡萄球菌SarA蛋白原核表达及免疫原性研究
2021-03-12杨雨晴吴赛男侯勤龙李咏梅韩慧明
程 旭,杨雨晴,吴赛男,侯勤龙,2,李咏梅,2,韩慧明,2
(1.北华大学基础医学院,吉林 吉林 132013;2.北华大学基础医学院感染与免疫研究中心,吉林 吉林 132013)
生物膜是细菌在宿主体内生存的一种形式[1],细菌生物膜的形成是导致长期感染的主要致病机制[2].有研究[3-4]表明:由金黄色葡萄球菌(金葡菌)导致的细菌生物膜感染逐年增多,而金葡菌生物膜的形成过程十分复杂,受众多基因及因子的共同调控[5].金葡菌生物膜的主要成分有多糖PIA(polysaccharide intercellular adhesion)、细菌表面分泌的细菌蛋白以及细胞外DNA[6].
在金葡菌中主要存在2类调控系统:一类是双组分调控系统(Two component regulatory system,TCRS)[7],另一类是葡萄球菌附属蛋白调控系统(SarA 蛋白家族类,Stapphylococcal accessory protein regulator)[8].SarA是SarA蛋白家族的第一个成员,该家族包括已经研究较为清楚的SarA、SarR、SarS、SarT、SarU以及功能尚不明确的SarV、SarX、SarY 和 SarZ[9].SarA是一种二聚体DNA结合蛋白,可与靶基因的启动子区域结合后发挥调控作用.有研究[10]发现:它在毒力基因调控系统中具有至关重要的作用,直接或间接调控的基因有120个,其中76个基因表达上调,44个基因表达下调.SarA不仅可以促进ica(intercellular adhesin locus)的转录,还能在不含有ica操纵子的条件下促进agr(accessory gene regulator)调节系统的表达,而agr系统可以减弱金葡菌形成生物膜的能力,所以,SarA可以影响生物膜的形成[6].除此之外,SarA还可以通过调节生物膜相关蛋白及纤连蛋白结合蛋白等表达,同样使细菌生物膜的形成能力减弱[11-12],目前,已研究出针对SarA设计的生物膜抑制剂[3,13].
1 材料与方法
1.1 试验材料
金黄色葡萄球菌菌种(ATCC 6538,中国普通微生物菌种保藏管理中心保存);质粒pET32a(+)(北华大学基础医学院实验室保存);大肠杆菌DH5α感受态(索莱宝生物技术有限公司);胰蛋白胨、酵母提取物、琼脂粉(Oxoid公司,英国)、氨苄西林(100 mg/mL)、卡那霉素(50 mg/mL)、基因组小提试剂盒、IPTG(Isopropyl-beta-D-thiogalactopyranoside)、SDS-PAGE凝胶配制试剂盒、弗氏(不)完全佐剂、限制性内切酶BamH I、XhoI(碧云天生物技术有限公司);凝胶回收试剂盒(天根生化科技有限公司);pEGM-T(promega)、HRP标记羊抗兔IgG(ABclonal,美国).
1.2 试验方法
1.2.1 SarA蛋白序列分析
通过NCBI获取SarA(Genbank:AAB21606.1)基因序列,采用TMHMM Server V2.0软件分析SarA蛋白的跨膜结构;应用抗原决定簇预测软件分析SarA蛋白的抗原表位.
1.2.2 引物设计
通过分析目的基因以及原核表达载体序列,选择共有的BamH I、XhoI作为酶切位点,在目的基因的上下游分别加上BamH I、XhoI酶切位点及保护性碱基,引物序列见表1.

表1 引物序列Tab.1 Primer sequences
1.2.3 PCR扩增并回收目的片段与T载体连接
将金葡菌ATCC 6538菌株进行菌种复苏,用基因组小提试剂盒进行金葡菌基因组提取,以基因组为模板,用P1和P2进行PCR扩增目的片段SarA.扩增体系见表2.反应程序:95 ℃预变性5 min;95 ℃变性 30 s,42.6 ℃退火30 s,72 ℃延伸 40 s,10个循环;95 ℃变性 30 s,55 ℃退火30 s,72 ℃延伸40 s,20个循环;72 ℃充分延伸10 min.

表2 SarA基因扩增体系Tab.2 SarA gene amplification system
吸取1 μL PCR扩增产物进行琼脂糖凝胶电泳鉴定,鉴定正确的目的片段加A尾,每50 μL体系加5.0 μL dNTP、5.0 μL 10×Taq buffer、2.0 μL Taq酶,95 ℃ 2 min,72 ℃ 30 min.将已加A尾的目的基因PCR扩增产物经1%琼脂糖凝胶电泳、溴化乙啶显色并切胶后,用天根胶回收试剂盒回收PCR扩增产物.按照pGEM-T Vector说明书将SarA纯化产物与pGEM-T进行连接,将连接产物转化至DH 5α感受态细胞中,并涂布于氨苄平板上,于37 ℃培养箱中培养16~18 h.
1.2.4 T载体重组质粒连接、菌液PCR及双酶切鉴定
挑取多个白色单克隆,置于200 μL含有氨苄的抗菌药物液体LB培养基中,37 ℃ 200 r/min过夜,震荡培养.次日,吸取2 μL菌液作为模板,进行菌液PCR鉴定,PCR反应体系和反应程序同1.2.3.若菌液PCR鉴定为阳性,则吸取5 μL相应阳性菌液,置于5 mL 含有5 μL氨苄抗菌药物的液体LB中,37 ℃ 200 r/min过夜震荡培养.次日,用Omega质粒提取试剂盒提取质粒,37 ℃酶切4 h,凝胶电泳鉴定.最后将酶切正确的质粒菌液进行测序.
1.3 SarA-pET32a(+)原核表达载体的构建及IPTG诱导表达
1.3.1 SarA-pET32a(+)原核表达载体的构建
将方法1.2.4测序正确的SarA-T质粒与pET32a(+)质粒分别用BamH I、XhoI双酶切,行琼脂糖凝胶电泳,对SarA基因片段与pET32a(+)载体片段进行回收、纯化,16 ℃ 过夜连接.连接完成后,将连接产物转化于DH5α感受态中,涂布于卡那霉素抗性平板上,37 ℃ 过夜培养.次日,挑取阳性克隆进行菌液PCR鉴定和酶切鉴定,方法同1.2.4.
1.3.2 IPTG诱导蛋白原核表达及蛋白纯化
将SarA-pET32a(+)转化至BL21(DE3)感受态中,涂布于含氨苄抗菌药物的LB平板上,37 ℃倒置培养16~18 h.挑取单克隆接种至10 mL液体LB培养基中,37 ℃摇床,180 r/min过夜震荡.次日,将10 mL菌液于1 L LB液体培养基中扩大培养,37 ℃摇床,200 r/min,当OD600达到0.5时,向1 L菌液中加入1 mL IPTG(终浓度为1 mmol),16 ℃摇床,130 r/min过夜诱导.次日,4 ℃ 4 500 r/min离心10 min,弃去上清,将菌液沉淀置于冰上,加入Binding Buffer和PMSF混合液进行超声.超声后,4 500 r/min离心25 min,将上清与沉淀分离,再用Binding Buffer和PMSF混合液重悬沉淀;再次超声、离心,将上清液混合.取上清与沉淀,行SDS-PAGE检测.利用亲和层析法纯化蛋白,分别用100、200、300、400、500 mmol咪唑洗脱,最后选择500 mmol咪唑进行洗脱,将超滤浓缩管浓缩洗脱下来的蛋白样品应用BCA试剂盒检测其蛋白浓度,用于多克隆抗体制备.
1.3.3 多克隆抗体的制备、血清效价及Western blot鉴定
首次免疫:将免疫原SarA重组蛋白与弗氏完全佐剂1∶1混合,选择家兔脊柱两侧共10个位点,每个位点注射0.2 mL蛋白浓缩液(800 μg/次).3周后加强免疫,免疫原与弗氏不完全佐剂1∶1混合,免疫原的量是首次免疫量的50%(400 μg/次),加强免疫3次.末次免疫1周后颈动脉取血,收集血清,进行间接酶联免疫吸附试验(间接ELISA),检测血清抗体效价.以SarA纯化蛋白为抗原,12% SDS-PAGE进行电泳,将目的条带转印至PVDF膜上,5%脱脂牛奶孵育1 h,兔免疫血清为一抗,4 ℃过夜孵育,HRP标记山羊抗兔抗体为二抗,室温孵育1 h,并行Western blot鉴定.
2 结 果
2.1 SarA蛋白序列分析
SarA基因编码113个氨基酸,蛋白分子量为13.44 kDa,以二聚体形式存在,通过生物信息学软件对SarA蛋白进行跨膜结构域和抗原表位分析.见图1a.SarA基因编码的蛋白区域均位于transme- mbrane线以下,未发现跨膜结构域,为胞内蛋白,可以选取基因全长的片段进行表达.见图1b.该抗原决定簇预测软件集成了以下5种算法:Kolaskar & Tongaonkar:分析蛋白的抗原指数;Parker:亲水性预测;Chou-Fasman:蛋白质二级结构;Karplus & Schulz:柔韧性预测;Emini:表面可及性预测.综合以上5种算法,结果显示后四者均有大部分重叠,而抗原指数预测与其相反,易形成抗原表位.本研究结果表明:选择SarA作为目标蛋白,其具有较强的免疫原性,容易刺激机体免疫系统产生抗体,故以其为模板构建DAN疫苗具有较强的可行性.

图1SarA基因编码蛋白的跨膜及抗原表位分析Fig.1Transmembrane and epitope analysis of protein encoded by SarA gene
2.2 目的基因片段的获取
金葡菌菌种复苏后,进行基因组DNA提取,以此为模板扩增出目的基因片段SarA(342 bp),条带在正确位置.见图2.

M.DL2000;1.SarA基因.图2SarA基因PCR结果Fig.2SarA gene PCR result
2.3 目的基因的T载体克隆、鉴定及测序
将PCR扩增产物SarA回收,回收后与T载体连接,连接后进行菌液PCR鉴定,PCR结果可见克隆条带与以基因组为模板的阳性对照条带大小一致.见图3.

M.DL2000;1.阴性对照;2.阳性对照;3~6.SarA-T阳性克隆.图3SarA-T重组质粒菌液PCR结果Fig.3PCR result of SarA-T recombinant plasmid
选择菌液PCR鉴定为阳性克隆的样品各两个,进行摇菌,提取质粒,质粒分别用BamH I和XhoI内切酶双酶切鉴定.酶切后分别有两条条带,一条为T载体条带,一条为目的条带.见图4.选取的菌液行PCR鉴定以及质粒双酶切鉴定,结果均为阳性.将菌液送于上海生工生物工程有限公司进行测序,通过比对,结果与Genbank中SarA序列一致.

M.DL2000;1、3.SarA-T未酶切质粒;2、4.SarA-T 双酶切质粒阳性结果.图4SarA-T重组质粒双酶切鉴定结果Fig.4Identification results of SarA-T recombinant plasmid by double enzyme digestion
2.4 SarA-pET32a(+)原核重组质粒的构建
将测序正确的SarA-T质粒和pET32a(+)质粒用BamH I/XhoI内切酶进行双酶切,回收目的片段SarA,分别与酶切后的pET32a(+)质粒载体连接;连接产物转化,进行双酶切鉴定.见图5.第2、4泳道上为pET 32a(+)载体条带,下为目的条带.

M.DL2000;1、3.SarA-pET32a(+)未酶切质粒;2、4.SarA-pET32a(+) 双酶切质粒阳性结果.图5SarA-pET32a(+)重组质粒双酶切鉴定结果Fig.5Identification results of SarA-pET32a(+) recom- binant plasmid by double enzyme digestions
2.5 SarA蛋白的原核表达
将鉴定正确的SarA-pET32a(+)原核重组质粒进行IPTG诱导表达,SDS-PAGE检测结果见图6.SarA蛋白在16 ℃诱导(相较于37 ℃诱导)条件下可溶性蛋白表达量更高.SarA的理论分子量约为14 kDa,正常条件下以二聚体形式表达,SDS-PAGE检测蛋白表达分子量在32 kDa左右.由于SarA蛋白与pET32a(+)原核表达载体形成融合蛋白,pET32a(+)T7启动子后含有一个thrombin位点、6×His标签、TrXA位点、Ek位点和S标签.

M.蛋白分子量;1.SarA重组菌体未诱导(37 ℃);2.SarA重组菌体诱导(37 ℃);3.SarA重组菌体的裂解液上清(37 ℃);4.SarA重组菌体的裂解液沉淀(37 ℃);5.SarA重组菌体未诱导(16 ℃);6.SarA重组菌体诱导(16 ℃);7.SarA重组菌体的裂解液上清(16 ℃);8.SarA重组菌体的裂解液沉淀(16 ℃);9.BL21菌体(37 ℃).图6SarA-pET32a(+) IPTG诱导表达产物的 SDS-PAGE分析Fig.6SDS-PAGE analysis of SarA-pET32a (+) IPTG-induced expression products
为进行多克隆抗体的制备,利用镍柱亲和层析法纯化16 ℃诱导表达的SarA可溶性蛋白,分别用100、200、300、400 mmol和500 mmol咪唑洗脱.相同条件下,500 mmol咪唑洗脱的蛋白量最多,将洗脱的蛋白样品使用10 kDa超滤浓缩管浓缩,浓缩后进行SDS-PAGE鉴定,使用BCA试剂盒检测蛋白浓度,用于多克隆抗体制备.见图7.
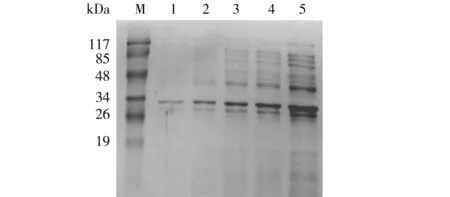
M. 蛋白分子量;1. 100 mmol咪唑洗脱液;2. 200 mmol咪唑洗脱液;3. 300 mmol咪唑洗脱液;4. 400 mmol咪唑洗脱液;5. 500 mmol咪唑洗脱液.图7SarA蛋白咪唑浓度梯度纯化结果Fig.7Results of SarA protein purified by different imidazole concentrations
2.6 ELISA间接法检测血清抗体效价
按一定比例的包被液稀释抗原SarA蛋白浓度至10 μg/mL,家兔阴性血清做对照,将待检血清按1∶1 000、1∶2 000、1∶4 000、…、1∶512 000稀释作为一抗,二抗为HRP标记羊抗兔IgG(1∶5 000),加TMB底物显蓝色,37 ℃孵育10 min后加入终止液,颜色变黄后应用酶标仪测定450 nm处各孔的吸光度值,绘制标准曲线,由图8可见血清抗体效价达到1∶512 000.
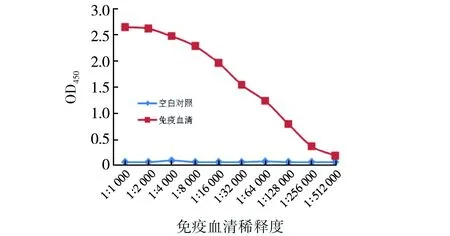
图8免疫动物血清抗体效价Fig.8Serum antibody titer of immunized animals
2.7 多克隆抗体的Western blot鉴定
免疫后的家兔颈动脉取血,收集血清,并作为一抗(1∶2 000);以未注射SarA蛋白的家兔血清作为阴性对照,HRP标记山羊抗兔抗体为二抗(1∶3 000).Western blot鉴定结果显示阴性对照无任何条带,在34 kDa位置附近能显示出特异SarA蛋白条带,说明本实验已成功制备了良好特异性的SarA蛋白血清多克隆抗体.见图9.

M.预染低分子量蛋白标准;1.兔免疫血清;2.阴性血清.图9兔血清抗体Western blot检测Fig.9Western blot results of rabbit serum
3 结 论
细菌生物膜可引起严重的耐药现象,进而形成难治性感染,细菌生物膜作为细菌耐药的重要机制之一已引起广泛关注,成为近年来细菌耐药机制研究的热点.虽然关于生物膜的形成机制已有很多研究,也认识一些在这一过程中起作用的关键基因,但对于如何有效抑制生物膜形成的细节还缺乏更深入的研究[14].
有研究[15]发现:在金葡菌中,特异性敲除SarA基因可使细菌生物膜形成的能力减弱,且增加了金葡菌对抗菌药物敏感性,这表明SarA在细菌生物膜的形成过程中具有至关重要的作用.本研究将SarA基因作为靶基因,通过对SarA的跨膜结构域以及抗原表位的生物信息学分析及预测,可知SarA蛋白不具有跨膜区域,二级结构主要由α螺旋和β折叠组成.在α-螺旋和β-折叠区域的间隙存在容易形成抗原表位的β-转角和无规卷曲区域,且该蛋白的C端具有较好的柔性、亲水性(≥0.5)和表面可及性(≥1),抗原指数也较高,分布较均匀,易形成抗原表位,与抗体结合的可能性较大.
本实验成功构建了金葡菌SarA基因的原核表达载体,并在大肠杆菌细胞中呈可溶性表达,通过对其诱导温度的改变,得到诱导温度为16 ℃时,包涵体蛋白较37 ℃时减少,可溶性蛋白量增加,这可能是由于低温会降低蛋白质的表达速度,并促进蛋白质的正确折叠[16].诱导SarA融合蛋白,并应用6xHis亲和层析技术获得较高纯度的免疫原,免疫原结合弗氏(不)完全佐剂免疫家兔后,弗氏佐剂不仅可以使抗原持续缓慢的释放,又能非特异性地增强机体对抗原的特异性免疫应答.本实验结果表明:研究中所表达纯化的可溶性SarA蛋白具有极强的免疫原性,通过间接ELISA实验和Western blot实验得到了高效价和良好特异性的多克隆抗体.
综上所述,SarA作为目标蛋白构建DAN疫苗具有可行性,可能会有效刺激机体的细胞免疫和体液免疫.本研究为后续针对细菌生物膜消散的DNA疫苗研究奠定了基础,将对具有强耐药性的金葡菌感染的治疗提供临床参考价值.
致谢:本文是北华大学大学生创新创业训练项目(201811923138)研究成果的一部分,口腔医学院2017级田磊同学参加了本实验的研究工作.
