L-精氨酸对热处理MLTC-1细胞氧化、凋亡及睾酮合成相关基因表达的影响
2021-03-11贾潇李照见李延森李春梅
贾潇,李照见,李延森,李春梅
(南京农业大学动物科技学院家畜环境控制与智慧生产研究中心,江苏 南京 210095)
精氨酸是条件性必需氨基酸,在自然环境下主要以D-精氨酸和L-精氨酸两种异构体的形式存在。在动物机体内,精氨酸以L-精氨酸的形式发挥功能,是目前发现的动物细胞内功能最多的氨基酸。精氨酸是NO和多胺等生物活性因子的前体物质[1],对调控动物的生产、繁殖有重要作用。有研究表明,精氨酸具有缓解氧化应激,增强畜禽抗氧化应激的功能[2]。此外,Holt等[3]研究发现,连续9 d摄入缺乏精氨酸的食物会导致男性的精子数量和活力降低。这些研究表明,精氨酸在精子发生中发挥着重要作用,适当增加精氨酸的供给可以提高雄性的生殖功能。
在雄性的睾丸发育过程中,分散在生精小管间的间充质细胞会分化为睾丸间质细胞,并分泌雄激素[4]。睾丸间质细胞主要分泌睾酮,动物体内95%左右的睾酮是由睾丸间质细胞分泌的[5]。睾丸间质细胞发育不良或增生时会引起多种疾病。有研究表明,睾丸间质细胞发育不良会导致雄激素分泌减少,影响睾丸下降到腹部及腹股沟阶段,最终导致隐睾的发生[6]。本课题组前期研究发现环境高温可引起公猪睾丸组织细胞凋亡和氧化损伤[7]。本研究选取小鼠睾丸间质瘤细胞系(MLTC-1),探究热处理对MLTC-1细胞的损伤以及L-精氨酸的缓解作用。
1 材料与方法
1.1 试验材料
MLTC-1细胞系购自中乔新舟;L-精氨酸(CAS:74-79-3;纯度>99%)购自希杰(上海)商贸有限公司;RPMI 1640培养基、胎牛血清购自Gibco公司;RT-PCR定量试剂盒、反转录试剂盒购自南京诺唯赞生物科技有限公司;总超氧化物歧化酶(T-SOD)测试盒(羟胺法)、谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒(可见光法)、MTT检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒购自南京建成生物工程研究所。
1.2 试验方法
1.2.1 试验设计
将细胞分为4组,分别为对照组(C)、热处理组(HT)、5 μg/mLL-精氨酸+热处理组(5H)和10 μg/mLL-精氨酸+热处理组(10H)。将细胞接种于六孔板中,每孔1×106个细胞,在37 ℃、5% CO2的培养箱中培养36 h后(若细胞较少,可适当延长培养时间),更换为分别含精氨酸0、5、10 μg/mL的RPMI 1640培养基,继续在37 ℃、5% CO2的培养箱中培养6 h,更换含0.1 U/mL hCG的RPMI 1640培养基,C组继续在37 ℃、5% CO2的培养箱中,0H、5H和10H组放入42 ℃、5% CO2的培养箱培养4 h,收集上清和细胞备用。
1.2.2L-精氨酸对MLTC-1细胞活力的影响
将细胞分为6组,接种于96孔板中,每孔2 000个细胞,在37 ℃、5% CO2培养箱中培养24 h后分别加入含 0、10、20、40、80、160 μg/mL精氨酸的培养基,孵育6、12、24 h后,采用MTT法测定细胞活力。检测方法参照MTT细胞活力检测试剂盒说明书。
1.2.3L-精氨酸添加量筛选
将细胞分为5组,即对照组(C)、热处理组(HT)、5 μg/mLL-精氨酸+热处理组(5H)、10 μg/mLL-精氨酸+热处理组(10H)和20 μg/mLL-精氨酸+热处理组(20H),接种于96孔板中,每孔2 000个细胞,在37 ℃、5% CO2条件下培养24 h后,将分别含L-精氨酸 0、5、10、 20 μg/mL的培养基加入到对应组中,孵育5 h后,将HT组、5H组、10H组和20H组移入42 ℃、5% CO2培养箱中热处理1 h,然后更换为不含血清的培养基,在37 ℃、5% CO2条件下恢复6 h,然后用MTT细胞增殖-毒性检测试剂盒检测细胞存活率。
1.2.4 细胞总RNA提取、反转录及荧光定量PCR
将细胞按试验设计处理完毕后,弃去培养液,收集细胞进行总RNA提取,反转录及荧光定量PCR测定。试验中所用引物序列如表1。

表1 引物序列
1.2.5 Annexin V-FITC细胞凋亡检测
按照试验设计将细胞处理完毕后,将细胞和上清液收集在同一离心管中,用流式细胞仪进行检测分析。
1.2.6 抗氧化指标的测定
使用GSH-PX测定试剂盒,采用可见光法测定细胞培养液中GSH-PX的活力;使用T-SOD测试盒,采用羟胺法测定细胞培养液中T-SOD的活力。
1.3 数据统计与分析
数据首先用WPS表格进行初步统计整理,然后使用SPSS 20以及Graphpad Prism 5.0进行统计分析,采用One-way ANOVA和LSD多重比较法进行分析,结果以平均值±标准误表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 精氨酸对MLTC-1细胞活力的影响
为确定L-精氨酸的处理时间以及添加量,本试验采用了MTT法测定了不同时间点(6、12和24 h)以及不同浓度(0、10、20、40、80和160 μg/mL)下MLTC-1细胞的存活率。如图1所示,处理时间为6 h,与对照组相比,L-精氨酸添加量为10 μg/mL时细胞活力显著上升(P<0.05),添加量为80 μg/mL时细胞活力极显著下降(P<0.01);当细胞处理时间为12 h时,不同浓度精氨酸对细胞活力呈下降趋势,并且添加量为40、80、120 μg/mL时,细胞存活率极显著下降(P<0.01);当处理时间为24 h时,所有精氨酸浓度处理下,细胞活力均极显著下降(P<0.01)。试验结果如图1所示,根据结果,后续试验细胞确定处理时间为6 h。
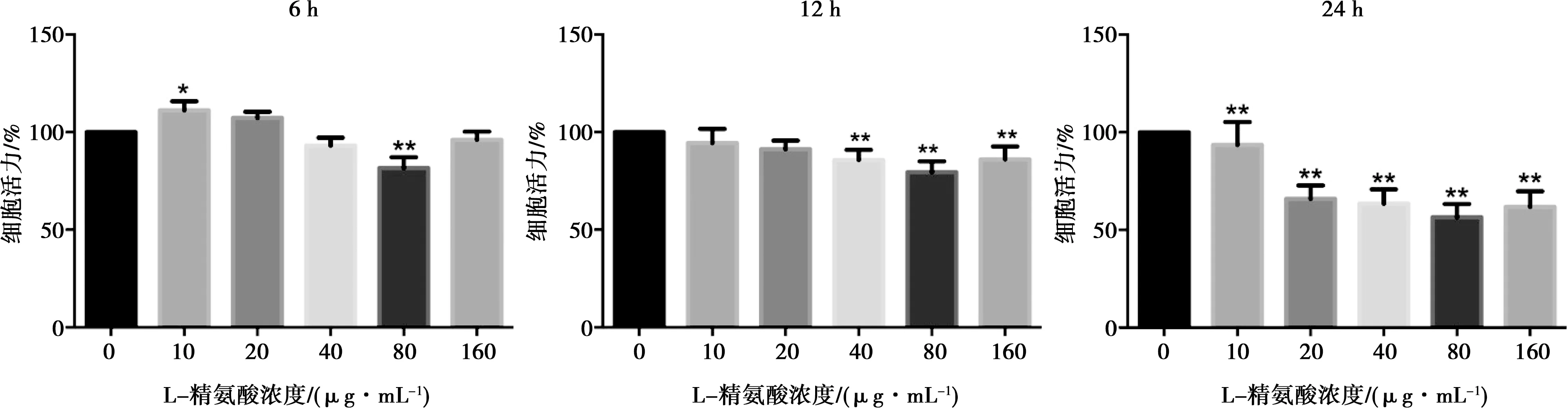
*表示与C组(0 μg/mL)相比差异显著,P<0.05;**表示与C组相比差异极显著,P<0.01
2.2 L-精氨酸添加量的筛选
如图2所示,热处理降低了MLTC-1细胞活力,当添加不同浓度(0、5、10和20 μg/mL)L-精氨酸处理后,细胞活力呈上升趋势,但是随着精氨酸浓度的增加,细胞活力又成下降趋势。当L-精氨酸添加量为5 μg/mL时,细胞活力恢复到和C组差不多水平。所以,确定L-精氨酸添加量为5和10 μg/mL。
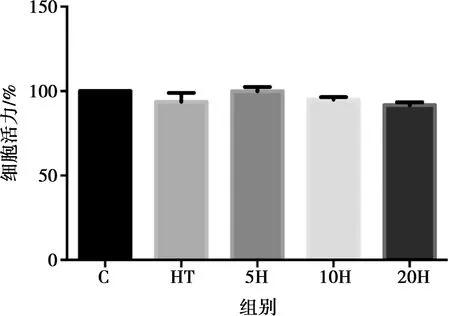
图2 L-精氨酸对热处理MLTC-1细胞活力的影响
2.3 L-精氨酸对热处理MLTC-1细胞抗氧化指标的影响
如图3所示,与对照组(C组)相比,热处理极显著降低了MLTC-1细胞GSH-Px活力(P<0.01),当L-精氨酸添加量为10 μg/mL时,与热处理组(HT)相比,GSH-Px活力极显著提高(P<0.01)。
2.4 L-精氨酸对热处理MLTC-1细胞凋亡的影响
如图4所示,与对照组(图4A)相比热处理后,早期凋亡和晚期凋亡细胞比例增加(图4B);分别添加5 μg/mL(图4C)和10 μg/mL(图4D)L-精氨酸处理后,与热处理组(图4B)相比,早期凋亡和晚期凋亡细胞比例减少。

A. GSH-Px活力;B. T-SOD活力。*表示差异显著,P<0.05;**表示差异极显著,P<0.01。下同

A. C组;B. HT组;C. 5H组;D. 10H组
2.5 L-精氨酸对热处理MLTC-1细胞凋亡相关基因表达的影响
如图5所示,与HT组相比,添加L-精氨酸处理后,PI3K、Akt和Bcl-2的基因表达均呈上升趋势,当L-精氨酸添加量为5 μg/mL时,PI3K和Bcl-2基因表达量显著增加(P<0.05)。
2.6 L-精氨酸对热处理MLTC-1细胞睾酮合成相关基因表达的影响
如图6所示,与对照组(C组)相比,热处理(HT)使StAR基因表达显著增加(P<0.05)。添加L-精氨酸处理后,StAR、SF-1、Hsd3b1和Cyp17a1基因表达均呈上升趋势,当L-精氨酸添加量为5 μg/mL时,与HT组相比,SF-1基因表达显著增加(P<0.05),StAR和Cyp17a1基因表达极显著增加(P<0.01);当L-精氨酸添加量为10 μg/mL时,与HT组相比,StAR基因表达极显著增加(P<0.01)。
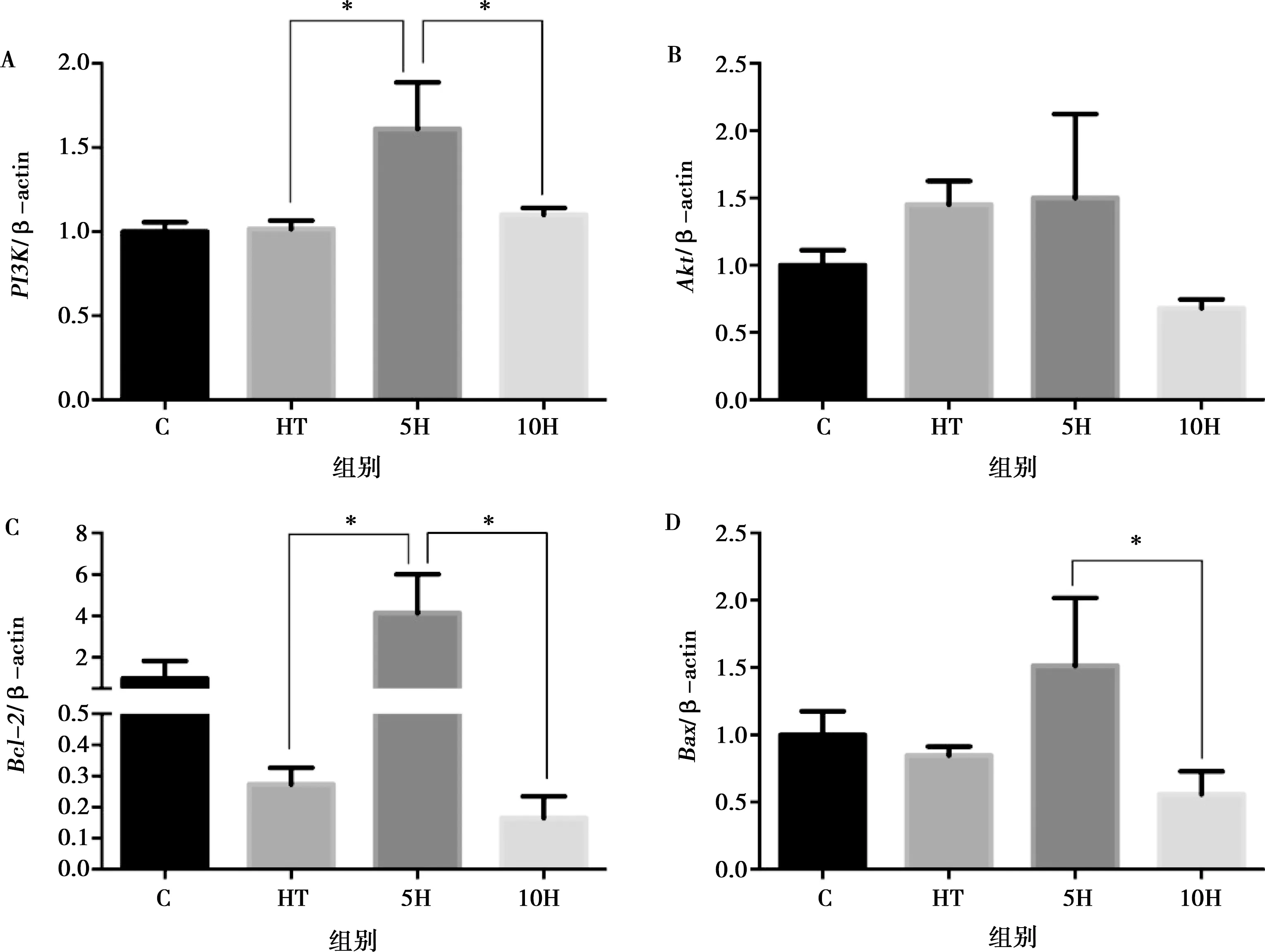
A. PI3K mRNA;B. AKT mRNA;C. Bcl-2 mRNA;D. Bax mRNA
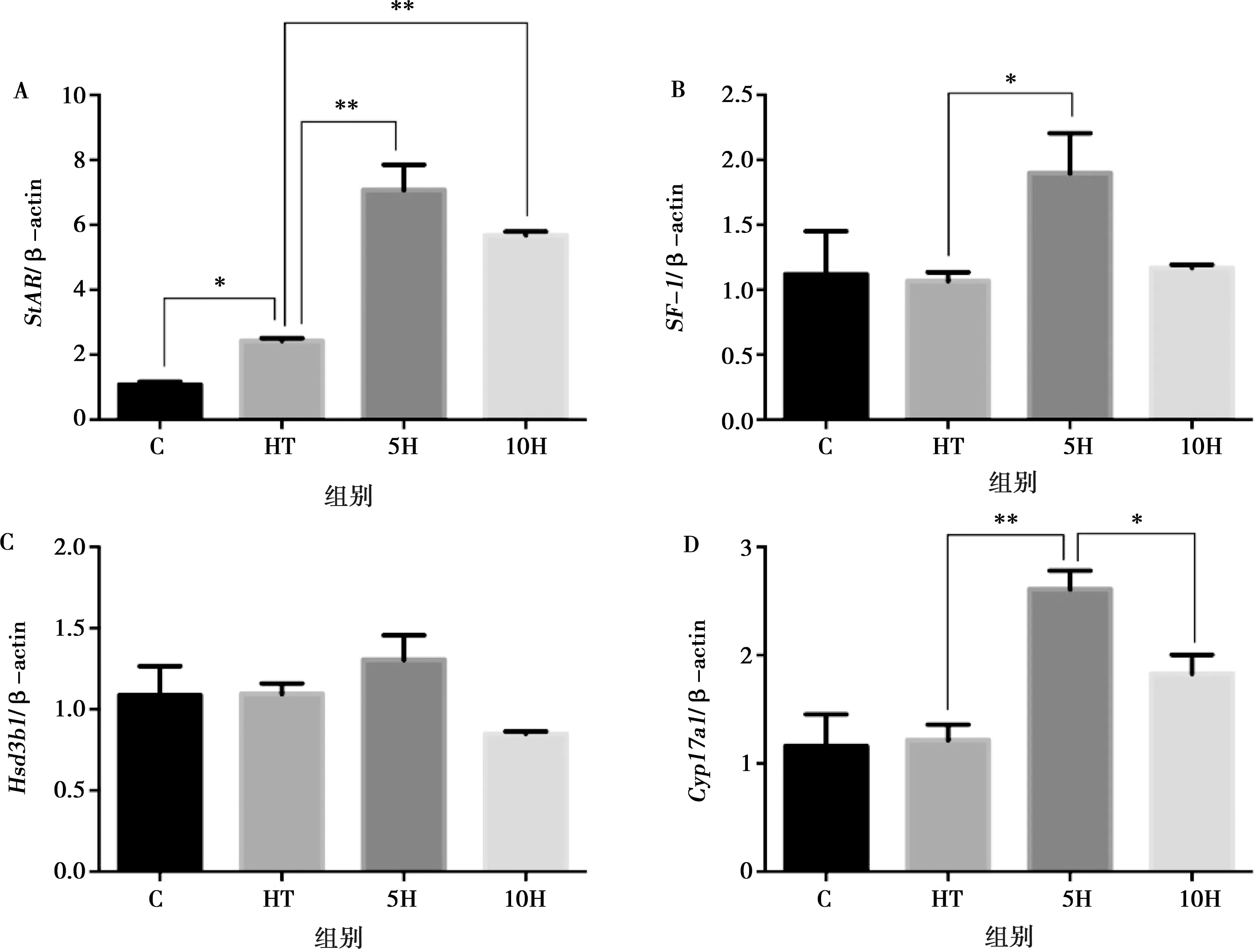
A. StAR mRNA;B. SF-1 mRNA;C. Hsd3b1 mRNA;D. Cyp17a1 mRNA
3 讨论
精氨酸是一种条件必需氨基酸,在机体内,主要以L-精氨酸的形式发挥作用。有研究发现,连续摄入缺乏精氨酸的食物会导致男性的精子数量和活力降低[3]。Srivastava[8]研究发现,L-精氨酸可以增加精子活力。也有研究表明,高浓度L-精氨酸对细胞有毒性。Silva等[9]发现高浓度L-精氨酸在体外受精下对牛精子可能有毒性作用。本研究对L-精氨酸的处理时间和浓度进行筛选发现,处理时间6 h时,MLTC-1细胞活力较高,12 h和24 h时细胞活力反而显著下降;热处理后,MLTC-1细胞活力下降,当L-精氨酸添加量为5 和10 μg/mL时,细胞活力得到恢复,因此后续试验确定L-精氨酸添加量为5 和10 μg/mL,处理时间为6 h。
GSH-Px和T-SOD是标志性的抗氧化酶,在缓解氧化损伤方面发挥着重要作用。GSH-Px功能和CAT相似,它可以以谷胱甘肽为底物清除过氧化氢,也可以清除脂质过氧化物[10]。SOD是体内清除自由基的主要物质,可以维持体内氧化-抗氧化平衡[11-12]。在本研究中,热处理极显著降低了MLTC-1细胞GSH-Px的活力,添加L-精氨酸后,热处理MLTC-1细胞GSH-Px的活力增强,说明L-精氨酸可以提高热处理MLTC-1细胞的抗氧化能力。
细胞凋亡是一种受基因调控的细胞程序性死亡。Bcl-2基因家族是细胞凋亡的重要调控基因,具有抗凋亡作用,可抑制线粒体释放细胞色素C,还可通过细胞色素C下游的一个关键节点,阻断细胞凋亡的级联反应[13-15]。Bax也可通过激活线粒体通路调节细胞凋亡,通过促进细胞色素C等小分子物质进入细胞浆,活化Caspase-3激活核酸内切酶,最终导致细胞凋亡[16]。PI3K家族成员参与多条信号通路[17],对细胞的生长、分化和凋亡起着重要作用[18]。PI3K激活后在质膜上产生第二信使 PIP3,PIP3 与细胞内信号蛋白AKT的PH结构域结合,磷酸化AKT蛋白的308位苏氨酸,活化AKT蛋白[19]。活化后的AKT通过磷酸化作用激活或抑制其下游靶蛋白[20]。在本研究中,热处理诱导了MLTC-1细胞的凋亡,添加L-精氨酸后,凋亡细胞数下降,当L-精氨酸添加量为5 μg/mL时,凋亡相关基因PI3K和Bcl-2的基因表达量显著增加。这表明,L-精氨酸可通过调控凋亡相关基因的表达,缓解热处理诱导的细胞凋亡。
StAR是类固醇激素合成的限速酶,SF-1是类固醇生成因子1,在类固醇生成、脑和垂体激素调控、肾上腺肿瘤发生中发挥着重要作用,是肾上腺和性腺发育及功能的重要调控因子。3β-HSD(Hsd3b1)的表达具有细胞及组织特异性,睾丸组织内只有间质细胞才会表达。3β-HSD能通过改变孕烯醇酮C5、C6之间的双键,将Δ5甾体转变为Δ4甾体[21],是所有活性类固醇激素所必须的一种脱氢酶。17α-羟化酶(Cyp17a1)在睾酮合成中具有非常关键的催化作用[22-23]。在本研究中,添加5 μg/mLL-精氨酸显著促进了StAR、SF-1和Cyp17a1基因表达;添加10 μg/mLL-精氨酸时,StAR基因表达显著上调,表明L-精氨酸可调控热处理MLTC-1细胞类固醇激素合成相关基因的表达。
4 结论
适量的L-精氨酸可增强MLTC-1细胞的抗氧化及抗凋亡能力,缓解热处理诱导的MLTC-1细胞凋亡,并且可调控热处理MLTC-1细胞睾酮合成相关基因的表达。
