铺地黍染色体制片优化及核型分析
2021-03-11林晓璇陈林静容晨毓陈凯琪高桂娟
林晓璇,陈林静,容晨毓,陈凯琪,高桂娟
(广东第二师范学院生物与食品工程学院,广东广州510303)
铺地黍(Panicum repens)广布于热带、亚热带地区,繁殖能力强,其在干旱、水淹、重金属胁迫、富营养化水体等环境条件下,均表现出较好的抗逆性及净化能力[1-3],同时,还表现出一定的饲用价值。目前,铺地黍以及相关属的植物染色体制片报道较少[4],《中国植物志》记录铺地黍染色体数2n=40[5],但未有相关文献报道铺地黍的核型参数。
染色体核型分析在研究植物的起源、系统演化以及物种间亲缘关系等方面都起着重要意义[6]。不同物种在预处理、解离以及制片等步骤中采用的方法各有不同,每个过程都可能对染色体带来或多或少的影响[7-14]。为获得更好的铺地黍染色体制片效果及确定铺地黍核型公式和不对称程度,本研究对铺地黍染色体制片技术进行优化并进行核型分析,以期为铺地黍的起源、演化及遗传育种提供一定的理论依据和技术基础。
1 材料与方法
1.1 材料
试验材料铺地黍采自于广东省大宝山,整个试验过程均采用同一株系扩繁材料,以水培条件培养,取幼嫩根尖进行试验。
1.2 方法
1.2.1 改良的制片技术
本研究采用改良的压片法,将去壁低渗–火焰干燥技术的低渗环节加入到压片技术中[10,15],操作流程如图1 所示;以铺地黍根尖为材料,从预处理、固定、前低渗、解离4 个方面进行优化设计。

图 1 改良的压片操作过程Figure 1 Im proved process of pressure sheet
1.2.2 取材时间
植物分生组织的生长具有一定周期性,一般认为取材应选在分裂中期最为合适,通常在08:00−11:00 或13:00−15:00 进行[7];但有研究发现最佳取材时间并不具有较好的稳定性,且在最佳时间取材所获得的分裂中期染色体比例也有较大波动[16]。也有学者指出,不同植物在不同温度条件下,细胞的分裂周期是可变的,而用一个固定的昼夜节律的概念去理解多变的细胞周期是缺乏理论依据而且在实践上也不能得到证实,因此,只要植物的分生组织处在良好活动状态,在一天中任何时间取材均可[17]。将铺地黍的根尖进行取样也证实,在08:00−18:00 取材均可得到一定数量可供核型分析的中期细胞(表1),并且在根长为0.5 和2 cm 时分别取材进行观察,发现两者对有丝分裂中期细胞的数量并无太大影响,分生区细胞成熟程度也未发现较大区别。基于文献以及方便后续研究,均在根尖长度为0.5~2 cm 时,于15:00 左右取材进行处理。
1.2.3 预处理阶段优化
预处理的目的在于阻止或破坏纺锤体形成,使有丝分裂被阻断在中期;也可导致染色体高度浓缩,使染色体变短,从而利于染色体分散。另外,用不同的预处理方法所得效果不同,如用药液(如秋水仙素和8-羟基喹啉的混合溶液)预处理,虽然浓度很低,但它们对细胞都有毒害作用,这种毒害作用强度随温度变化而不同;而用冰水混合物低温预处理相对安全,但不适用于所有植物,因为不同植物细胞的合成、代谢及细胞分裂对低温的反应不同[17]。预处理条件的单因素优化设计:对预处理进行8 种不同条件设计,冰水混合物4℃分别设置12、20、22、24、48h,1꞉1 溶液(0.002mol·L−18-羟基喹啉溶液꞉0.0 5%秋水仙素溶液)4℃分别设置2、3、4 h,每处理5 个重复。固定、前低渗和解离统一采用常规固定条件(卡诺氏固定液Ⅰ、4℃、2 4 h)、常规前低渗条件(0.075mol·L−1KCl 溶液、25℃、30m in)和常规解离条件(混合酶液、25℃、4h)[17],每处理5 个重复。
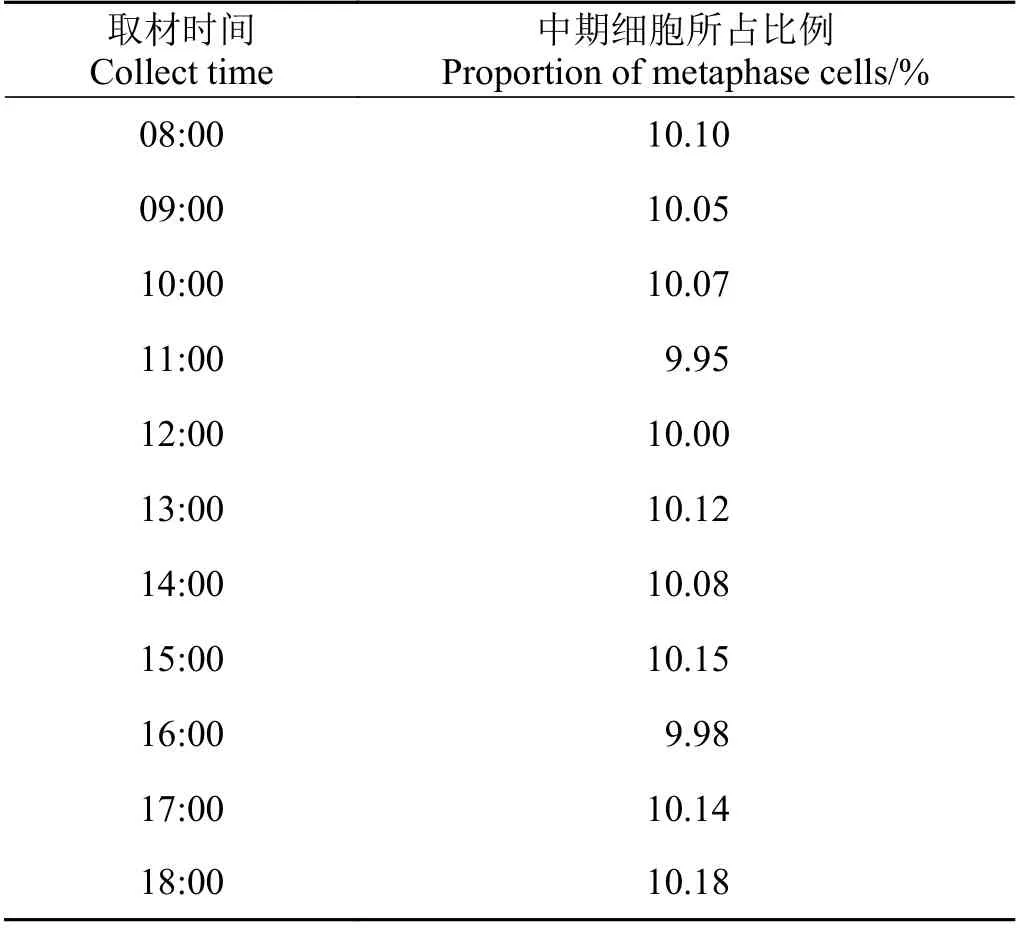
表 1 不同取材时间对铺地黍中期细胞的影响Table 1 Effect of different collection tim es on the metaphase of Panicum repens
1.2.4 固定阶段优化
固定的目的在于用固定液将细胞迅速杀死,使蛋白质沉淀并尽量使其保持原有状态;一般采用卡诺氏固定液Ⅰ(无水乙醇꞉冰醋酸=3꞉1)低温(4℃左右)固定材料;也有使用甲醇替代无水乙醇,但由于甲醇毒性较大,且对细胞壁和染色体的硬化作用较乙醇强,一般只用于去壁低渗干燥法中[15,17]。固定阶段的单因素优化设计:使用卡诺氏固定液Ⅰ(无水乙醇꞉冰醋酸=3꞉1)在4℃条件下,分别固定1、2、12 和24 h 的梯度设计。预处理、前低渗和解离统一采用已获得的优化预处理条件(冰水混合物4℃预处理22h)和常规前低渗条件(0.075mol·L−1KCl溶液、25℃、3 0m i n)、常规解离条件(混合酶液、2 5℃、4 h)[17],每处理5 个重复。
1.2.5 前低渗阶段优化
在解离前进行前低渗,解离后又进行后低渗,水分通过细胞膜渗入细胞内,使细胞膨胀,进而使得本来分散的染色体更加分散[18]。利用常规压片方法进行制片,解离后材料较硬,细胞较难分散,并且很难将细胞压到同一个平面,所得染色体图像不清晰;有研究将去壁低渗干燥技术的低渗加到压片技术之中,所得制片效果良好[10,15];一般使用蒸馏水或0.075mol·L−1KCl 溶液进行低渗,处理时间的长短也因植物的不同而定。前低渗条件的单因素优化设计:前低渗阶段用0.075mol·L−1KCl 溶液在25℃条件下分别设置5、10、15、20、25、30 及60 m in 共7 个时间梯度,预处理、固定和解离统一采用已获得的优化预处理条件(冰水混合物4℃预处理2 2 h)、优化固定条件(卡诺氏固定液Ⅰ固定2 4 h)及常规解离条件(混合酶液、25℃、4h)[17],每处理5 个重复。
1.2.6 解离阶段优化
解离的目的在于将部分细胞质、细胞壁的纤维素和果胶物质分解或软化细胞壁,易于染色体分散制片;酸解法通常用1mol·L−1HCl 在60℃水浴锅解离几分钟到十几分钟或更长;对于难以解离或软化的材料,也有用无水乙醇和浓盐酸的混合液进行解离;而采用纤维素酶(1%~5%)和果胶酶(1%~3%)的混合溶液去除细胞壁时,酶的浓度、质量、pH 以及酶解的时间、温度都对酶解效果有不同的影响,酶解时间一般在室温下2~5 h[15-18]。解离阶段的单因素优化设计:酸解法用浓HCl꞉95%乙醇=1꞉1(25℃)分别设置5、10、15min 和1mol·L−1HCl(60℃)分别设置5、1 0、1 5m in;酶解法用1%果胶酶和2%纤维素酶(25℃)分别设置2、3、4 h,共9 种解离条件,预处理、固定、前低渗统一采用已获得的优化预处理条件(冰水混合物4℃预处理2 2 h)、优化固定条件(卡诺氏固定液Ⅰ固定2 4 h)及优化前低渗条件(0.075mol·L−1KCl 溶液、25℃、前低渗15~20m in),每处理5 个重复。
1.2.7 镜检
用OLYMPUSCX22 显微镜观察,选择30 个染色体分散且形态较好的细胞进行染色体数目统计,若85%以上染色体数目相同时,即能够确定染色体数目[19];其次选取5 个分裂相对良好且染色体形态清晰的细胞再用佳能相机借助显微镜单反相机转接口(2X)在油镜下拍照。
1.2.8 核型分析
选取5 张染色体形态清晰且无重叠的图片使用Photoshop 软件对染色体进行测量和配对[20],用Excel 软件绘制核型模式图[21]。核型分析方法依据李懋学和陈瑞阳[19]的标准,染色体形态根据Levan等[22]的方法归类,核型不对称性按照Stebbins[23]的标准划分。
臂比(r)=长臂(S)/短臂(L);染色体绝对长度(μm)=放大的染色体长度(mm)/放大倍数×1 000;染色体相对长度(%)=染色体长度/染色体组总长度×1 0 0%;染色体平均相对长度(%)=染色体组总相对长度/染色体组总数;染色体相对长度系数(Index of relativelength)=每条染色体相对长度/染色体平均相对长度;平均长度核型不对称系数(As.k,%)=长臂总长/全组染色体总长×100%。
2 结果与分析
2.1 不同处理阶段优化的染色体制片效果
2.1.1 预处理阶段优化的染色体制片效果
8 种处理条件中,冰水混合物4℃预处理2 2 h染色体长度适宜、分散良好、清晰度高(图2C),是适合铺地黍类染色体制片的预处理方法。冰水混合物4℃预处理2 0 h 和1꞉1 溶液4℃处理3 h 条件下会出现局部黏连现象(图2B 和图2G),或者冰水混 合 物4℃预处理1 2 h 和1꞉1 溶 液4℃处理2 h后凝缩程度不足、严重拖尾现象(图2A 和图2F)。而4℃预处理2 4 h、4 8 h 和1꞉1 溶液4℃处理4 h的染色体凝缩过度,并出现染色体不同层现象(图2D、图2E、图2H)。
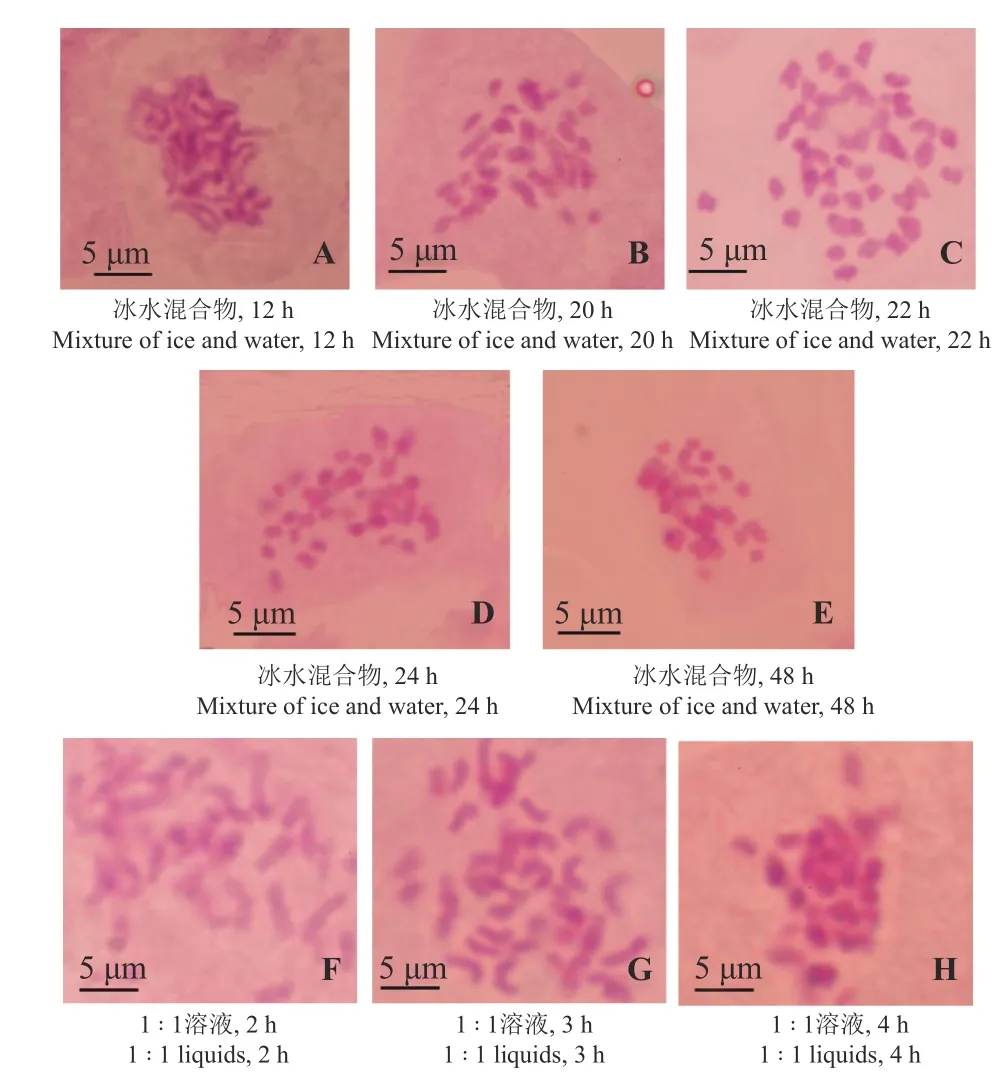
图 2 不同预处理条件的单因素试验制片效果Figure 2 Single-factor effect of different pre-treatmentconditions on chromosome preparation
2.1.2 固定阶段优化的染色体制片效果
4 种处理中,使用卡诺氏固定液Ⅰ(无水乙醇 ꞉冰醋酸=3꞉1)在4℃条件下固定2 4 h 细胞视野清晰,染色体分散,染色效果良好,易于观察计数(图3D),即固定24 h 是适合铺地黍类染色体制片的固定时间。固定1 h 会出现细胞质易染上颜色(图3A)、固定2 h 细胞视野清晰但染色体局部黏连(图3B)、固定12 h 染色深浅不一且局部聚集(图3C)。

图 3 不同固定条件的单因素试验制片效果Figure 3 Single-factor effect of different fixed conditions on chromosom e preparation
2.1.3 前低渗阶段优化的染色体制片效果
用0.075mol·L−1KCl 溶液在25℃条件下前低渗15 和20m in 染色体易于着色,染色体较分散(图4C和图4D),即解离前低渗15~20m in 易于铺地黍类染色体分散。前低渗5 和25m in 染色体染色效果较好,但染色体较黏连(图4A 和图4E);前低渗10m in的染色体大致分散,但染色效果不佳(图4B);前低渗30 和60m in 染色体凝集缠绕严重,难以观察计数(图4F 和图4G)。
2.1.4 解离阶段优化的染色体制片效果
铺地黍根尖相对较佳的解离条件为1%果胶酶和2%纤维素酶于25℃条件下酶解3 h(图5H),经此方法处理后,细胞壁完全溶解,细胞质稀薄,染色体分散且易着色。而用1%果胶酶和2%纤维素酶于25℃条件下酶解2 h,细胞壁基本溶解,细胞质较薄,染色体易着色但不够分散(图5G);酶解4 h,细胞壁破坏彻底,细胞质很稀薄,背景清晰,染色体易着色,但根尖易断裂丢失,导致染色体易缺失(图5I)。

图 4 不同前低渗条件的单因素试验制片效果Figure 4 Single-factor effect of different pre-hypotension conditions on chromosome preparation

图 5 不同解离条件的单因素试验制片效果Figure 5 Single-factor effect of different dissociation conditions on chromosome preparation
采用酸解法所得制片效果较差,在25℃条件下 用浓HCl꞉9 5%乙醇=1꞉1 解 离5、1 0min,细 胞壁均未全部溶解,细胞质厚,细胞易重叠,染色体聚集且难着色(图5A 和图5B);用浓HCl꞉95%乙醇=1꞉1 解离1 5m in 细胞壁已全部溶解,但细胞质仍较厚,染色体不够分散,难着色(图5C)。在60℃条件下用1mol·L−1HCl 解离5m in,细胞壁全部溶解,细胞质薄,但染色体不够分散,难着色(图5D);解离10min,细胞壁破坏彻底,细胞质很稀薄,背景干净,染色体较分散,易着色,但细胞容易重叠(图5E);解离15min,细胞壁完全溶解、细胞质薄,但染色体不够分散、着色不均匀(图5F)。
综上,将优化处理整理如图6 所示。在根长0.5~2c m、1 5:0 0 时剪取根尖,采用冰水混合物在4℃条件下预处理22h 后,于4℃条件下用卡诺氏固定液Ⅰ固定24h,接着用0.075mol·L−1KCl 溶液于25℃条件下前低渗15~20m in,置于1%果胶酶和2%纤维素酶混合酶液于25℃条件酶解3 h,再用蒸馏水于25℃条件后低渗3 0 m i n,于2 5℃条件下用卡诺氏固定液Ⅰ再固定30m in 后使用改良苯酚品红染液染色8m in,用吸水纸吸取染液,盖上盖玻片,对边轻压玻片边缘并用带橡皮铅笔头敲击。

图 6 铺地黍根尖细胞染色体制片优化条件Figure 6 The optim ized conditions for preparing chrom osomes in Panicum repens root tip cells
2.2 铺地黍核型分析
2.2.1 染色体数目
铺地黍染色体数目为2 n=2 x=40,为二倍体。
2.2.2 核型特征铺地黍核型公式为2n=2 x=4 0=3 4m+6sm,为中部和亚中部着丝粒染色体,未发现有随体(表2、图7)。染色体绝对长度范围为10.87~19.21μm,属于大型染色体。染色体相对长度为3.85~6.81,相对长度组成为2n=40=2L+16M2+22M1;最长与最短染色体长度比值为1.77,臂比值范围为1.04~2.08,核型不对称系数为58.99%,核型类型属于2A 型。
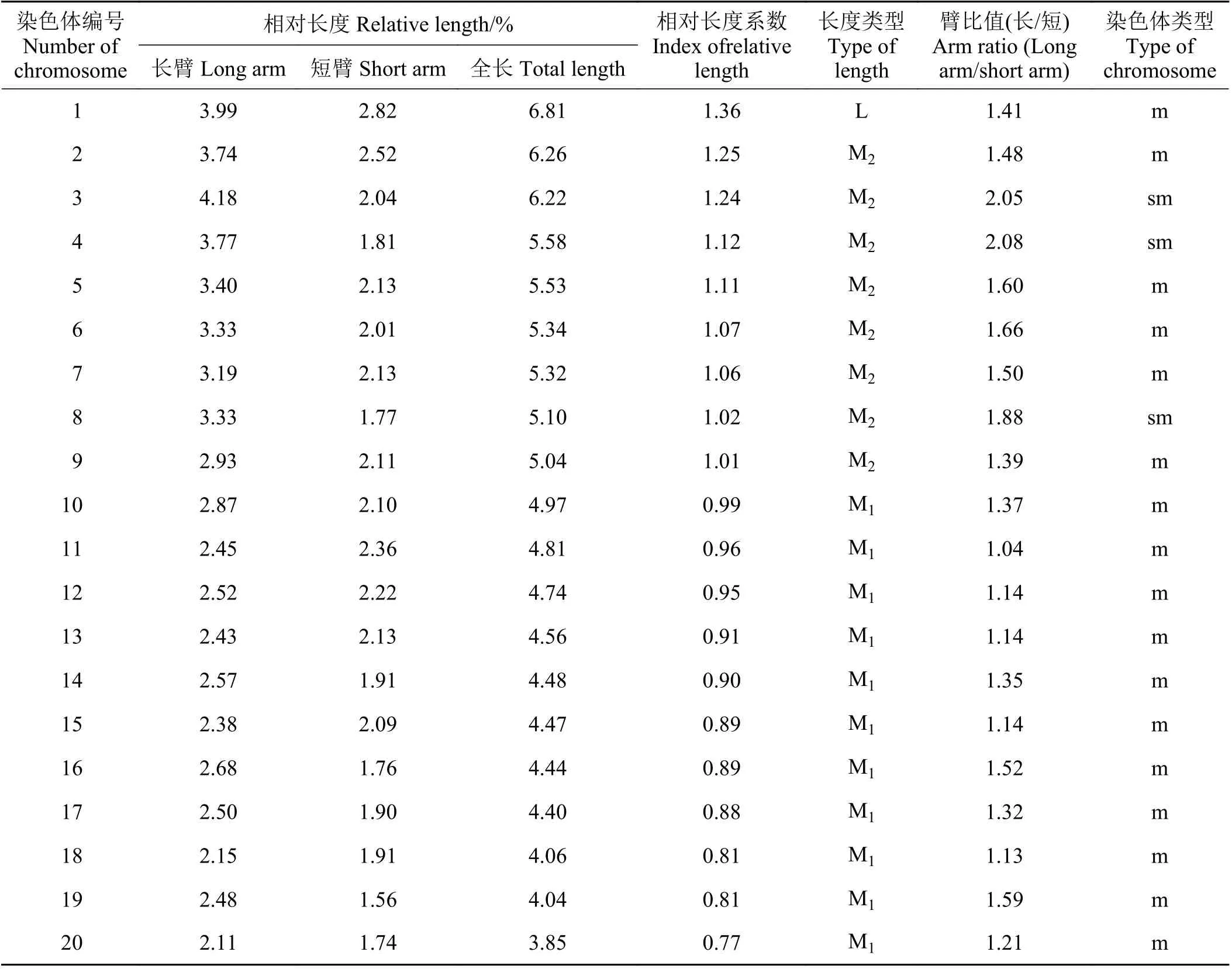
表 2 铺地黍染色体核型参数Table 2 Parameters of the chromosome karyotype of Panicum repens
3 讨论
3.1 铺地黍染色体制片优化效果分析

图 7 铺地黍中期分裂相(A)、染色体核型(B)及核型模式图(C)Figure 7 Chromosomes in the metaphase cleavage phase (A), karyotypes (B), and karyotype models (C) of Panicum repens
在染色体制片过程中,每个过程都可能对染色体的核型参数带来影响[24-25];许多学者也根据不同的物种对染色体制片进行优化[8-14]。良好的染色体制片效果受多方面因素的影响,大量研究表明,预处理条件是染色体制备的关键步骤之一[26]。有研究发现冰水混合物不适合用于山药(Dioscorea oppositifolia)的预处理[27];另有研究发现用对二氯苯饱和溶液和0.003mol·L−18-羟基喹啉将雅砻江冬麻豆(Salweenia bouffordiana)预处理3 h 的中期染色体形态良好,更有利于开展核型分析[28]。本研究通过对铺地黍根尖进行不同预处理发现,置于冰水混合物在4℃条件下预处理2 2 h,染色体凝缩程度适宜、分散良好,其最佳预处理条件与平邑甜茶(Malus hupehensis var.mengshanensis)的研究结果一致[29]。
固定的时间一般为2~24 h,材料小者时间可短,大者可长,大多植物在4℃条件用卡诺氏固定液Ⅰ固定的效果较好[17];也有研究发现青花菜(Brassica oleracea)根尖材料对固定时间没有严格的要求,12~24 h 均可[15]。铺地黍根尖的最佳固定条件是卡诺氏固定液Ⅰ4℃条件固定2 4 h。
有研究将去壁低渗干燥技术的前低渗环节(0.075mol·L−1KCl溶液、25℃、30m in)用于青花菜根尖的压片法[15],另有研究将去壁低渗干燥技术的后低渗(蒸馏水、室温、30m in)加到白姜花(Hedychium coronarium)、金姜花(H. gardnerianum)等姜科植物根尖的压片技术之中,均制得分散良好的染色体装片,且染色效果好,所制染色体图像清晰,易于观察[10]。铺 地黍 在0.075mol·L−1KCl 溶 液于25℃条件下前低渗15~20m in 的效果最佳,可以获得浓缩程度适宜且分散的染色体。
有研究将小麦根尖放入预热的1mol·L−1HCl 中在60℃的水浴锅解离7~8 m in,所得材料最适合制片;而酶解法中使用纤维素酶和果胶酶进行解离时,只需在37℃条件下酶解8 m in 左右就可以得到好的分裂相[30]。也有研究发现用5%纤维素酶和4%果胶酶混合液对尖叶牛樟(Cinnamomum kanehirae)根尖酶解3 h 制片效果最差[25]。对于铺地黍,用1%果胶酶和2%纤维素酶混合酶液于25℃条件酶解3h 效果最佳;用1mol·L−1HCl60℃水浴加热发现,解离10min 就能够去除细胞壁和细胞质,但不易于压片,细胞容易发生重叠,不利于染色体的观察。
3.2 铺地黍染色体数目及核型特征分析
在系统演化上,具有对称核型的植物属于较古老或原始类型,而不对称核型往往出现在进化水平较高或特化的植物中,并且具有较相似核型的物种往往亲缘关系较近。核型不对称系数越接近50%,表明核型的对称程度越高,进化程度就越原始[23,31]。而铺地黍的核型不对称系数为58.99%,接近50%,具有较大的对称性,核型为2A 型,表明铺地黍在进化类型上可能属于原始类型。
一种植物染色体的核型、数目是稳定的,具有自我复制的能力,并且作为决定物种繁衍的遗传物质的载体[32]。但也有学者认为,预处理、固定、酸解离或酶解离、普通压片时对材料施加的外力等各个环节的掌握不同会导致染色体伸长或缩短的程度不同,并且在测量时由于着丝点的位置辨认不清也可能导致长臂与短臂的测量结果不准确;染色体本身结构的差异可能导致同一条染色体有的部位染色深,有的部位染色浅,这些都有可能致使染色体核型出现差异[8]。另外,虽然有些植物对重金属具有一定的耐受性,但当环境中重金属离子超过临界值时,就会对植物的生理生化特性产生很大影响;在自然条件或人工因素的重金属影响下,可能导致染色体变异或DNA 的损伤,染色体变异表现为,一些染色体的数目增加或减少,一些染色体会出现断裂,然后会再一次的异常连接等[33-34]。在本研究中,也发现铺地黍根尖的临时装片在显微镜下观察时有时出现大小差异;在几组核型参数中也发现数据上存在差异,本研究中所使用的铺地黍材料长期在大宝山重金属尾矿地生长,其生长条件[35]是否对其有影响,有待于进一步探究。
4 结论
铺地黍染色体制片的优化条件为:冰水混合物4℃预处理2 2 h,卡诺氏固定液Ⅰ4℃固定2 4 h,0.075mo l·L−1KCl 溶液25℃前低渗15~20m in,用1%果胶酶和2%纤维素酶混合酶液25℃酶解3 h效果最佳。铺地黍核型公式为2n=2 x=4 0=3 4m+6sm,未发现有随体,属于大型染色体;核型不对称系数为58.99%,核型类型属于2A 型,在进化类型上可能属于原始类型。
