糖尿病视网膜病实验动物模型的研究进展
2021-03-11葛文秀孙桂波孙晓波
罗 云,葛文秀,孙桂波,孙晓波
(1.中国医学科学院药用植物研究所,北京 100193;2. 哈尔滨商业大学药物工程技术研究中心,黑龙江 哈尔滨 150076)
国际糖尿病联盟最新统计数据表明,2019年全球约4.63亿20-79岁成人患糖尿病,预计到2045年,糖尿病患者会达到7.002亿;中国2019年患者数量为1.164亿,给国家医疗保障体系及家庭经济负担带来巨大的压力。流行病学数据表明,约有1/3的糖尿病患者晚期会出现糖尿病视网膜病变(diabetic retinopathy,DR),是成年人致盲的原因之一[1]。近年研究表明,持续高血糖首先诱导视网膜神经病变,导致视网膜微血管疾病,如微血管瘤、出血、基底膜增厚[2]。进一步致使血视网膜屏障通透性增加,导致毛细血管堵塞,引起视网膜缺血,引发血管内皮生长因子(vascular endothelial growth factor,VEGF)高表达,促进血管新生,最终导致失明。虽然DR的病理形成过程得到了阐述,但是各个环节确切的病理机制仍不明确。实验动物模型是疾病致病机理以及治疗药物的研究方式之一。本文根据致病诱因综述近几年来所报道的实验动物模型,以期为糖尿病视网膜病研究提供参考。
1 实验动物的选择
目前研究报道最多的是啮齿动物如小鼠、大鼠,小鼠具有与人类遗传、生理特性相似性,易于控制,繁殖迅速,常用于DR的研究;大鼠同样具备价格低廉,容易饲养等优点,也常用于糖尿病并发症的研究。灵长目动物恒河猴等也用于建立DR动物模型。狗的DR形态被认为是与人类最相似,猪与斑马鱼因其与人类有相似的血管和视网膜结构,也被用作DR实验研究。斑马鱼是糖尿病研究中一个新兴的疾病模式动物,它的葡萄糖代谢形成的途径与人类非常相似。同时,斑马鱼还可提供复杂的成像技术,并允许简单和快速的遗传和药理方法与高通量等优点,因此也大量应用于糖尿病并发症动物模型。
2 糖尿病视网膜病实验动物模型
2.1 诱发型动物模型
2.1.1链脲佐菌素(streptozotocin,STZ) 利用STZ建立DR模型较为普遍,最近一篇报道利用该模型证实了C反应蛋白促进视网膜神经退化和视网膜白斑淤积和无细胞毛细血管形成,进而加速DR的形成[3]。梅茜钰等[4]通过连续5 d腹腔注射STZ建立小鼠糖尿病视网膜病模型,并对夏枯草水提物进行了保护作用研究。该模型建立简单易操作,应用量最大,但是模型不太稳定,见Tab 1。
2.1.2四氧嘧啶 连续一周给予白化病小鼠皮下注射四氧嘧啶水合物成功建立1型DR模型,并发现卡马西平能够显著改善DR中视网膜损伤和神经病变[5]。一次性给予C57BL/6小鼠四氧嘧啶成功实现小鼠新生血管显著增加,二甲双胍能够通过抑制VEGF-A减少新生血管[6]。连续3 d给予Wistar大鼠腹腔注射四氧嘧啶水合物,成功建立2型DR模型,并研究了二氢槲皮素治疗DR的药理作用[7]。连续3次给予大鼠腹腔注射四氧嘧啶成功建立早期视网膜病变,并探讨了视网膜和脉络膜细胞结构病理性改变[8]。该模型的主要特征见Tab 2。
2.1.3甲基乙二醛 甲基乙二醛(methylglyoxal,MG)是葡萄糖代谢的中间产物,是糖尿病患者血液或组织中糖基化终产物的前体。Schlotterer等[9]给予雄性Wistar大鼠MG后,成功促使视网膜周细胞丢失,增加无毛细血管数量,减少双极细胞功能等DR特征。研究者利用MG溶液培养斑马鱼胚胎,成功诱导斑马鱼视网膜血管新生,加入VEGFR抑制剂抑制MG的促血管新生作用,证明该模型可用于DR血管新生研究[10]。目前,该模型应用相对较少。其主要特征见Tab 3。

Tab 1 Major features of STZ-induced DR in experimental animal models
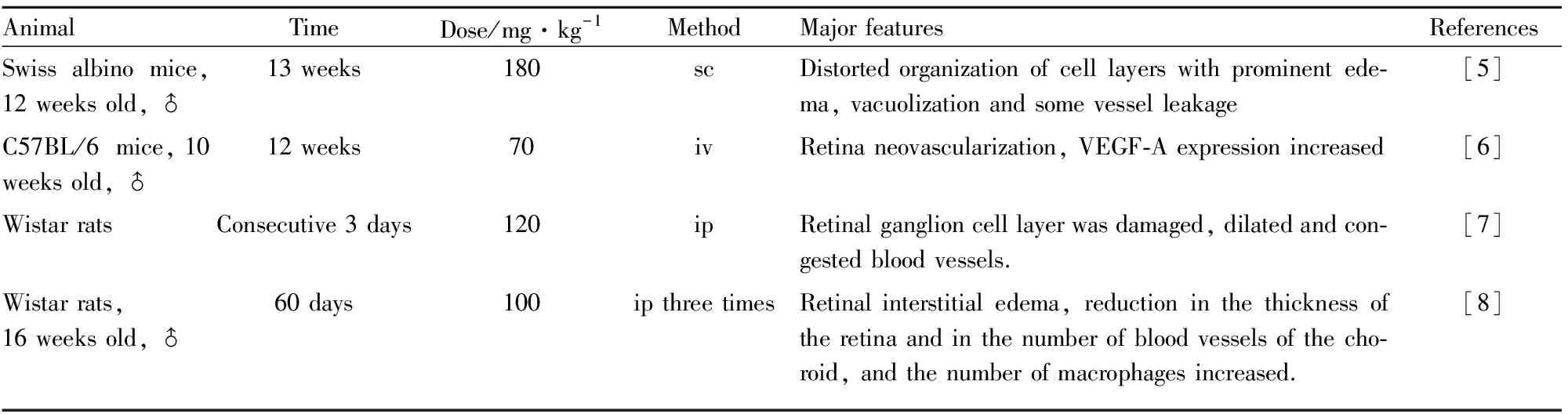
Tab 2 Major features of alloxan-induced DR in experimental animal models

Tab 4 Major features of hyperoxia-induced DR in experimental animal models
2.1.4高氧环境 由于成年啮齿糖尿病动物模型中不利于观察视网膜血管新生,常利用高氧环境建立该病理模型。7日龄小鼠置于密闭的高氧环境连续5 d后,通过检测视网膜血管新生、炎症因子等成功构建DR模型[11]。利用该模型,研究报道了Sema4D/PlexinB1信号通路参与了DR的形成[12]。该模型多用于探讨DR中血管新生机理及其治疗研究,其主要特征见Tab 4。
2.1.5高糖、高脂饮食 利用高脂、高糖饮食,Rithwick等[13]首先报道发现在高脂诱导的DR中视网膜功能性缺陷先于结构性病变。建立小鼠早期DR模型,证明精氨酸酶2及tau蛋白磷酸化在糖尿病视网膜病形成中的重要作用[14-15]。研究还报道了二甲双胍虽然能够降低高脂诱导的小鼠体质量增加和血糖水平,但是不能改变视网膜光反应及阻止视网膜血管新生[16]。Hammoum等[17]利用高脂成功诱导沙鼠2型糖尿病视网膜病实验动物模型。陈镜妃等[18]利用高脂饮食成功建立猕猴早期糖尿病视网膜病变,并证实猕猴视网膜VEGF和色素上皮衍生因子(pigment epithelium derived factor, PEDF)的mRNA表达水平分别上调和下调。利用高糖培养斑马鱼胚胎6 d后,VEGFR和NO表达水平显著增加,成功建立短期DR实验动物模型[19]。Lim等[20]西方饮食饲养Ossabaw猪,建立早期DR小型猪模型。该模型应用较多,且更贴合临床,其主要特征见Tab 5。
2.2 基因型动物模型
2.2.1db/db小鼠 在2014年就有研究表明,db/db小鼠可复制人类糖尿病视网膜的神经退行性过程的特征,因此该小鼠可作为一个合适的实验动物模型来研究糖尿病视网膜神经病变的致病机理及发现治疗药物。利用该模型,罗云等[21]发现中药复方渴络欣具有减缓视网膜神经退变的作用。此模型目前最大的不足之处是未发现视网膜血管渗漏及血管新生等现象,很难使得其与临床DR的分级相对应。
2.2.2Zucker肥胖大鼠(Zucker diabetic fatty,ZDF) ZDF大鼠是一种肥胖型大鼠,大约30年前首次报道ZDF大鼠较对照组大鼠视网膜细胞增多,同时视网膜毛细血管基底膜厚度增加,提示其可作为糖尿病视网膜病药物干预研究模型。近年来进一步证实随着年龄的增加,ZDF大鼠视网膜形态出现退行性改变,视网膜神经节厚度增加,但是细胞核的数量减少;神经胶质细胞激活,GFAP表达水平增加等特征[22]。另外,Szabó等[23]发现32周龄ZDF大鼠出现了神经胶质细胞数量增加,通过视锥蛋白表达模式的改变表明感光层外节段降解,这些特征与1型糖尿病大鼠视网膜病变特征类似。利用ZDF大鼠模型,研究者发现了外周血线粒体DNA损伤是DR形成的一个潜在的生物标志物[24]。该模型可能由于其价格昂贵等因素,还未被普遍使用。
2.2.3斑马鱼 最近一项研究表明,斑马鱼胰腺转录因子pdx1突变体在2月龄时,具有明显的糖尿病视网膜病血管表型;在12月龄时视网膜出现动脉性血管减少、毛细血管弯曲、神经病变以及光感受器受损等病理特征;表明该突变体可作为啮齿动物和其他哺乳动物DR模型的补充,特别是对糖尿病微血管和视网膜神经疾病相互作用的机制研究[25]。斑马鱼因其自身在影像学上的优势,未来其在DR模型中的研究将占有重要的位置。
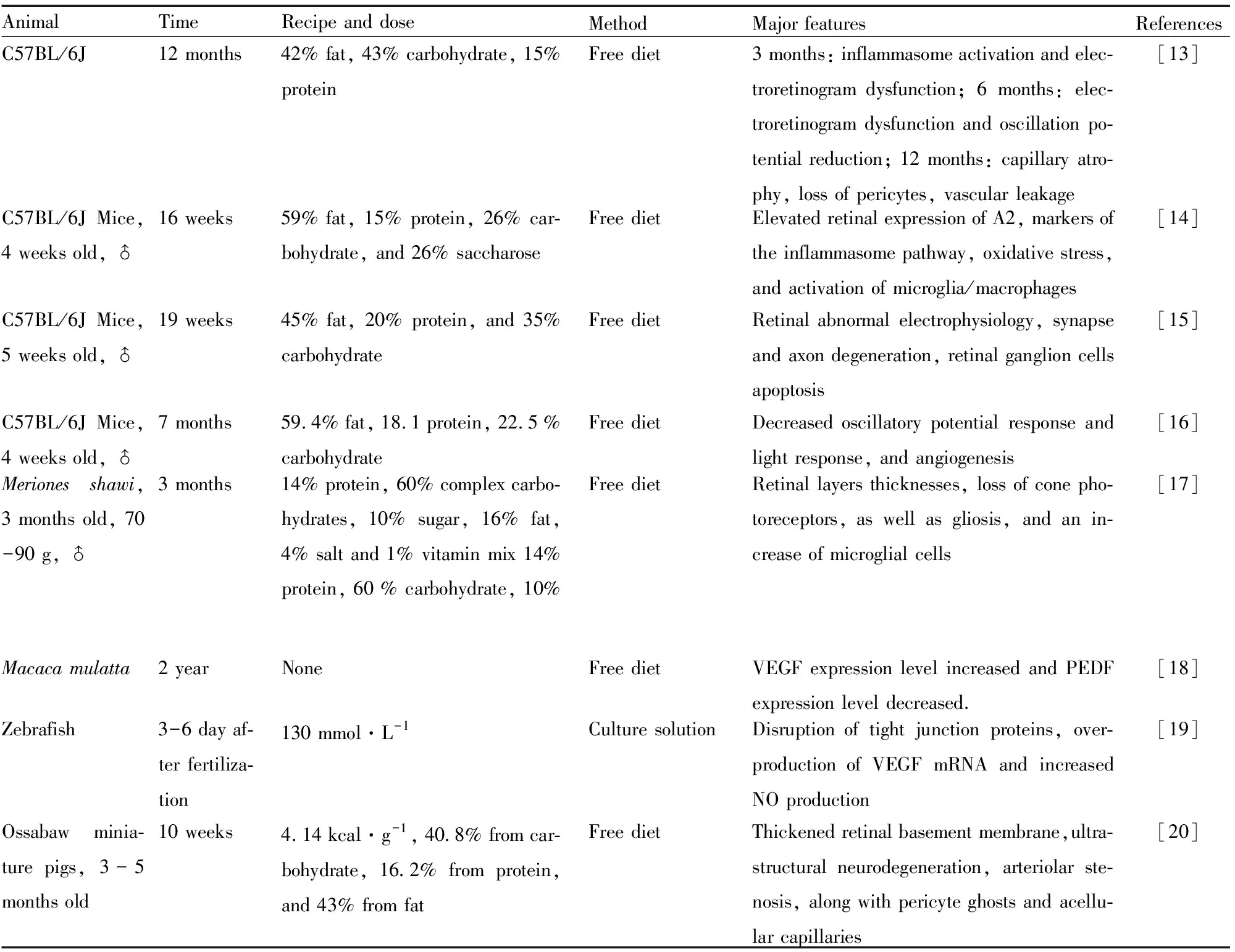
Tab 5 Major features of high-glucose-high-fat diet-induced DR in experimental animal models
3 存在问题及展望
糖尿病视网膜病,因目前仍无彻底根治的方法给糖尿病患者及其家庭带来了巨大的经济负担和精神压力。尽管雷珠单抗和康柏西普类药物在临床治疗糖尿病黄斑变性已经有很好的疗效,但是DR患者数量仍然未得到显著改善,未满足临床需求[26-27]。糖尿病视网膜病实验动物模型在DR的发展及药物治疗研究中扮演至关重要的作用。DR是一种复杂的多因素影响的疾病,其实验动物模型的建立相对困难。总体来看,近些年主要以STZ诱导较多,同时基因型小鼠因其血糖相对稳定也运用较多;ZDF大鼠能看出血管渗漏,但因其价格昂贵目前应用还相对较少;斑马鱼虽然有其优势,但是由于与哺乳动物相差较大只能作更为基础的研究或前期药物筛选。另外,由于模式动物如斑马鱼,以及基因敲除实验动物模型的兴起,胰岛切除、碱烧伤等传统操作难、死亡率高等缺点的实验动物模型近几年已经不再使用;恒河猴因其特殊饲养条件及成本高等,该模型也逐渐淘汰。
目前的实验动物模只具有DR临床某种或某几种特征,如果要评价血管新生只能用新生鼠高氧诱导模型,这些不足导致无法与临床糖网指南里的分级相对应。因此未来DR实验动物模型应该结合其中几种特征,以建立与临床更接近的疾病特征。例如,通过STZ与转基因结合,或许可以建立既有神经病变等特征还能看见视网膜血管新生。更为重要的是,DR实验动物模型主要集中于糖尿病早期阶段的特征,而不具有晚期糖网的临床特征;目前常用的模式动物(大鼠、小鼠、斑马鱼)眼睛没有黄斑区,这些都限制了DR形成机制及药物治疗研究。
总之,虽然近些年通过不同方法构建了DR实验动物模型,但还是存在稳定性不高、特点单一等问题。因此,必须秉承动物模型研究真实性、稳定性、可行性、经济性等原则,继续优化模型的构建方法,利用视网膜相干断层扫描、视网膜造影等科研设备,利用表型与机制相结合的方式,加大模型的研发力度,构建出更加贴近临床实际的国际公认的糖尿病视网膜病模型。
