光强对欧洲舌齿鲈稚鱼眼组织基因表达的影响
2021-03-11吴禹濛姜洁明任星月姚安琪宋昌斌闫红伟
吴禹濛 , 袁 震 , 姜洁明 , 张 磊 , 任星月 姚安琪 宋昌斌,闫红伟 , 刘 鹰 ,
(1. 大连海洋大学, 辽宁 大连 116023; 2. 设施渔业教育部重点实验室, 辽宁 大连 116023; 3. 中国科学院半导体研究所, 北京 100083; 4. 青岛海洋科学与技术试点国家实验室, 山东 青岛 266237)
光照是影响鱼类生长发育中的重要因素, 它对鱼类摄食、生长、发育和繁殖等都有一定影响[1-2]。光照的三要素为光照强度、光谱和光周期[3]。不同鱼类和鱼类发育的不同阶段对光照强度的需求均存在差异, 如 Vander 等[4]研究了光照强度对大西洋鳕(Gadus morhua)生长的影响, 结果显示高光照强度下大西洋鳕生长更快、存活率更高。谢从新等[5]也发现随着光照强度的增大, 乌鳢(Channa argus)幼鱼的摄食强度逐渐减小。一般认为, 大多数海水鱼靠视觉进行摄食, 无论其与食物的距离长短, 视觉在捕食过程中均非常关键, 在水产养殖中与鱼类视觉系统匹配的照明条件可以增加其对饵料的辨识度, 缩短搜索食物时间并最终促进生长和提高存活率[6-7]。研究证实, 光照强度对不同鱼类的影响具有差异[8-9], 光照强度过低或过高, 会影响鱼类的摄食行为, 从而对生长产生胁迫[10-13]。有研究表明光照强度会影响鱼类的视觉系统, 将白化斑马鱼(Danio rerio)和白化虹鳟(Oncorhynchus mykiss)饲养在连续强光照射条件下, 发现其视网膜受到光损伤, 主要表现为感光层细胞的凋亡[14]。即使是对外界光胁迫抵抗能力较高的体色正常的鱼类, 如欧洲舌齿鲈(Dicentrarchus labrax)、大西洋鳕和大西洋鲑(Salmo salar), 24 h 持续照明条件下, 它们视网膜的感光层会变薄[15]。因此,鱼类在过高的光照强度下, 其视觉会受到损害, 进而有可能影响其摄食行为和生长。
在前人的研究中发现, 在蓝光照射下, 金鱼(Carassius auratus)的TUNEL 测定结果显示, 视网膜有大量的细胞凋亡, 另外黑色素浓缩激素(melanin concentration hormone, MCH) 和半胱天冬酶-3(caspase-3)基因表达上调, MCH-R mRNA 的表达随着蓝光暴露和强度的增加而显着增加, 增加视网膜黑色素聚集, caspase-3 是广泛用于细胞凋亡的指标,是细胞凋亡的核心作用酶, 以上两个基因上调表明蓝光照射下会对视网膜造成损伤, 这与TUNEL 测定结果相符[16]。而在另一项关于金鱼的研究表明, 在绿光处理下更有利于维持视网膜的稳定, 增强视网膜细胞的再生[17]。但光照强度对鱼类视网膜内基因表达的影响还未见报道。
欧洲舌齿鲈, 或称舌齿鲈、狼鲈, 隶属鲈形目(Perciformes) 、 狼 鲈 科(Moronidae) 、 舌 齿 鲈 属(Dicentrarchus)[18], 欧洲舌齿鲈的含肉率高、营养价值高、抗病力强、适宜池塘和工厂化循环水养殖[19],是欧洲商业化养殖的第一个非鲑科海水鱼类, 是欧洲和地中海区域水产养殖业中的重要经济鱼类[20]。2010 年, 中国科学院海洋研究所刘鹰研究员率先于2010 年将其引种到我国进行人工养殖, 并于2014 年突破其苗种繁育技术[21]。为探究光照强度是否会影响欧洲舌齿鲈稚鱼的视觉系统, 本研究以孵化后30 d 的欧洲舌齿鲈作为研究对象, 在白光2.0 W/m2(W 2.0)、1.0 W/m2(W 1.0)和0.3 W/m2(W 0.3)条件下对其进行为期66 d 的养殖实验。实验结束后比较了3 组稚鱼的体长、湿重和存活率, 根据结果构建了W 2.0 和W 0.3 两组稚鱼眼组织的转录组文库并进行了高通量测序, 以期为查明光照强度对鱼类生长和视觉的影响机制提供基础数据, 并为养殖生产者提供参考。
1 材料和方法
1.1 实验材料
本实验所用欧洲舌齿鲈(孵化后30 d, 体长12.52±1.34 mm, 湿重92.35±4.77 mg)由大连富谷水产有限公司提供。
1.2 方法
1.2.1 养殖与光处理
首先将上述欧洲舌齿鲈稚鱼随机放置到 9 个100 L 圆柱形桶(桶高62 cm)中, 每桶养殖密度为700 尾, 养殖周期为66 d。根据鱼类生长情况投喂卤虫无节幼体(孵化后第30 至40 d)和卤虫成体(孵化后第41 至96 d), 每天投喂6~8 次, 每次饱食投喂,投喂前均使用强化剂(50 DE 微囊, 山东省升索渔用饲料研究中心)强化卤虫无节幼体。每天各养殖水桶统一换水数次, 并清洁养殖容器, 去除残饵粪便与死亡幼体。保持各养殖水桶中盐度为 33, 温度为18.5~19.5℃溶氧为8 mg/L 以上, pH 7.9~8.1, NH4-N <0.2 mg/L, NO2-N < 0.05 mg/L。
本实验采用人工LED 光源(深圳市超频三科技股份有限公司)照明, 共设置3 种不同的光照处理组(3种光照强度)来开展养殖实验, 包括0.3 W/m2、1.0 W/m2和2.0 W/m2的白光(表示为: W 0.3, W 1.0, W 2.0)。由可调节光强的3 盏LED 灯提供光照, 每个光照处理组设置3 个养殖平行(共在9 个养殖水桶中开展实验)。采用不透光的灰色幕布将2 个处理组进行隔离并防止外界光线的影响, 且每天使用光谱辐射分析仪(PLA-20, 杭州远方光电信息股份有限公司)在水面上进行测试一次, 确保实验期间光环境的稳定。
1.2.2 生长数据计算
在实验结束时随机每组选取20 尾稚鱼, 冰上低温麻醉后, 测定其体长和湿重。每天计数表面和底部死亡鱼的个数, 存活率的测定参考Yan 等的研究[22]。
1.2.3 RNA 提取
根据生长数据结果, 为保证试验数据可靠性,另取W 0.3 和W 2.0 组的稚鱼麻醉(20 尾/桶), 于低温条件下分离眼组织, 放入装有RNA later 的离心管中,之后在–80℃超低温冰箱中进行保存。眼组织的总RNA 的提取采用RNeasy Mini Kit 试剂盒(Qiagen, 德国), 根据说明书操作。采用Agilent 2100 生物分析仪和Nanodrop ND-1000 分光光度计检测RNA 的质量和浓度。
1.2.4 基因文库构建及转录组分析
样品检测合格后, 将之前提取的总RNA 等量混合, 送样至北京诺禾致源生物有限公司进行文库构建和转录组测序。
测序产生的数据(reads)作为原始数据(raw data),将带接头的、低质量的reads 过滤除去进而得到高质量可用数据(clean reads)。利用组装软件Trinity 对获得的高质量测序数据进行序列组装。
通过BLASTX 将转录本与NCBI、SwissProt、KEGG、GO、COG、KOG、EggNOG、Pfam9 个数据库比对。利用Blast2 GO 软件进行基因本体(GO)注释, 并使用TopGo 进行富集分析。序列也进一步与COG 和EggNOG 数据库进行比对, 并对基因序列进行功能预测和功能分类。利用 Perl script 进行KEGG 通路的富集对基因产物在细胞中的功能及其代谢途径进行系统分析。通过在线KEGG 自动注释服务(KAAS), 可以得到的每条序列的京都基因与基因组同源体系分析(KO)注释, 并映射到相应的KEGG 通路中。
1.2.5 差异表达基因的鉴定
利用FPKM 值表示对应非重复序列基因(unigene)的表达丰度。FPKM 计算公式如下:
每一百万个map 上的reads 中map 到外显子的每1K 碱基上的Fragments 个数(FPKM)=cDNA 片段(cDNA fragments)/图谱片段(百万)[mapped fragments(millions)]/转录长度[transcript lengths (kb)]。
筛选差异表达基因的标准为错误发现率(False Discovery Rate, FDR)≤0.01 和差异倍数(log2fold change, FC)>1。
1.2.6 实时定量PCR
为了验证转录组数据的正确性, 采用实时定量PCR 检测晶状体纤维主要固有蛋白、视黄醇结合蛋白3、维生素A 脱氢异构酶、热休克同源70、伸长因子1-α 和葡萄糖-6-磷酸异构酶6 个基因的表达。引物使用Primer Premier 5.0 软件进行设计(表1)。以提取的眼组织的 RNA 为模板, 按照 SYBR FAST qPCR Kit Master Mix(2×)试剂盒说明书合成cDNA,然后以其为模板, 以β-actin 为内参基因进行实时定量PCR 扩增(Applied Biosystems 7900 HT Real-TimePCR仪)。PCR 条件为: 95℃, 5 min; 95℃, 3 s 和60℃, 20 s共40 个循环[23]。

表1 引物序列Tab. 1 Sequences of the primers used for PCR amplification of differentially expressed genes in Dicentrarchus labrax
1.2.7 统计分析
实时荧光定量数据以2–ΔΔCT法处理。采用统计软件IBM SPSS 22.0(IBM, Armonk, NY, 美国)中的t检验分析眼内的基因表达的显著性差异, 使用Duncan 检验两个不同光照组之间稚鱼体长、湿重和存活率, 显著性设定为P<0.05 和P<0.01。
2 结果
2.1 不同光强的白光对欧洲舌齿鲈稚鱼生长的影响
在实验结束时, W 2.0 组稚鱼的体长和湿重显著小于W 0.3 和W 1.0 处理组下饲养的稚鱼(P< 0.05),但三组欧洲舌齿鲈稚鱼的存活率无显著性差异(P>0.05)(图1)。
2.2 转录组测序与组装
经Illumina Hiseq 2500 测序, W 0.3 处理组获得raw reads(统计原始序列数据) 50 907 730 个, W 2.0处理组获得raw reads 50 265 736 个; W 0.3 处理组获得clean reads 50 273 392 个, W 2.0 处理组获得clean reads 49 277 200 个; W 0.3 处理组获得clean bases(测序序列的个数乘以测序序列的长度) 7.54 GB, W 2.0处理组获得clean bases 7.39 GB。

图1 W 0.3、W 1.0 与W 2.0 组欧洲舌齿鲈稚鱼的湿重、体长和存活率Fig. 1 Wet weight, body length, and survival rate of Dicentrarchus labrax juveniles in the W 0.3, W 1.0, and W 2.0 groups
2.3 差异表达基因筛选及其功能富集分析
根据两个RNA 样本基因的差异表达丰度来做差异表达分析。如图2 所示, 共得到的差异表达基因有368 个, 与W 0.3 组相比, W 2.0 组中234 个基因上调表达, 134 个基因下调表达(图2)。

图2 W 0.3 与W 2.0 组欧洲舌齿鲈稚鱼眼内差异表达基因的火山图Fig. 2 Volcano plot of differentially expressed genes in the eye of D. labrax between the W 0.3 and W 2.0 groups
在筛选得到的差异表达基因中, 晶状体纤维主要固有样蛋白(MIP),晶状体纤维膜固有蛋白(lens fiber membrane intrinsic protein), 晶状体纤维膜固有蛋白(lens fiber membrane intrinsic protein), 晶状体纤维膜固有蛋白样亚型X1(lens fiber membrane intrinsic protein-like isoform X1)等, rho 相关的btb 结构域, 包含蛋白 2 样亚型 X1(rho-related BTB domain-containing protein 2-like isoform X1), 胰岛素样生长因子结合蛋白1(insulin-like growth factor-binding protein 1), 维生素A 脱氢异构酶(RPE65)等均在W 2.0 组出现了上调(表2)。
对得到的368 个差异表达基因进行GO 分析发现, 差异表达基因主要富集在分子功能(MF)和生物学功能(BP)上。其中在MF 上差异表达基因主要分布在细胞黏附(cell adhesion)、生物黏附(biological adhesion)、磷酸化(phosphorylation)等通路上。而在BP上差异表达基因主要分布在葡萄糖-6-磷酸异构酶激(glucose-6-phosphate isomerase activation)、分子内氧化还原酶(intramolecular oxidoreductase), 且分布较少(图3)。
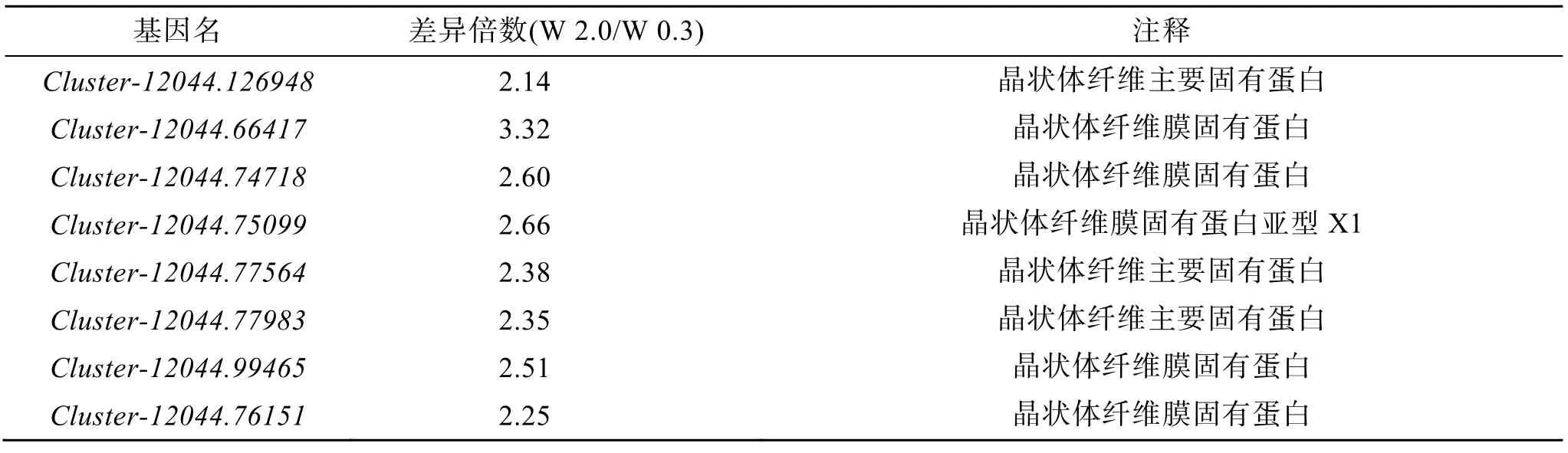
表2 W 0.3 与W 2.0 组欧洲舌齿鲈眼内代表性的差异表达基因Tab. 2 Differentially expressed genes in the eye of D. labrax between the W 0.3 and W 2.0 groups

续表

图3 W 0.3 与W 2.0 组欧洲舌齿鲈眼内差异表达基因的GO 富集分析Fig. 3 GO enrichment analysis of differentially expressed genes in the eye of D. labrax between the W 0.3 and W 2.0 groups
KEGG富集分析结果如图4所示, 差异基因富集在碳代谢(carbon metabolism), 乙醛酸盐和二羧酸盐代谢(glyoxylate and dicarboxylate metabolism), RNA转运(RNA transport), 氧化磷酸化(oxidative phosphorylation), 三羧酸循环 TCA 循环(citrate cycle TCA cycle), 淀粉和蔗糖的代谢(starch and sucrose metabolism), 军团杆菌病(legionellosis), 磷酸戊糖途径(pentose phosphate pathway)等20 个通路上。在这些通路中, RNA 转运、核糖体、氧化磷酸化和碳代谢上差异表达基因的分布相对较多。
2.4 qPCR 结果
对得到的6 个差异表达基因进行验证, 结果显示在W 2.0 组稚鱼眼内MIP、HSC70、 RBP3、RPE65、EF1A 和GPI 基因的表达都显著高于W 0.3 组稚鱼(P<0.05, 图5), 这与转录组结果一致。
3 讨论

图4 W 0.3 与W 2.0 组欧洲舌齿鲈眼内差异表达基因的KEGG 富集分析Fig. 4 KEGG enrichment analysis of differentially expressed genes in the eye of D. labrax between the W 0.3 and W 2.0 groups

图5 W 0.3 与W 2.0 组欧洲舌齿鲈眼内6 个基因表达Fig. 5 Expression of six genes in the eye of D. labrax between the W 0.3 and W 2.0 groups
许多海洋鱼类靠视觉觅食, 并且需要一个最低光照强度阈值; 但是对高光强影响稚鱼视觉, 进而影响其摄食和生长, 目前关于这方面的认识仍然不足。前人的研究主要集中在光照条件对眼睛, 尤其是视网膜的组织学上的观察, 而对眼内基因的相关性表达产生的影响的报道少之又少。Bayarri 等人研究发现影响欧洲舌齿鲈眼睛视网膜敏感性光阈值为0.06 W/m2[24], Villamizar 等人设置光照强度为0.42 W/m2,使欧洲舌齿鲈眼睛和血浆中褪黑激素含量产生变化[25]。在本研究中, 我们的研究任务是查明当光照强度增加时, 欧洲舌齿鲈稚鱼的生长、存活和视觉是否受到影响。因此我们将稚鱼分别暴露于0.3 W/m2、1.0 W/m2和2.0 W/m2这3 个光照强度下, 形成3 个处理组。实验结束时, 在光照强度为2.0 W/m2下饲养的稚鱼的平均体长、湿重均显著小于1.0 或0.3 W/m2下饲养的稚鱼(P<0.05), 而1.0 和0.3 W/m2光照强度下饲养的稚鱼平均体长无显著差异(P>0.05), 3 个处理组之间的存活率无显著性差异(P>0.05)。前人研究证明, 漠斑牙鲆(Paralichthys lethostigma)暴露于100 lx的光照强度以下时生长和存活率都有所降低[26]。金头鲷(Sparus aurata)在中等强度下生长较好, 可能是由于这种光强下会刺激视网膜上的色素, 增加其辨别猎物的能力[27]。加州鲈鱼(yellow perch)的反应距离,随着光强的降低而逐渐降低, 当光强度下降到小于2 lx 时, 最大平均反应距离显著下降, 在黑暗中最小反应距离减小[28]。另在禽类中, 光照强度在1~65 lx,对鸡的生长没有影响, 而在130~290 lx 的光照下会抑制鸡的生长[29]。由此可见, 因不同物种的生活环境不同, 其对光强的适应范围各有不同, 过低或者是过高的光强都会对其生长产生影响。因此, 在养殖生产中, 了解鱼类生长所需的合理光照强度至关重要。
一般认为大部分海水鱼是通过视觉来摄食, 在W 2.0 组稚鱼的生长较差, 可能是因为2.0 W/m2对鱼类来说属于高光强, 高光强可能会影响其视觉, 进而对其生长产生影响。与高等脊椎动物相比, 多数鱼类的眼睛无眼睑, 不能调节瞳孔大小来控制入射视网膜的光强度, 所以在高光强下鱼类的视网膜更容易受到伤害[30]。研究表明, 将大西洋鳕、大西洋鲑和欧洲舌齿鲈置于24 h 高光强照明条件下, 它们的视网膜会受到损伤[15]。我们前期研究中发现, 24 h 连续照明条件下, 欧洲舌齿鲈稚鱼的视网膜各层厚度会受到影响, 且感光层均会受到不同程度的损伤, 相比W 0.3 组, W 2.0 组稚鱼的视网膜感光层受损更为严重, 除视杆细胞的损伤外, 我们还发现视锥细胞外节出现缩短的现象, 在肿胀的内节里出现细胞核溶解, 这是一种细胞坏死的标志[22]。研究发现, 光诱导的光感受器细胞损伤是从外节末端开始的, 这表明外节层是最先遭受损伤的, 损伤的严重程度和膜盘的更新速度有关[31]。赵颖熙研究发现, 高光强可以引起豚鼠眼球眼轴增长减缓, 对视网膜光感受器造成轻微损伤[32]。然而, 即使在哺乳动物中, 光照对视网膜造成的损伤的分子机制依旧不是十分清楚。
在本研究中, 以高通量测序为研究手段, 构建了W 0.3 和W 2.0 两组稚鱼的眼转录组文库, 并筛选不同处理组之间的差异表达基因, 以期从分子水平来解释光照强度对欧洲舌齿鲈视觉的影响。结果表明, 共获得在W 2.0 和W 0.3 组稚鱼眼内差异表达的基因368 个, 与W 0.3 组相比, W 2.0 组中234 个基因上调表达, 134 个基因下调表达。在这些差异表达基因中, 我们发现, MIP、RBP、RPE65、HSC70、EF1A和GPI 6 个基因均在W 2.0 组高表达。这说明, 这些基因的上调可能是对光照强度的响应, 进而影响欧洲舌齿鲈稚鱼的视觉。
其中我们筛选得到的MIP 为水通道蛋白的一种,主要在晶状体纤维细胞及视网膜中表达[33]。截至目前, 已经在植物、原生生物和脊椎动物中发现超过200 种水通道蛋白[33]。众所周知, 人体内大部分器官,如肝、肾、眼等依赖于渗透压调节来维持各自的生理功能, 所以水分对传递视觉信息, 视网膜成像起着至关重要的作用[33]。MIP 同时也具有结构性链接功能, 它与晶状体正常代谢及透明度的维持密切相关。近年来的研究发现, MIP 也与白内障的发生密切相关[33]。而白内障是由于晶状体病变而引起的疾病,晶状体在正常状态下是透明的, 因不同原因引起的晶状体蛋白变性、水肿、纤维之间出现空泡, 上皮细胞增生等, 从而使晶状体透明性减弱, 阻碍光线入射眼内, 形成白内障, 进而影响视力[34-35]。HSC70 是1999 年Ballinger 等[36]发现的具有辅助伴侣分子和泛素连接酶功能的蛋白质, 可以通过其氨基端连接热休克蛋白调节蛋白质的重新折叠, 同时通过其羧基端连接蛋白酶体促进底物的降解[37]。HSC70 在所有的器官内几乎均有表达, 但在代谢效率较高亦或是蛋白质更替较快的器官或组织中, 如骨骼肌、心脏和脑中高表达, 在胰腺、肺、肝、胎盘和肾脏中的表达水平相对较低[37]。在正常情况下, HSC70 参与维持蛋白质的空间构象, 起到细胞骨架等基本功能。可当细胞面临胁迫时, 生物体会大量表达HSC70 用于阻止变性蛋白质的的积累, 增加细胞的抗逆和保护机制[38]。维生素A 由视黄醇(维生素A1)和3-脱氢视黄醇(维生素A2)组成, 两者均为20 碳的白芷酮环多烯烃一元醇, 在动物体内, 其多存在于肝脏中[39]。在前人的研究中发现, 维生素A 是构成视觉细胞内感光物质的成分, 是维持上皮组织健全所必须的物质,其不足时会引起维生素A 缺乏综合征, 如眼部视网膜血管炎[40]、夜盲症和干眼症[41]。在我们筛选的基因中, 我们发现, RBP3 和RPE65 两者均在W 2.0 组稚鱼高表达, 而RBP 是维生素A 的运载蛋白, 在协助维生素发挥生理功能中起着不可替代的作用[42]。综上, 与W 0.3 组相比, 在W 2.0 组中, 上述基因在眼睛组织中的表达水平上升, 可能是因为该光照条件对稚鱼视觉系统造成了胁迫, 其作用机制尚需进一步研究。GPI 又被称为磷酸葡萄糖异构酶, 在所有真核生物和原核生物的细胞中普遍存在, 是一类具有多功能生物活性的天然蛋白质[43], 它参与糖代谢的糖酵解作用[44]。光电能的转换是视网膜组织的重要功能之一, 这种转换过程需消耗大量的能量。这种能量的来源主要是依靠葡萄糖的酵解获得[45]。因此,W 2.0 组稚鱼的光电能的转换速率可能增加, 进而使葡萄糖-6-磷酸异构酶表达水平升高。
4 结论
本研究以欧洲舌齿鲈稚鱼为研究对象, 在白光光照强度为2.0 W/m2、1.0 W/m2和0.3 W/m2的条件下对其进行养殖。实验结束后比较了3 组稚鱼的体长、湿重和存活率, 且构建了W 0.3 和W 2.0 两组稚鱼眼组织的转录组文库并进行了高通量测序。研究发现白光饲养条件下, 高光照强度会抑制欧洲舌齿鲈稚鱼的生长, 这可能是由于高光照强度会对其视觉产生影响进而影响其摄食活动和生长。
