结核性与恶性胸腔积液中微小核糖核酸内参基因筛选的初步研究
2021-03-11董静贾红彦孙琦李自慧魏荣荣杜博平邢爱英潘丽萍张宗德
董静 贾红彦 孙琦 李自慧 魏荣荣 杜博平 邢爱英 潘丽萍 张宗德
结核性胸膜炎是病理性胸腔积液形成的主要原因之一[1]。由于其临床表现不典型,需病原学检测来确诊。但目前胸腔积液的多种病原学检测方法的临床应用均不理想,如分枝杆菌抗酸染色和BACTEC MGIT 960快速液体培养的阳性率均较低,仅为10%和20%左右;γ干扰素释放试验难以区分结核分枝杆菌潜伏感染,特异度较低[2];穿刺活检和胸腔镜活检病理学检查虽可使阳性率提升至56%以上,但患者难以耐受侵入式检查,并发症较多,对医生操作水平和设备的要求也较高[3];而新一代实时荧光定量核酸扩增检测(GeneXpert MTB/RIF Ultra)技术也对30%~50%的疑似患者无法确诊[4-6]。临床亟需有效的新型检测方法。
微小核糖核酸(miRNA)是一类长度为19~25个核苷酸的非编码单链RNA分子[7-8],主要通过3′UTR区完全或不完全互补配对,结合相应靶mRNA 来抑制相应蛋白质的翻译[9]。相对于蛋白和长链RNA,miRNA具有抗酸、抗碱、抗核糖核酸酶,反复冻融不易降解的稳定性质[10],且已被大量研究证实,miRNA的动态变化与疾病的发生发展和转归有着十分密切的关系[1, 11-12]。但胸腔积液中miRNA含量较少、丰度偏低、缺乏公认的可相对定量检测的内参基因,阻碍了对胸腔积液中miRNA的相关研究[1]。为评估胸腔积液中miRNA内参基因定量检测的可行性,本研究选取了7个应用频次较高的定量检测胸腔积液及其他体液中miRNA表达量的内参基因,通过geNorm、NormFinder和BestKeeper软件分析并了解其在胸腔积液标本中定量检测的稳定性和表达丰度,为后期研究胸腔积液miRNA的动态变化与疾病的发生发展和转归关系提供基础支撑。
对象和方法
一、研究对象
搜集2016年9月至2018年12月在首都医科大学附属北京胸科医院经胸腔积液常规生化和涂片镜检、核酸检测、细菌和真菌培养、分枝杆菌改良罗氏培养,以及细胞学、病理学、胸部CT扫描等检查结果确诊治疗的47例结核性胸膜炎患者和31例并发胸腔积液的癌症患者作为研究对象。所有入选患者均排除HIV感染、乙型和丙型病毒性肝炎、梅毒螺旋体感染、妊娠,以及有免疫抑制剂用药史、结核病病史和结核病密切接触史者。
78例患者中,男51例(65.4%),女27例(34.6%);年龄25~88岁,年龄中位数(四分位数)为60(30,68)岁。其中,结核性胸膜炎患者中,男35例(74.5%),女12例(25.5%);年龄18~86岁,年龄中位数(四分位数)为46(25,64)岁;胸腔积液分枝杆菌培养阳性15例(31.9%)、涂片抗酸杆菌染色阳性5例(10.6%)、PCR扩增结核分枝杆菌基因保守序列检测阳性12例(25.5%)、GeneXpert MTB/RIF检测阳性14例(29.8%),GeneXpert MTB/RIF和PCR扩增结核分枝杆菌基因保守序列同时阳性1例(2.1%)。并发胸腔积液的癌症患者中,男16例(51.6%),女15例(48.4%);年龄38~88岁,年龄中位数(四分位数)为65(59,69)岁;经组织病理检测和既往病史确诊腺癌(包括腺癌转移)21例(67.7%),其他类型癌症(包括鳞癌、小细胞肺癌、间皮瘤肺转移、霍奇金淋巴瘤肺部转移等)10例(32.3%)。本研究通过首都医科大学附属北京胸科医院伦理委员会批准[(2020)年临审第(2号)]。
二、研究方法
1.miRNA内参基因的选择:选择胸腔积液及其他体液中用于miRNA表达量定量检测应用频次较高的5个内参基因(包括miR-16、miR-20a、miR-192、U6、Cel-miR-39)[7, 13-14],以及前期研究中高通量筛选获得的2个稳定表达的miRNA(包括miR-1268和miR-4281)。
2.标本收集与处理:留存每例研究对象常规检测后的胸腔积液标本2 ml,4 ℃下2000×g离心10 min,再经16 000×g离心10 min,吸取上清,根据实际情况分装,每管200 μl,-80 ℃冻存备用。另采集2例患者胸腔积液标本各1 ml,各等分为5管,其中1管采集后直接如上离心处理,另3管采集后分别放置1 h、2 h、4 h后如上离心处理,最后1管反复冻融2次后如上离心处理。5管处理后均于-80 ℃冻存备用,用以分析放置不同时间及2次冻融后胸腔积液内miRNA内参基因表达量的变化比较。
3.RNA提取:采用miRNeasy Serum/Plasma kit血液/血浆RNA提取纯化试剂盒(德国Qiagen公司,批号:217184)提取胸腔积液标本中的RNA。操作步骤如下:取200 μl胸腔积液标本,加入1 ml RNA提取试剂,室温放置5 min,再加入3.5 μl Spike-In control工作液(德国Qiagen公司,批号:219610,5.6×108拷贝,2.67×10-1pmol/ml)和200 μl三氯甲烷,振荡15 s,放置2 min,4 ℃环境下12 000×g离心15 min,弃上清,加入1.5倍体积的无水乙醇,置于试剂盒配套的收集柱内,10 000×g离心15 s,先后经洗液Ⅰ、洗液Ⅱ和80%乙醇洗涤,收集RNA。再以微量紫外分光光度计(Nanodrop 2000)测定RNA含量。为分析同1例患者的2份胸腔积液标本中miRNA定量检测的一致性,从上述标本中任意挑选5例患者的2管200 μl胸腔积液标本,进行如上操作,以测定重复标本miRNA检测的一致性。
4.加尾法逆转录:按照miScript Ⅱ RT Kit反转录试剂盒(德国Qiagen公司,批号:218161)配套说明书进行如下逆转录操作:取4 μl高特异性反转录缓冲浓缩液(5×miScript HiSpec缓冲液)、2 μl核酸混合物浓缩液(miScript nucleics mix)、2 μl反转录酶(miScript reverse transcriptase mix)、100 ng RNA和适量无酶水(RNase-free ddH2O)组成20 μl反转录体系。37 ℃孵育60 min,95 ℃灭活5 min,完成反转录,产物于-80 ℃保存。
5.PCR预扩增检测:按照miScript PreAMP PCR Kit预扩增PCR试剂盒(德国qiagen公司,批号:331452)说明书进行预扩增,其中,7个待检miRNA引物均购自德国Qiagen公司。操作步骤如下:取待检测miRNA的引物浓缩液各10 μl,混合并稀释至工作液,制成引物混合物备用。按说明书配置成25 μl预扩增反应体系,在Mycycler普通PCR仪上(美国Bio-Rad公司)设置反应程序如下:95 ℃ 15 min,94 ℃ 30 s,60 ℃ 3 min,循环12次。
6.实时荧光定量PCR检测和熔解曲线分析:使用miScript SYBR Green PCR Kit实时荧光定量PCR试剂盒(德国Qiagen公司,批号:218073),按照说明书配置20 μl扩增体系。程序设置为:95 ℃ 15 min,94 ℃ 15 s,55 ℃ 30 s,70 ℃ 30 s,循环40次,在Thermofisher Quantistudio 7实时荧光定量PCR仪(美国赛默飞世尔公司)上完成。根据扩增曲线得到引物扩增效率和miRNA的内参基因表达量[循环阈值(Ct值)]。Ct值越低,表示基因表达量越高,基因表达的丰度越好,越适合作为内参基因用于相对定量;引物扩增效率为90%~110%之间,表示可以用于后续胸腔积液中miRNA的检测;当熔解曲线平滑,仅有单一主峰时,表明扩增产物特异度较好。
7.软件评估及判读:使用geNorm(https://genorm.cmgg.be/)、NormFinder(https://moma.dk/Normfinder-software)和BestKeeper(http://www.gene-quantification.de/bestkeeper.html)3种软件分析内参基因的表达稳定性。其中,通过geNorm软件可计算出代表每个内参基因稳定性的M值来筛选出稳定性较好的内参基因,M值越小表示内参基因的稳定性越好,该软件设定的阈值为1.5;通过NormFinder软件计算出的稳定值越小,表示内参基因稳定性越好;而BestKeeper软件主要通过表格内置公式,计算出待测基因的Ct值的“均数±标准差”和变异系数,标准差和变异系数越小,表示内参基因越稳定,越适合作为内参基因。
三、统计学处理
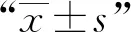
结 果
一、miRNA表达丰度的分析
78份标本中,7种内参基因miR-1268、Cel-miR-39、miR-16、miR-192、miR-20a、miR-4281、U6检测的Ct值从低至高分别为19.16±4.40、24.17±0.73、24.52±1.65、27.54±1.36、28.47±1.72、28.58±2.09、30.31±1.56;扩增效率分别为90%、101%、110%、93%、97%、97%、90%,均可以用于后续胸腔积液miRNA检测;且7种内参基因的熔解曲线均为平滑且仅有单一主峰,显示特异度均较好。
二、miRNA表达稳定性的分析
通过3种软件的分析,Cel-miR-39更适合作为内参基因,具体如下:
1. geNorm软件分析:Cel-miR-39、miR-192、U6、miR-20a、miR-16等5种内参基因的M值分别为0.994、1.003、1.224、1.376、1.484,均符合软件设定的阈值(<1.5),稳定性较好。而miR-4281和miR-1268的M值分别为1.612和2.078,均不符合软件设定的阈值,稳定性较差。
2.NormFinder软件分析:Cel-miR-39的稳定值为0.674,优于其他6种内参基因,即U6、miR-192、miR-20a、miR-16、miR-4281、miR-1268分别为0.813、0.890、0.936、1.057、1.140、3.041。
3.BestKeeper软件分析:Cel-miR-39在78份标本中的Ct值为24.17±0.73,低于除miR-1268外其他内参基因的Ct值,且标准差和变异系数均较低;而miR-1268虽然Ct值较低,但是标准差和变异系数高,并不适合作为相对定量检测的内参基因,具体见表1。
三、miRNA检测重复性分析
对5例患者胸腔积液标本(各2份)miRNA含量进行可重复性检测显示: 7个内参基因两次检测Ct值的比较,结果均未见差异(表2),说明本实验对胸腔积液标本中RNA提取和miRNA定量检测均具有较好的稳定性。
四、不同标本处理方法对胸腔积液miRNA定量检测的影响
对不同处理时间和2次冻融胸腔积液标本进行实验,结果显示:在标本采集后1 h、2 h、4 h及反复冻融2次后,7种内参miRNA的表达量与采样后立即处理时的表达量比较,差异均无统计学意义(表3)。
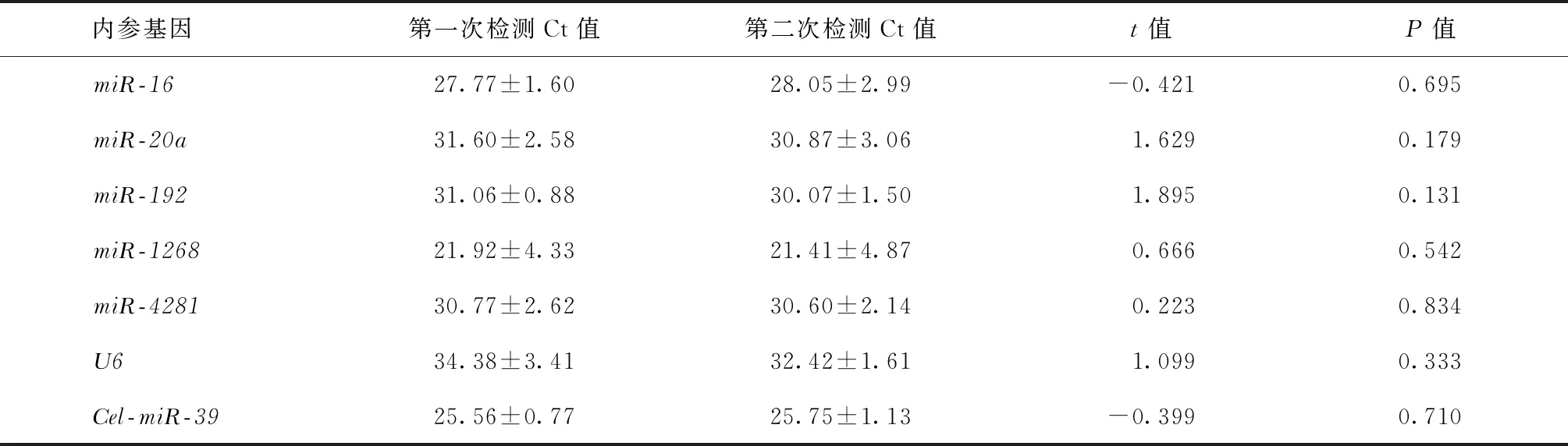
表2 胸腔积液标本中miRNA检测重复性分析
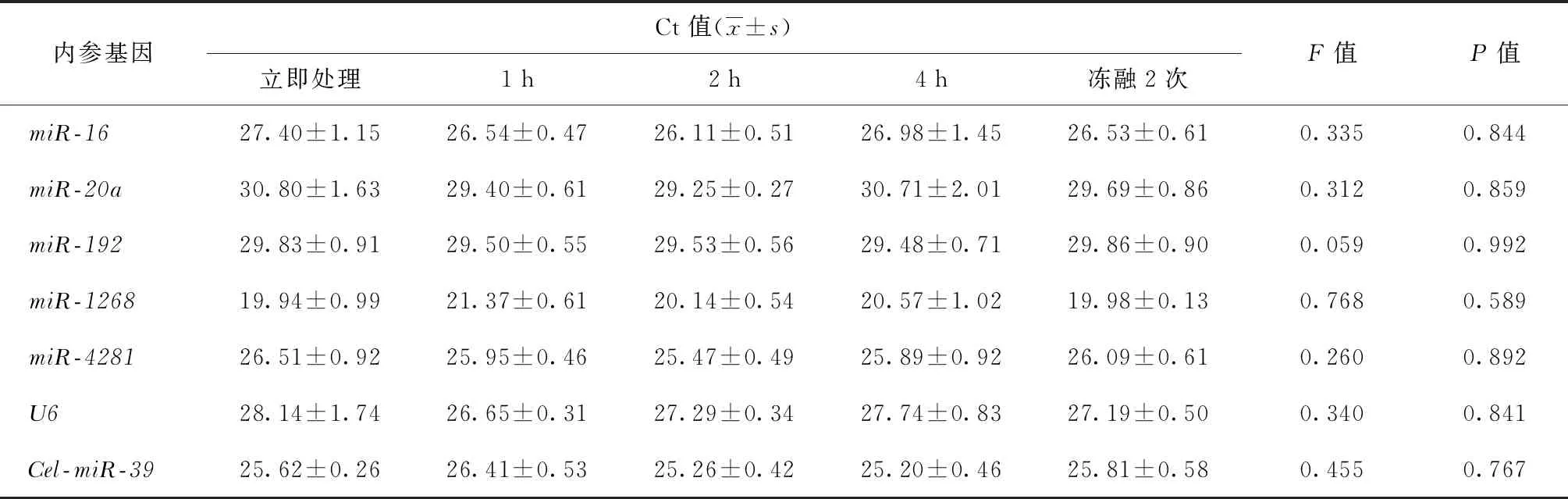
表3 七种内参基因在不同处理方式胸腔积液标本中的表达情况
讨 论
当前,结核性胸膜炎的临床诊断和鉴别诊断仍存在困难,通过选择合适的生物标志物进行组织液活检用于辅助诊断越来越受到关注[15]。胸腔积液是临床上常见的一种病理状态,主要分为漏出液和渗出液。前者常通过成分和详细询问病史来进行临床判断,而后者的病因种类繁多,最常见于结核性胸腔积液和癌性胸腔积液[16-17],分别占比为40%和30%左右[18-19]。由于笔者所在医院的特殊性,可选择用于研究的患者标本均为结核性和恶性胸腔积液,故本研究对所选取的研究对象进行胸腔积液miRNA内参基因相对定量的检测的结果具有一定的代表性。
现阶段关于miRNA定量检测的实验技术主要有基因芯片、二代测序和实时荧光定量PCR。前两种方法属高通量检测,常用于初步筛查;而荧光定量PCR技术由于较敏感,易出现误差,常通过目的基因与内参基因的差值来进行相对定量检测,已成为现阶段主要的实验方法。因此,选择合适的内参基因对于实验结果的客观呈现有着重要意义[20]。既往研究提示,在某种类型标本中公认的稳定的内参基因,并不一定在其他类型标本中也稳定[7]。针对不同标本类型,通常应有相对的特异性标准内参基因,如血浆或细胞中miRNA的相关研究通常使用U6[13]。但在对胸腔积液miRNA的定量检测研究中,并没有业界认可的统一的标准内参基因。在生物标识物研究中,大多数的研究者为了保证内参基因表达的均一稳定,会在开始进行正式的实时荧光定量PCR检测前,根据实验标本类型和研究疾病尝试多种比较常见的内参基因,或通过前期实验发现相对稳定的内参基因,以选择出有针对性的内参基因。
通过前期检索国内外文献,笔者发现内源性基因U6、RNU44、RNU48、miR-192、miR-20a均被较多地应用于胸腔积液miRNA内参基因的定量检测中[14]。并在2014年前后被较多研究证实,相对于RNU44、RNU48,U6更合适作为内参基因进行相对定量检测,并在其后的一段时间内被广泛应用于很多相关实验中[13]。但本次研究发现,虽然U6的应用时间较长,但其Ct值较大,丰度较低,且在个别标本中存在未能成功扩增的现象,故笔者认为U6不是结核性和恶性胸腔积液miRNA相对定量检测中最合适的内参基因。此外,虽然Han等[7]建议选择miR-192作为内参基因来对胸腔积液miRNA进行定量检测,但在对胸腔积液细胞的进一步研究中发现,其可作为鉴别良恶性胸腔积液的敏感性生物标识[21],且在2018年被Filipska等[22]发现其在鳞状细胞肺癌细胞化学治疗的耐药性和侵袭性方面有生物学作用,故笔者认为miR-192并不能作为胸腔积液miRNA检测最合适的内参基因。miR-20a也曾被证实参与了抑癌网络调控[23],而miR-16仅作为内参基因应用于血液miRNA的定量检测[24]。结合本次实验结果,发现以上miRNA内参基因在胸腔积液中的表达稳定性较差,可能并不适合作为结核性和恶性胸腔积液miRNA定量检测的内参基因,提示在一些研究中相对稳定的U6或miR-16并不能推广于结核性和恶性胸腔积液标本检测,可能与不同标本和疾病类型之间的表达谱存在差异有关。
miR-4281和miR-1268是笔者团队在前期进行胸腔积液miRNA高通量筛选中获得的标本间相对稳定表达的miRNA内参基因。但由于前期高通量筛选的标本数量有限,导致在扩大研究后发现这两个miRNA内参基因的表达稳定性并不好,并不适合作为内参基因。这也提示在选择内参基因时,应慎重选择那些通过高通量筛选技术获得的相对稳定的miRNA,不能仅基于高通量检测结果而盲目选择。
相对于细胞和组织,除血液外,在胸腔积液、脑脊液等体液中能够稳定表达的miRNA内参基因并没有被发现,这也是研究人员尝试引入外源性miRNA基因来进行定量检测的主要原因[25]。Cel-miR-39就是其中1个被引入最多的内参基因[25-26]。Cel-miR-39是人工合成的线虫序列miRNA,是在RNA提取过程中人为添加的外源性对照,其含量与体内病理变化没有直接联系,通常作为检测标准化的外源性对照[27],但在胸腔积液中并没有太多的研究。仅发现Wang等[28]在2017年对胸腔积液外泌体miRNA的研究中使用其作为实时荧光定量PCR检测的参照基因。结合本研究结果可以初步认为,在未发现胸腔积液中存在更加稳定表达的其他内参基因时,可以选择Cel-miR-39作为内参基因进行miRNA的定量检测。
目前,国内外并没有对于内参基因综合评价的统一标准,而geNorm、NormFinder和BestKeeper软件是内参基因筛选常用的软件,在其他类型标本中已被广泛应用[29-30]。本研究使用这3个软件分析内参基因的稳定性时,发现Cel-miR-39在3个软件中均表现出最佳的稳定性,且7个内参基因的稳定性排序并不完全相同,与既往的研究中发现“NormFinder软件显示U6的稳定性优于miR-192,但BestKeeper软件显示miR-192的稳定性优于U6”的结果相似[7],可能与不同软件内置的计算模式不相同有关。但本研究仅通过这3个软件来评估7个miRNA内参基因的检测稳定性和表达丰度,可能存在评估不全面的问题;而且,在以内参基因为标准对靶标基因进行相对定量检测时,还要考虑扩增效率的因素。当靶标基因和内参基因扩增效率基本一致时,才能保证检测的客观性和准确性[7]。此外,有学者提出可同时采用内源性和外源性内参基因进行相对定量检测[26],但如何将内源性和外源性基因进行联合,抑或是分别基于内源性和外源性内参基因进行相对定量检测,目前并没有明确的标准或依据。因此,本研究也未联合多个内参基因用于定量检测评价。但希望在未来研究中,能开发出基于数学模型的miRNA多内参基因的联合定量检测。
综上所述,本研究针对胸腔积液中miRNA的定量检测进行了内参基因的筛选,通过3个计算软件比较了7个候选内参基因的表达稳定性,并分析了标本不同处理方式对miRNA检测的影响,发现Cel-miR-39稳定性最好,表达丰度适中,适宜作为实时荧光定量PCR技术定量检测胸腔积液miRNA表达量的内参基因。
