黄芪甲苷抑制放线菌素D诱导的HepG2细胞凋亡作用研究
2021-03-11刘松格谷见法
刘松格,谷见法,潘 琼
(郑州市中心医院 肿瘤内科,河南 郑州 467000)
黄芪甲苷作为黄芪的有效成分已经被证明在多种疾病不同组织器官中可发挥显著的药理学作用[1]。诸多研究表明,黄芪甲苷可通过多种信号通路作用模式发挥抗炎症、抗氧化、抗细胞凋亡等作用[2]。田彦璋等[3]研究发现,As-IV可通过下调GCS蛋白表达逆转肝癌细胞株HepG2多药耐药性。王宇晖等[4]发现黄芪甲苷通过 Smads 通路抑制TGF-β1诱导足细胞凋亡。黄芪甲苷可保护受损心肌细胞线粒体,促进 TERT的表达,抑制心肌细胞凋亡,保护心肌细胞。黄芪甲苷可通过MAPK等多条细胞信号通路发挥作用调节肿瘤细胞的增殖、凋亡和迁移等[5];但黄芪甲苷对肝癌细胞株HepG2的作用及其作用机制目前尚不清楚。
蛋白激酶C (PKC)/细胞外信号调节激酶 1/2(ERK1/2)途径在癌细胞存活、增殖、凋亡、迁移和侵袭中有重要作用[6]。研究表明PKC蛋白过表达与肿瘤的发生发展密切相关,已被视为癌症诊断的生物标志物,广泛用于肿瘤的预后评估。先前的研究已经表明,抑制pKC-α的表达可以阻止A549细胞侵袭和迁移[7]。PKCs通过下游信号通路,如ERK1/2影响迁移和侵袭肿瘤细胞的相关信号蛋白的表达。肿瘤组织中ERK1/2磷酸化水平的增加与肺癌的临床分期、侵袭和迁移密切相关,PKC-ERK1/2作为重要的调节通路可通过改变激酶磷酸化水平影响肝癌的侵袭和迁移等过程[8]。
肝细胞性肝癌是常见的恶性肿瘤之一,其死亡率占世界肿瘤死亡率的第3位,超过所有恶性肿瘤死亡率的5%,但是目前临床上的治疗结果仍然不容乐观[9]。因此探寻更有效的治疗方法非常紧迫,而传统中药因其固有的优点无疑是研究肝癌治疗新药物的重要资源[10]。本研究通过MTT、流式细胞术、western blot等技术研究黄芪甲苷对ActD诱导的肝癌细胞株HepG2细胞凋亡的影响及作用机制。
1 材料与方法
1.1 材料与试剂
肝癌HepG2细胞株购自中国科学院上海生命科学院生物化学与细胞生物学研究所;DMEM培养基、胎牛血清均购于美国Gibco公司;MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)、放线菌素D、Hoechst33258和细胞裂解提取蛋白试剂盒均购于美国Sigma公司;PVDF膜购于美国Millipore公司;一抗为蛋白激酶C蛋白(PKC)、细胞外调节蛋白激酶1(ERK1)、细胞外调节蛋白激酶2(ERK2)、pERK1、pERK2蛋白和内参GAPDH(1∶10 000稀释)均购置于英国Abcam公司;二抗为辣根过氧化物酶标记抗小鼠抗体,购于美国Santa Cruz Biotechnolog公司;增强化学发光(ECL)检测试剂购自美国Pierce公司;细胞凋亡检测试剂盒 Guava Nexin reagent和流式细胞仪为 Millipore公司产品。黄芪甲苷为国产分析纯,由广州威佳生物技术有限公司提供。不同浓度的放线菌素D溶解于一定量乙醇溶液中配制成不同浓度梯度的放线菌素D溶液。黄芪甲苷为白色干粉剂,不溶于水,用助溶剂羧甲基纤维素钠(1%) 1 mL制成均匀混悬液。
1.2 细胞培养
肝癌HepG2细胞株培养于含10%胎牛血清的DMEM培养液中,置于37 ℃、5% CO2培养箱中进行常规培养。
1.3 MTT实验
将处于对数生长期的HepG2细胞稀释至 5×103个/孔的细胞浓度,接种于96孔板,培养2天后,进行对应的药物处理。药物处理完毕后,各组细胞中加入终浓度为5 mg/mL的MTT溶液20 μL/孔,4 h后吸净旧培养基,加150 μL DMSO脱色摇床震荡10 min,490 nm波长下在酶标仪上测OD值,每组设6个复孔,重复3次。细胞存活率=(实验组OD值/对照组OD值)×100%。
1.4 Hoechst33258染色
将HepG2细胞细胞以5×104/mL接种于细胞爬片上,贴壁后采用不同浓度的AS-IV和ActD处理。染色前,PBS清洗3次,加入0.5 mL固定液固定10 min,PBS洗2次,每次3 min;加入0.5 mL Hoechst33258染色液室温下染色5 min,在荧光显微镜下观察并拍照。
1.5 流式细胞术检测细胞凋亡
细胞正常培养,不经过任何药品处理作为对照组,经过终浓度为2 mg/mL的ActD处理24 h作为凋亡模型组,实验处理组细胞经放线菌素D诱导凋亡处理24 h后,加入40 μmol/L的黄芪甲苷处理10 h;经过ActD和AS-IV处理后,胰酶消化细胞后1 000 rpm/min离心收集细胞,重悬于预冷的1×缓冲液中使其浓度约为1× 106细胞/mL。加入200 μL检测试剂后,室温避光反应25 min,200目滤网过滤后上机检测。具体操作过程参照Guava Nexin reagent试剂盒说明书进行。
1.6 细胞膜蛋白和细胞质蛋白提取
将处理过的细胞分别加入5倍体积的缓冲液(含 2 mmol/L EDTA,10 mmol/L EGTA,20 mmol/L Tris/HCl pH=7.5,0.25 mol蔗糖)冰上制成匀浆,4 ℃、100 000×g离心1 h,取上清液含胞浆蛋白。沉淀加入1 mL胞膜蛋白提取液(含1% Triton×100,5 mmol/LEGTA,5 mmol/ L EDTA),超声粉碎后抽提半小时,4 ℃、100 000×g离心1 h,取上清液即为胞膜蛋白,采用BCA法进行蛋白定量,具体的操作方法参照参考文献[11]。
1.7 蛋白印迹
经过一定浓度和时间的ActD和AS-IV处理后,收集各组细胞并分别提取总蛋白,以BCA法测其浓度。12%的SDS-PAGE电泳分离总蛋白后,转印至PVDF膜上,BSA溶液室温封闭1 h后,一抗4 ℃孵育过夜;PVDF膜以TBST溶液洗涤5 min×3次后,二抗室温孵育1 h;TBST溶液洗膜5 min×3次后,滴加ECL发光试剂显色,X片压片后曝光成像。以GAPDH为内参对照。
1.8 统计学处理

2 结果
2.1 黄芪甲苷对HepG2细胞增殖的影响
经过0、20、40、60、80、100 μmol/L浓度的黄芪甲苷处理10 h后,通过MTT法检测各组细胞吸光值,不同浓度处理的细胞活性,如图1所示。随着浓度的加大,处理同样的时间对细胞活性的抑制作用就越强。在浓度大于40 μmol/L时,细胞活性显著降低;选用40 μmol/L为实验浓度,并处理0、6、12、24、36、48、60 h,检测细胞活性变化,随着时间的延长,同一浓度对细胞活性的影响就越大,如图2所示。综合以上结果,选择浓度为40 μmol/L、处理时间为24 h作为后续实验处理条件。
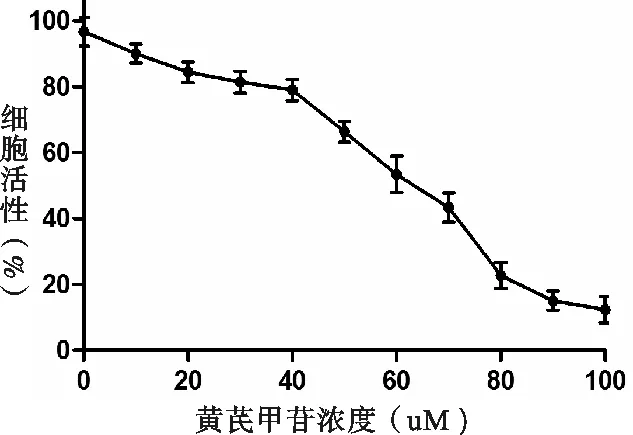
注:浓度为0、20、40、60、80、100 μmol/L的黄芪甲苷处理HepG2细胞,采用MTT法,检测波长为490,分别检测各组细胞活性。
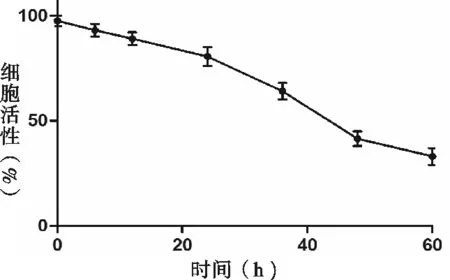
注:40 μmol/L的黄芪甲苷分别处理0、6、12、24、36、48、60 h后各组细胞活性;n=6。
2.2 ActD诱导HepG2细胞凋亡与时间和剂量的关系
经过不同浓度的ActD处理后,实验结果表明,ActD可有效诱导HepG2细胞凋亡,并且呈现一定的时间和剂量依赖性,选择“浓度为2 μg/mL、处理时间为24 h”作为HepG2细胞凋亡的诱导条件,如图3所示。并采用Hoechst33258染色细胞核,观察ActD对细胞凋亡的诱导情况,如图4所示。经过ActD处理的HepG2细胞组荧光显微镜图片中出现大量凋亡小体,而正常对照组中染色的细胞核染色均匀,未见凋亡小体,凋亡小体越多说明细胞凋亡程度越高。以上结果说明“浓度为2 μg/mL、处理时间为24 h”可以有效诱导HepG2细胞凋亡。

注:不同浓度的ActD处理不同的时间后各组细胞凋亡比例,每组设置3个平行实验。

注:Hoechst33258染色细胞核后结果,红色箭头指示凋亡小体。
2.3 黄芪甲苷与ActD诱导的HepG2细胞凋亡
选择浓度为40 μmol/L的AS-Ⅳ和2 μg/mL ActD处理24 h为实验组;不经过药物处理的正常细胞为空白对照组。流式细胞仪检测结果显示,实验组HepG2细胞凋亡率为8%,显著低于ActD诱导组(27%),P<0.05,但实验处理组的细胞凋亡率仍显著高于空白对照组。以上结果表明,一定浓度的黄芪甲苷可有效抑制ActD诱导的HepG2细胞凋亡。
2.4 黄芪甲苷与PKC/ERK通路发挥的抑制细胞凋亡作用
经AS-IV和ActD处理后,分别提取每组细胞的细胞膜蛋白和细胞质蛋白。Western blot结果表明,As-IV和ActD共同处理组细胞膜PKC-α蛋白表达量显著低于ActD处理组(P<0.01),As-IV可显著降低细胞膜PKC-α表达量。而在细胞质中,As-IV和ActD共同处理组细胞质PKC-α蛋白表达量显著高于ActD处理组(P<0.01),As-IV处理组细胞质PKC-α表达量显著高于空白对照组和ActD处理组(P<0.05)。另一方面,As-IV处理组p-ERK1/2表达量显著低于空白对照组,As-IV和ActD共同处理组p-ERK1/2表达量显著低于ActD处理组。ERK1/2呈相反趋势,如图5所示。
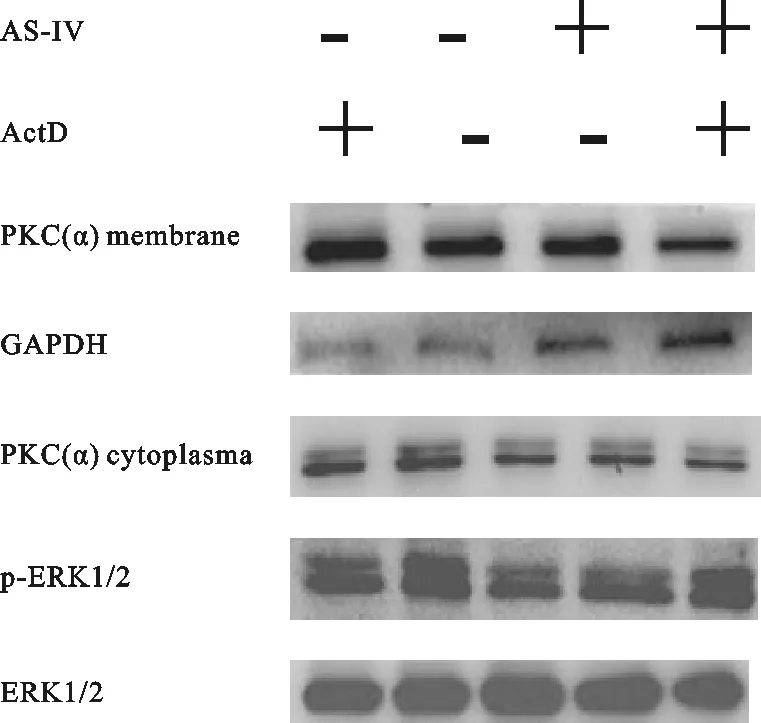
注:图片从上到下依次表示:AS-IV和ActD处理对PKC/ERK通路相关蛋白表达的影响;以及细胞质PKC-α、细胞膜PKC-α、p-ERK1/2、ERK1/2相对于对照组的灰度值。
3 讨论
近些年来,肿瘤的临床诊断和治疗手段都取得了长足进步,但是随着各种癌症发病率的升高,肿瘤开始逐步成为一种影响人们健康的常见疾病。随着对肿瘤发病机制的深入研究,一批又一批的肿瘤特效化疗药物正不断地影响着肿瘤的治疗效果。近年来,国内外诸多实验发现,中药中存在着某些特效成分,可有效抑制肿瘤的发生与发展,引起了各界的广泛关注。有研究表明,黄芪中含有的黄芪多糖、黄酮和氨基酸等具有抗肿瘤、调节免疫力和抗氧化等药理作用,目前已广泛应用于临床医学的多个领域[11]。一般认为黄芪中的有效成分主要是皂苷,其中黄芪甲苷的作用受到了各方肯定。
实验研究表明,黄芪甲苷可通过Smad、MAPK等信号通路发挥非特异免疫调节作用和肿瘤抑制作用,但是对于黄芪甲苷对肝癌细胞的作用及其作用机制目前尚无相关报道[12]。本研究选用HepG2细胞作为肝癌细胞模型,采用不同浓度的黄芪甲苷刺激肝癌细胞,采用MTT法,流式细胞术等实验验证发现黄芪甲苷对肝癌细胞活性的影响呈现时间和剂量依赖性,黄芪甲苷浓度越高,作用的时间越长,对肝癌细胞活性的抑制作用就越明显。但在40 μmol/L浓度以下作用24 h对细胞活性无明显影响,可作为后续作用的处理条件。根据参考文献[13],采用不同浓度的放线菌素D诱导肝癌细胞凋亡,Hoechst33258染色和流式细胞术结果表明,2 μg/mL ActD处理时间为24 h,可有效诱导肝癌细胞凋亡。随后采用40 μmol/L黄芪甲苷作用24 h观察细胞凋亡情况,实验结果表明黄芪甲苷可有效抑制放线菌素D诱导的肝癌细胞凋亡。相对于黄芪甲苷处理组和放线菌素D处理组,采用western blot实验证实放线菌素D处理后经过黄芪甲苷的作用可以有效抑制细胞膜PKCα蛋白和p-ERK1/2表达,而细胞质PKC-α和ERK1/2表达量显著升高。细胞中PKC-α活化后,PKC-α会从细胞质中移位到细胞膜中,细胞膜PKC-α的增加进一步激活MAPK通路,其中MAPK通路已知广泛参与了细胞的增殖、凋亡、炎症和氧化应激等过程。结果表明,黄芪甲苷可有效抑制细胞质PKC-α向细胞膜转移,抑制了细胞膜PKC-α的活化,从而进一步抑制下游ERK通路表达。实验证实黄芪甲苷可有效抑制p-ERK1/2表达,从而抑制了细胞的凋亡和侵袭等过程。
已有研究表明,黄芪甲苷在不同的组织器官中具有不同的药理作用。罗永姣等[14]研究发现,黄芪甲苷可有效抑制病毒性心肌炎发生过程中的心肌细胞凋亡,且已证明与促进Bcl-2抑制Bax表达有关。在肾病模型中,ZHENG等[15]研究发现,黄芪甲苷可通过抑制JNK和ERK1/2激活,保护补体膜攻击复合物诱导的足细胞损伤。LIU等[16]研究发现,黄芪甲苷可显著抑制猪血清诱导的肝细胞纤维化,并抑制胶原合成和肝星状细胞增生。
目前多数研究认为PKC在细胞中通常以无活性的方式存在于细胞质中,细胞外信号分子通过偶联蛋白活化磷脂酶 C导致三磷酸肌醇含量升高,使得Ca2+浓度升高,并激活PKC相关通路[17]。宋兴福等[18-19]研究发现,肺鳞癌和腺癌细胞质和细胞膜中PKC表达量都有显著增高,而细胞膜中增加的幅度更明显,说明肺鳞癌和腺癌与细胞膜PKC-α表达量的增加密切相关。本研究结果表明,黄芪甲苷可以通过抑制细胞膜PKC-α表达量的增加,抑制ActD诱导的肝癌细胞凋亡,为肝癌的治疗和预防提供了新的思路和实验室依据。但黄芪甲苷在其他肿瘤中的作用和作用机制有待于进一步的深入研究。
