类弹性蛋白多肽-红色荧光蛋白融合蛋白的表达纯化及细胞相容性
2021-03-11崔梅英王明月杨泽斌方楷漪关新刚
刘 宁,崔梅英,王明月,杨泽斌,王 浩,毛 禹,方楷漪,夏 薇,关新刚
(北华大学医学技术学院,吉林 吉林 132013)
类弹性蛋白样多肽(elastin-like polypeptide,ELP)是一种由基因工程设计合成的非免疫原性且无热原性的具有良好生物相容性的蛋白质聚合物[1-2],ELP主要是由五肽重复序列单元构成,即Val-Pro-Gly-Xaa-Gly(VPGXG),其中Xaa是除脯氨酸以外的任一种氨基酸[3-5].ELP具有可逆相变循环(Inverse transitioncycling,ITC)的特性,即温度低于其相变温度,ELP多肽以高度可溶的形式存在于水溶液中;若温度高于其相变温度,ELP开始聚集,形成不溶物聚集体,且该过程可逆[6].由于ELP具有的这种特殊性质,在大肠杆菌中高产量表达的ELP蛋白可以利用可逆相变的特性进行快速纯化[7].红色荧光蛋白(mCherry)是SHANER等[8]将发色基团mRFP进行位点突变得到的一种单体红色荧光蛋白[9],mCherry的荧光强度高且稳定性好[10].KALIMUTHU等[11]将含有mCherry基因的慢病毒颗粒转染人间充质干细胞,表达红色荧光mCherry基因,用生物发光成像法追踪间充质干细胞在荷瘤小鼠中的迁移.
在本研究中,基于ELP蛋白的独特优势及mCherry的荧光成像特性,我们构建了ELP-mCherry原核表达载体,表达纯化了ELP-mCherry融合蛋白,探讨了其与人肾上皮细胞HEK293T和小鼠胚胎成纤维细胞NIH3T3细胞的相容性,为设计开发新型的荧光示踪组织工程材料奠定了基础.
1 材料与方法
1.1 细胞、主要仪器和试剂
pET28a-ELP和pEGFP-N1-mCherry质粒(Origene公司,美国);限制性内切酶XbaI与XhoI(生工生物工程(上海)有限公司);大肠杆菌BL21菌株为本实验室保存菌株;HEK293T细胞、NIH3T3细胞复苏自本实验室冻存细胞;胰蛋白胨、酵母提取物、卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)(生工生物工程(上海)有限公司);多功能酶标仪Tecan Spark(上海帝肯公司);PCR仪、核酸电泳以及SDS-PAGE电泳所使用的电泳仪与电泳槽(Bio-Rad公司,美国).
1.2 ELP-mCherry原核表达载体的构建及鉴定
根据GenBank中mCherry基因的核苷酸序列设计包含mCherry基因编码框的引物(生工生物工程(上海)有限公司),并在引物两端分别添加XbaI和XhoI酶切位点.以pEGFP-N1-mCherry为模板通过PCR扩增获得mCherry片段,凝胶回收mCherry片段.mCherry片段和pET28a-ELP质粒分别用1 μL 限制性内切酶XbaI和XhoI酶切,回收目的片段,利用T4 DNA连接酶在4 ℃连接过夜,将连接产物转化到DH5α感受态细胞,接种于含有卡那霉素的LB平板上过夜培养.从平板培养基中挑取单个菌落,170 r/min摇床过夜,提取质粒后用XbaI限制性内切酶进行单酶切验证,再用XbaI和XhoI进行双酶切及1%琼脂糖凝胶电泳检测(Bio-rad),并将构建的重组质粒送至生工生物工程(上海)股份有限公司进行测序分析.
1.3 ELP-mCherry融合蛋白的原核表达
将构建的pET28a-ELP-mCherry质粒转化到大肠杆菌感受态细胞(BL21)中,过夜培养后挑取单克隆菌落,接种于20 mL含有卡那霉素的LB培养基中,37 ℃、170 r/min摇菌过夜;第2天按1∶50接种于1 L含有卡那霉素的LB培养基中,当OD600达到0.6时,加入IPTG(终浓度1 mmol/L),37 ℃条件下培养6 h诱导蛋白表达;离心收集菌体,PBS重悬菌体沉淀后加入苯甲基磺酰氟(PMSF,终浓度1 mol/L),应用超声破碎菌体,离心收集上清和沉淀,通过SDS-PAGE电泳分析蛋白的表达情况.
1.4 ELP-mCherry融合蛋白的纯化
利用ITC法快速纯化ELP-mCherry融合蛋白,将裂解液上清用NaOH调节pH至9.0,4 ℃振荡过夜;第2天将裂解液上清在4 ℃下,5 000 r/min离心90 min,去除不溶性蛋白沉淀;将分离的上清恢复至室温后,置于37 ℃摇床,250 r/min震荡3 h,在3 h内分3次加入NaCl至终浓度为1 mol/L,37 ℃离心收集沉淀,PBS重悬沉淀.以上过程重复两个循环,通过SDS-PAGE电泳分析蛋白的纯化情况.
1.5 ELP-mCherry融合蛋白的细胞相容性
用MTT法检测ELP-mCherry融合蛋白对HEK293T细胞和NIH3T3细胞增殖能力的影响.将对数生长期的HEK293T细胞和NIH3T3细胞以5 000个/孔接种于96孔板中,置入37 ℃、5% CO2培养箱中培养24 h;第2天每孔中加入终浓度25、50、100、200、300 μg/mL的ELP-mCherry融合蛋白,每个ELP-mCherry融合蛋白浓度做5个平行孔.培养48 h后每孔加入20 μL的MTT,37 ℃孵育4 h后,每孔再加入150 μL二甲基亚砜(DMSO),沉淀充分溶解后在酶标仪(TECAN M200)上测定 OD490时每孔的吸光度值.
2 结 果
2.1 ELP-mCherry原核表达载体的构建
将从mCherry质粒中获得的PCR产物与pET28a- ELP质粒分别用限制性内切酶XbaI和XhoI双酶切后,酶切产物经0.8%琼脂糖凝胶分离,将目的片段凝胶回收后连接,连接产物转化到Kana平板,获得阳性克隆.提取质粒通过酶切进行验证,双酶切产生的片段与预期大小一致,提示pET28a-ELP-mCherry重组质粒初步构建成功.见图1.DNA测序结果显示mCherry基因被成功插入表达载体中,没有发生碱基突变和移位,表明pET28a-ELP-mCherry重组质粒构建成功.见图2.

M.DL 5000 DNA marker;1.Xba I单酶切结果;2.Xba I和Xho I双酶切结果.图1pET28a-ELP-mCherry重组质粒的酶切鉴定Fig.1Identification of pET28a-ELP-mCherry recombinant plasmid by enzyme digestion

图2pET28a-ELP-mCherry重组质粒的测序结果Fig.2Sequencing result of pET28a-ELP- mCherry recombinant plasmid
2.2 ELP-mCherry融合蛋白的原核表达
将pET28a-ELP-mCherry表达载体转入大肠杆菌感受态细胞(BL21)中,诱导ELP-mCherry重组蛋白表达,SDS-PAGE电泳结果显示:在细胞裂解液的上清在分子量30 kDa左右出现明显的蛋白条带,与ELP-mCherry融合蛋白的预计分子量相符,说明ELP-mCherry融合蛋白存在于细胞裂解液上清中,然后再利用ITC法进行快速纯化.见图3.

M.蛋白分子量标准;1.菌体细胞裂解液上清;2.菌体细胞裂解液沉淀.图3ELP-mCherry重组蛋白的原核表达Fig.3Prokaryotic expression of ELP-mCherry recombinant protein
2.3 ELP-mCherry融合蛋白的纯化
利用ITC法纯化ELP-mCherry融合蛋白,裂解液上清通过两轮ITC循环的结果显示:电泳条带纯化后的ELP-mCherry融合蛋白在30 kDa位置显示单一条带,未出现明显的蛋白杂带,且蛋白分子量与ELP-mCherry融合蛋白相符.因此,可以确定纯化蛋白为ELP-mCherry蛋白.见图4.

M.蛋白分子量标准;1.纯化后的ELP-mCherry融合蛋白.图4ELP-mCherry融合蛋白纯化Fig.4Purification of ELP-mCherry fusion protein
2.4 ELP-mCherry融合蛋白细胞相容性分析
将不同浓度ELP-mCherry融合蛋白(25、50、100、200、300 μg/mL)分别处理HEK293T细胞及NIH3T3细胞48 h后,通过MTT法检测细胞的存活率.处理48 h后,HEK293T细胞的存活率在各个浓度下都超过100%,NIH3T3细胞在测试所有浓度下也接近100%,这些结果说明ELP-mCherry融合蛋白在两种细胞中都具有良好的细胞相容性.见图5.
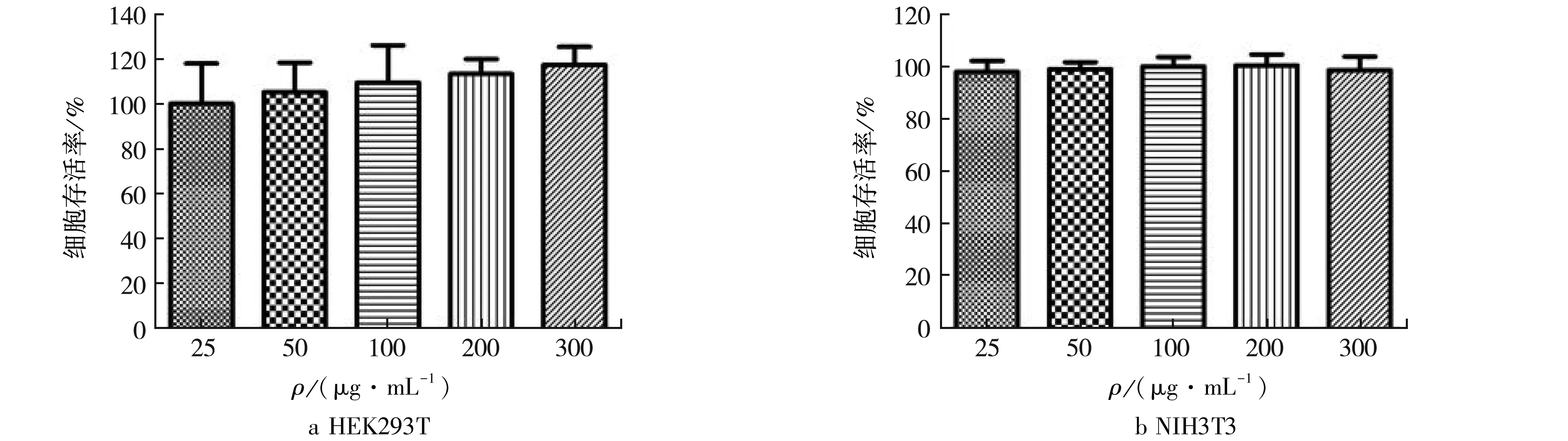
图5ELP-mCherry融合蛋白的细胞相容性Fig.5Cell compatibility of ELP-mCherry fusion protein
3 结 论
利用传统亲和层析法(麦芽糖结合蛋白MBP、谷胱甘肽S-转移酶GST、多聚组氨酸标签His、多聚精氨酸Arg)可以快速获得高纯度的目的蛋白,然而纯化介质成本较高,因此,迫切需要开发一种成本低廉的高纯度蛋白量产方法[12-13].1999年,MEYER等[14]首次将ELP与其他蛋白融合表达时发现了其可逆温度相变转换的特性,从此开创了一种新的蛋白纯化方法,称为“ELP化”,即将目的蛋白基因与ELP基因的N末端或C末端融合而获得融合蛋白的方法.由于类弹性蛋白多肽类衍生蛋白具有可逆温度相变(低温溶解,高温聚集)特性,应用ITC法对ELPs蛋白进行纯化只需要加盐、升温(蛋白聚集)、离心(收集蛋白沉淀)、蛋白复溶几个步骤即可完成,多数情况下只需要2~3轮ITC纯化即可获得高纯度的目的蛋白,无需昂贵的亲和层析介质,极大地降低了蛋白的生产成本,有利于进行大规模的蛋白质生产.近年来 “ELP化”法在重组蛋白纯化、改善目的蛋白半衰期、提升蛋白产量、作为蛋白的递送载体等方面获得了广泛应用[15-18].例如,MOKTAN等[19]将细胞穿膜肽和促凋亡肽分别融合在ELP基因的N末端和C末端,通过大肠杆菌表达系统制备了一种新型的蛋白抗肿瘤药物SynB1-ELP-KLAK,结果显示融合蛋白具有显著抑制肿瘤细胞增殖的能力.PHAN等[20]将两种禽流感H5N1抗原与ELP融合后在转基因烟草中进行融合蛋白表达,并利用ITC方法成功获得了融合蛋白,结果显示ELP化方法在烟草表达系统中能够显著提高目的蛋白产量.FLOSS等[21]将anti-HIV-1单克隆抗体2F5与 ELP 融合后在中国仓鼠卵巢细胞(CHO)也获得了成功表达,结果显示单克隆抗体与ELP融合并未影响2F5与抗原的结合活性,显示ELP化法在哺乳动物表达系统中的有效性.
本研究结果显示:通过构建ELP-mCherry融合蛋白的表达载体,并将其转入大肠杆菌中进行融合蛋白表达,应用ITC法对融合蛋白进行纯化,得到纯度较高的ELP-mCherry融合蛋白.鉴于ELP蛋白在细胞中极佳的细胞相容性,我们随后检测了ELP-mCherry融合蛋白在HEK293T细胞和NIH3T3细胞中的细胞相容性,结果显示融合蛋白在两种细胞的存活率超过或接近100%,提示引入mCherry并未降低ELP的细胞相容性,为接下来的组织工程应用奠定了良好的材料基础.mCherry红色荧光蛋白的最大激发波长为587 nm[22-24],具有结构稳定、表达量高、测定简便等优点,因此,被广泛用来对组织细胞定位进行示踪.将ELP与mCherry制备成ELP-mCherry融合蛋白,既可以利用ELP的可逆温度相变转换特性纯化的融合蛋白,又可以利用mCherry高度稳定的红色荧光追踪其分布[25],因此,可作为理想的集示踪与支架功能于一身的生物材料用于皮肤损伤愈合、组织修复等工程应用.
综上所述,本研究成功构建pET28a-ELP-mCherry表达载体,表达并纯化ELP-mCherry融合蛋白,ELP-mCherry融合蛋白对HEK293T细胞和NIH3T3细胞具有良好的细胞相容性,此研究为开发新型的组织工程示踪材料奠定了基础.
