猪圆环病毒2 型荧光定量PCR 检测试剂盒原材料研究
2021-03-10张晓霞张皖静赵悦琪吴文静凯3
张晓霞,张 琪,张皖静,赵悦琪,吴文静,杨 丹,许 燕,赵 凯3
(1 上海师范大学生命科学学院,上海200234;2 上海博满生物科技有限公司,上海201106;3上海市农业科学院生物技术研究所,上海201106)
猪圆环病毒(Porcine circovirus type,PCV)为圆环病毒科(Circoviridae)圆环病毒属(Circovirus genus)的成员[1-2]。该病毒有两个血清型,即猪圆环病毒1 型(PCV1)和猪圆环病毒2 型(PCV2)[3]。通常认为,PCV1 不具致病性,但PCV2 具有致病性,是引起断奶仔猪多系统衰竭综合征(Post-weaning Multisystemic Wasting Syndrome,PMWS)的主要病原[4]。PCV2 主要破坏猪的免疫系统,造成机体免疫抑制,抵抗力降低,产生其他病原微生物的继发感染[5-6]。PCV2 也与猪的其他多种临床疾病密切相关[7-8]。自1997年在加拿大首次报道PMWS 以来,PCV2 流行范围不断扩大,给养猪业造成了巨大的经济损失[9-11]。PCV2 感染猪的初期诊断与病猪的淘汰是PMWS 防治的关键,开发猪的PCV2 的定性、定量快速检测方法很有必要。
目前,PCV2 的检测技术主要有免疫学检测技术和分子生物学检测技术。免疫学检测技术有酶联免疫吸附试验(ELISA)、间接免疫荧光试验(IFA)、单层过氧化物酶试验(IPMA)等。其中,ELISA、IFA 和IPMA 主要用于PCV2 血清的检测[12-13]。PCV2 的分子生物学检测技术中最常见的是PCR 技术,但常规PCR 一般只能定性,不能定量。基因芯片通过荧光染料信号强度来推算每个探针对应的样品量,但是定量效果不好[14]。实时荧光定量PCR 技术(Real-time fluorescence quantitative polymerase chain reaction,FQPCR)是以定性PCR 技术为基础发展起来的,是目前敏感性最高的核酸检测和定量技术。FQ-PCR 技术是根据荧光共振能量转移原理,在PCR 反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR 进程,最后通过Ct 值(Cycle threshod,循环阈值)和标准曲线对未知模板的起始浓度进行定量[15-16]。Ct 值是指每个反应管内的荧光信号达到设定的阈值时所经历的循环数。每个模板的Ct 值与该模板的起始拷贝数的对数存在线性关系,且起始拷贝数越多,Ct 值越小[17-19]。荧光定量PCR 灵敏度高、特异性强、无污染、快速、准确,在临床检验及生命科学研究方面具有重要的意义[20-22]。本实验室已建立了PCV2 实时荧光定量PCR 检测方法,该方法已被美国佐治亚疾控中心所采用,且已经研制出PCV2 荧光定量PCR 检测试剂盒。本研究通过荧光定量PCR 技术对试剂盒主要原材料进行优化,以期为后续药证申报奠定基础。
1 材料与方法
1.1 病毒来源
PCV2 毒株,由本实验室保存。阳性参考品:PCV2 病毒培养液;阴性参考品:猪伪狂犬病病毒(PRV)、猪呼吸与繁殖障碍综合征病毒(PRRSV)和猪瘟病毒(SFV),均由上海市农业科学院畜牧兽医研究所惠赠。
1.2 主要试剂
荧光定量PCR 试剂盒原材料用的Taq 酶和PCR 反应缓冲液两者为配套试剂,共购置3 套,Group 1:Taq DNA Polymerase(with PCR Reaction Buffer)(上海博彩生物科技有限公司);Group 2:Ex Taq®HotStar version(with PCR Reaction Buffer)[Takara 宝生物工程(上海)有限公司];Group 3:Ex Taq®(with PCR Reaction Buffer)[Takara 宝生物工程(上海)有限公司]。Uracil-DNA-Glycosylase(UDG)酶购置于3 家公司,Group 1:上海博彩生物科技有限公司;Group 2:南京诺唯赞生物科技有限公司;Group 3:北京康为世纪生物科技有限公司。荧光定量PCR 引物和TaqMan 探针由上海生工生物技术有限公司合成;病毒基因组DNA∕RNA 提取试剂盒和质粒提取试剂盒购于天根生化科技(北京)有限公司。
1.3 引物和探针设计
以PCV2(BJ0804 株)ORF2 基因(GenBank 登录号为EU921257.1)序列作为靶序列(全长149 bp),使用Primer Premier 5.0 软件设计引物和探针,使用Oligo DNAMAN 4.0 和Primer Analysis 进行序列比对分析。引物与探针信息见表1。

表1 PCV2 引物和探针序列Table 1 Sequence of primers and probe of PCV2
1.4 PCV2 荧光定量PCR 检测试剂盒使用方法
体系配置间:在此房间完成荧光定量PCR 总体系的配置。具体如下:于1.5 mL 离心管中加入Premix(内含10 ×Buffer、dNTPs、MgCl2、Taq 酶、UDG 酶和Rox 矫正染料)11.9 μL,Primer1 和Primer2 各0.9 μL,Probe 0.4 μL,用灭菌双蒸水补至20 μL。涡旋混匀,瞬时离心,然后将配置好的总体系分装到8 连PCR 排管中。所有的荧光定量PCR 反应均平行重复3 次。此房间不能放置阳性模板或PCR 反应产物。
模板间:将配好的PCR 体系在模板间加入模板DNA∕参考品∕对照品∕待检样品5 μL,立即盖严管盖,瞬离,避免产生气泡。模板要按照拷贝数从低到高的顺序依次加入且此房间不能放置PCR 体系配制的原料。
扩增间:荧光定量PCR 反应的扩增程序为37 ℃5 min;94 ℃预变性10 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸31 s(此阶段收集荧光信号),45个循环。反应结束后进行荧光定量PCR 扩增结果分析。
1.5 试剂盒标准阳性对照的制备
阳性对照是含有PCV2 靶基因片段的质粒,用分光光度计测定其含量,并根据病毒学方法计算出质粒浓度对应的拷贝数。质粒做10 倍梯度稀释后作为模板进行荧光定量PCR 扩增。
1.6 空白对照的制备
空白对照为无RNA 酶的无菌水。用移液器量取1 mL 的DEPC,补纯化水至1000 mL,混匀,121 ℃、20 min 灭菌,室温保存。
1.7 阳性参考品、最低检测限参考品和精密性参考品的制备
分取200 μL 已灭活的PCV2 病毒培养液的母液,按照病毒基因组DNA∕RNA 提取试剂盒说明书进行核酸提取。按10 倍系列梯度稀释,梯度为10-1至10-9,稀释后分别进行荧光定量PCR 检测。
1.8 Taq 酶和荧光定量PCR 反应缓冲液的优选试验
将3 家公司生产的Taq 酶和荧光定量PCR 反应缓冲液,与UDG 酶按照供应商说明书进行配制,分别加入浓度为1 ×107拷贝∕mL 和1 ×104拷贝∕mL PCV2 病毒DNA,按照设定程序进行荧光定量PCR 检测,重复3 次。评价3 家公司的Taq 酶和PCR 反应缓冲液对PCR 反应的影响。
1.9 UDG 酶的优选试验
将3 家公司生产的UDG 酶与Taq 酶和PCR 反应缓冲液按照供应商说明书进行配制,分别加入含dUTP的PCV2 DNA 扩增产物(浓度分别为1 ×107拷贝∕mL、1 ×106拷贝∕mL、1 ×105拷贝∕mL、1 ×104拷贝∕mL和1×103拷贝∕mL)或阳性对照,按照说明书设定程序进行荧光PCR 检测,重复3 次。
1.10 阳性对照
将PCV2 的质粒按10 倍系列梯度稀释,梯度为10-1至10-9,稀释后分别进行荧光定量PCR 检测。检测结果中Ct 值范围为25—30 对应的浓度梯度的PCV2 病毒质粒等体积混合后为阳性对照。置于-20 ℃条件下保存,长期保存则置于-70 ℃条件下。
1.11 阳性参考品、最低检测限参考品和精密性参考品试验
将PCV2 的核酸DNA 按10 倍系列梯度稀释,梯度为10-1至10-9,稀释后分别进行荧光定量PCR 扩增检测,重复3 次。
2 结果与分析
2.1 Taq 酶和荧光定量PCR 反应缓冲液的优选试验
如表2 所示,当样本浓度为106拷贝∕μL 时,Group 1、Group 2 和Group 3 的Ct 值没有显著性差异,Group 2 的荧光增长值高于Group 1 和Group 3;样本浓度为102拷贝∕μL 时,Group 1、Group 2 的Ct 值没有显著性差异,Group 2 的荧光增长值高于Group 1,Group 3 未获得Ct 值且无荧光增长值。综上,Group 2 的产品试剂效果最佳。
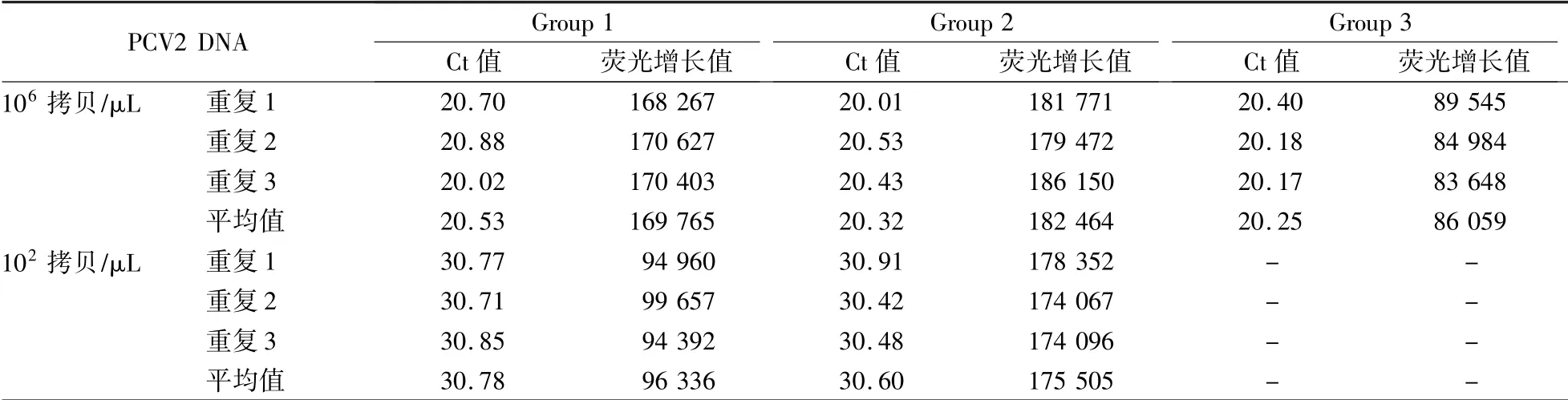
表2 3 家公司Taq 酶和PCR 反应缓冲液的优选Table 2 Optimization of Taq enzyme and PCR reaction buffer from three companies
2.2 UDG 酶的优选试验
PCR 产物受污染会造成假阳性。如表3 所示,根据荧光定量PCR 扩增结果的Ct 值判断,无论是含有dUTP 的高浓度PCR 产物还是低浓度PCR 产物,Group 1、Group 2 和Group 3 均能有效消除污染,之间没有显著性变化,综合考虑质量和价格因素,选择Group 1。

表3 3 家公司UDG 酶的比对优选Table 3 Comparison and optimization of UDG enzymes from three companies
2.3 阳性参考品、最低检测限参考品和精密性参考品试验
如图1A 所示,检测结果中Ct 值范围为20—25 对应的浓度梯度的PCV2 病毒核酸提取液等体积混合后作为阳性参考品。检测结果中Ct 值范围为30—35 对应的浓度梯度的PCV2 病毒核酸提取液等体积混合后作为最低检测限参考品。检测结果中Ct 值范围为20—25 对应的浓度梯度的PCV2 的病毒培养液(工作液)等体积混合后作为精密性参考品。以上参考品置于-20 ℃保存,长期保存置于-70 ℃。
2.4 阴性参考品试验
对阴性参考品、阳性对照和阴性对照进行荧光定量PCR 检测,结果如图1B 所示,阳性对照有典型的S 型扩增曲线、阴性参考品和阴性对照均无扩增,说明PRV、PRRSV、SFV 病毒与PCV2 病毒均无交叉反应。
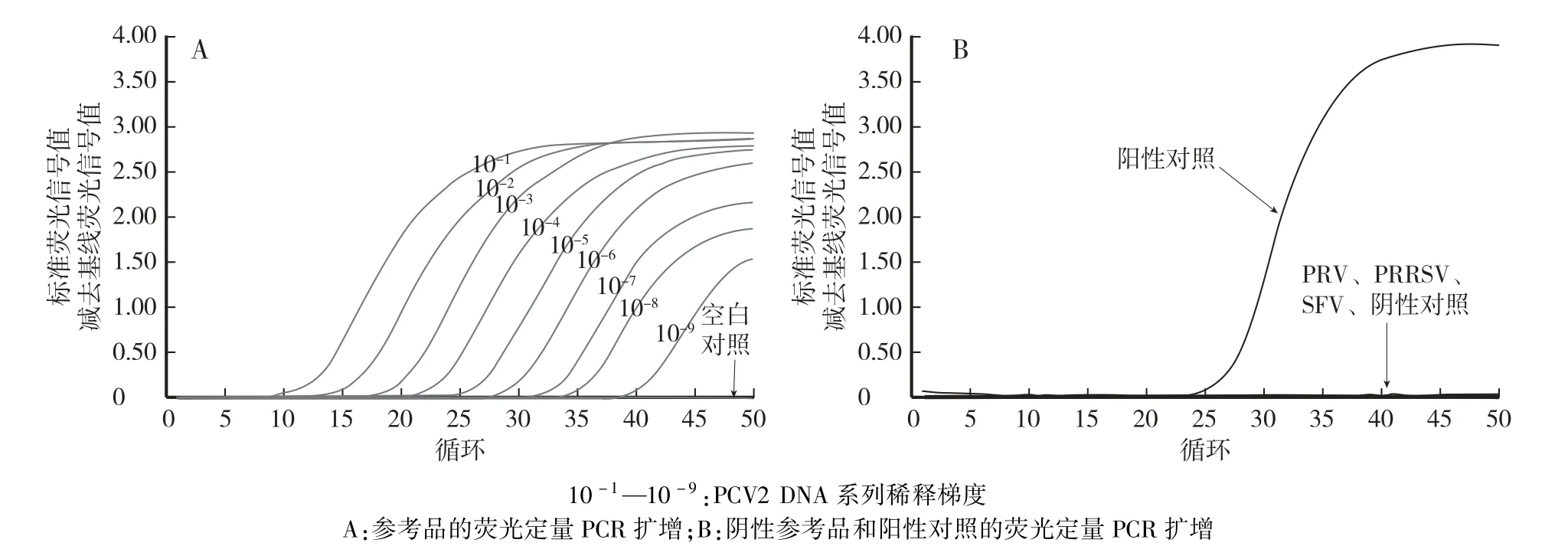
图1 阳性参考品、最低检测限参考品、精密性参考品和阴性参考品的荧光定量PCR 扩增Fig.1 Fluorescent quantitation PCR amplification of positive reference,the lowest detection limit reference,precision reference and negative reference
3 结论与讨论
本试验选择不同的靶序列并设计了不同的引物和探针来检测PCV2,发现已建立的荧光定量PCR 检测方法PCV2 的检测率比普通PCR 高18%。这不仅提供了一种快速定量检测PCV2 的方法,也可应用于评价PCV2 疫苗。
本研究对比了3 家公司生产的Taq 酶、PCR 反应缓冲液试剂,结果表明Takara 宝生物工程(上海)有限公司生产的Taq 酶、PCR 反应缓冲液的试剂扩增效果最佳;在3 家公司生产的UDG 酶试剂的比对研究中,上海博彩生物科技有限公司所生产的UDG 酶的质量和价格最优,能够有效消除污染;在试剂盒参考品研究中,对阳性参考品、最低检测限参考品、精密性参考品进行制备和定值,保证试剂盒在检测应用中的参照标准和灵敏度,使这种检测方法更加标准和规范化;在试剂盒阴性参考品研究中,设置了PRV、PRRSV、SFV 3个病毒和阳性对照进行荧光定量PCR 试验,结果显示阴性参考品无交叉反应,说明阴性参考品具有优良的特异性;在试剂盒的质控品研究中设置了阳性对照和空白对照,保证试剂盒的质量控制。下一步将会继续进行该试剂盒稳定性、生产工艺及反应体系、参考值、分析性能评估、临床考核等等方面的研究。该研究可为业内同行药证申报提供参考。
