寄生黑腹果蝇的日本开臂反颚茧蜂生物学特性及其寄生对寄主发育及免疫反应的影响
2021-03-09周思聪陈佳妮张启超陈学新黄健华
张 显,周思聪,陈佳妮,庞 兰,张启超,王 莹,时 敏,陈学新,黄健华
(浙江大学昆虫科学研究所,农业部作物病虫分子生物学重点实验室,杭州 310058)
化学农药在降低农业害虫危害、保障农产品高产和推动社会发展等方面发挥了极其重要的作用。但近些年来,由于农药不合理使用带来的许多弊端,比如环境污染、农药残留及害虫抗药性等问题,引起了全社会的广泛性关注(Lietal.,2018)。生物防治是指利用天敌昆虫及病原微生物等自然资源去控制害虫发生的一种环境友好、生态安全的防控技术。它能有效避免农药滥用带来的一系列问题,符合我国发展绿色农业的战略需求(古德祥等,2000;张俊杰等,2015;党英侨等,2018)。寄生蜂是一类重要的寄生性天敌昆虫,其数量众多,约占整个昆虫种类的10%~20%(Whitfield,2003)。通过大规模饲养和人工释放寄生蜂,可以有效地控制和降低害虫种群数量,达到对害虫防治的目的。我国已经有许多应用寄生蜂进行害虫防治的成功案例,比如:应用赤眼蜂对玉米螟、二化螟Chilosuppressalis、甘蔗螟虫等害虫进行防治(张海燕等,2019);应用丽蚜小蜂Encarsiaformosa减少温室害虫白粉虱的危害等等(李洪安等,2007)。
在自然界中,有一些果蝇属Drosophila昆虫,比如斑翅果蝇D.suzukii,是危害极大的浆果类水果害虫。与其他果蝇种类不同,斑翅果蝇雌虫具有锯齿状产卵器,所以它能够将卵产在即将成熟的果皮下,孵化后的斑翅果蝇幼虫通过取食果肉为生(Atallahetal.,2014)。斑翅果蝇原产于东南亚,近年来传入美洲和欧洲等许多国家和地区,对当地的水果产业造成了巨大的危害(Leeetal.,2011;Cinietal.,2014)。在我国四川、云南、浙江等省份都发生过斑翅果蝇危害樱桃、蓝莓、葡萄等水果,严重影响了水果产量并造成巨大的经济损失(张成林等,2011;张开春等,2014)。为此,国内外生物防治领域相关研究人员一直致力于寻找能够有效降低斑翅果蝇害虫种群的寄生蜂,希望通过大量繁殖和释放技术实现对斑翅果蝇危害的持续控制。
目前,果蝇属寄生蜂的研究主要集中寄生果蝇幼虫的茧蜂科(Braconidae)寄生蜂和环腹瘿蜂科 (Figitidae)寄生蜂,以及寄生果蝇蛹期的锤角细蜂科(Diapriidae)寄生蜂和金小蜂科(Pteromalidae)寄生蜂(Cartonetal.,1986)。有研究表明,锤角细蜂科的毛锤角细蜂Trichopriadrosophilae对斑翅果蝇有很高的寄生效率(Chabertetal.,2012)。而绝大多数幼虫寄生蜂,像环腹瘿蜂科(Figitidae)Leptopilina属的异小环腹瘿蜂L.heterotoma和布拉迪小环腹瘿蜂L.boulardi都不能成功寄生斑翅果蝇。本课题组于2018年在浙江省台州地区(28°50′N,120°34′E)诱捕到一种茧蜂科开臂反颚茧蜂属Asobara的果蝇幼虫寄生蜂日本开臂反颚茧蜂Asobarajaponica,发现其能成功寄生斑翅果蝇(Zhangetal.,2020)。更为重要的是,该寄生蜂种群的生殖方式为产雌孤雌生殖,即后代均为雌性。这些特性均显示日本开臂反颚茧蜂是一种潜在的、可用于生物防治斑翅果蝇的优势寄生蜂。
日本开臂反颚茧蜂是典型的单寄生蜂,其能寄生多种果蝇属的昆虫,这有助于我们选择一种适合的替代寄主进行工厂化大规模扩繁,并用以生物防治(Ideoetal.,2008)。黑腹果蝇D.melanogaster是一种模式昆虫,它具有繁殖速度快、容易饲养等优点。因此,黑腹果蝇可能是日本开臂反颚茧蜂进行大规模繁殖的最佳替代寄主。本研究针对日本开臂反颚茧蜂-黑腹果蝇这一体系,来研究寄生蜂在寄主体内的形态特征、发育历期及寄生效率等生物学特征;研究寄生蜂寄生对寄主生长发育及免疫信号通路相关基因转录水平的影响,以期能够提升日本开臂反颚茧蜂大量繁殖的能力,从而保证寄生蜂生防产品的产量和质量。
1 材料与方法
1.1 供试昆虫
黑腹果蝇品系W1118从美国印第安纳大学Bloomington果蝇中心购买,用5.5 cm×5.5 cm的果蝇瓶饲养。果蝇食物为常规的玉米粉配方,每6 L果蝇食物含:玉米粉318 g,干酵母120 g,琼脂粉57 g,蛋白胨60 g,红糖90 g,葡萄糖180 g,酵母提取物60 g。日本开臂反颚茧蜂于2018年6月在浙江省台州地区用葡萄和香蕉等水果诱集,并一直饲养于本实验室。日本开臂反颚茧蜂为孤雌生殖品种,所有后代均为雌性。寄生蜂雌蜂饲养在苹果汁食物中,食物配方为:每1 L含27 g琼脂,33 g红糖,330 mL苹果汁,20 mL 10%尼泊金甲酯。所有昆虫均在人工气候箱中进行饲养,黑腹果蝇饲养条件为温度25±1℃,相对湿度50%±1%,光周期16L∶8D;寄生蜂饲养条件为温度25±1℃,相对湿度50%±1%,光周期16L∶8D。
1.2 日本开臂反颚茧蜂发育历期及形态特征观测
挑取200头黑腹果蝇2龄幼虫放于含果蝇食物的果蝇瓶中,用羽化后4 d的日本开臂反颚茧蜂寄生,使用寄生蜂数与供试寄主幼虫数比为1∶20,寄生3 h后取出寄生蜂,将寄主放于25±1℃恒温培养箱中培养并观察。寄生后每隔12 h取被寄生的黑腹果蝇进行解剖,观察日本开臂反颚茧蜂在寄主体内的发育阶段,并用KEYENCE VHX-2000C成像系统进行拍照。依据预实验结果,初步判断寄生蜂幼虫期与蛹期分别为产卵后2-6 d 和7-16 d。为了进一步精确计算日本开臂反颚茧蜂各发育阶段所需的时间,我们分别在寄生蜂产卵后1.5,2和2.5 d解剖30头寄主,用以统计蜂卵孵化数;分别在产卵后6,7 和8 d解剖30头寄主,用以统计幼虫化蛹数;分别在产卵后15,16和17 d解剖30头寄主,用以统计蛹羽化数。卵期所需天数(d)=(1.5 d×卵孵化数+2 d×卵孵化数+2.5 d×卵孵化数)/卵孵化总数;幼虫期所需天数(d)=[(6 d×幼虫化蛹数+7 d×幼虫化蛹数+8 d×幼虫化蛹数)/总化蛹数]-卵期发育天数;蛹期所需时间(d)=[(15 d×蛹羽化数+16 d×蛹羽化数+17 d×蛹羽化数)/总羽化数]-幼虫期发育天数-卵期发育天数。实验重复3次。
1.3 日本开臂反颚茧蜂的寄生率及出蜂率测定
采用的实验方法同1.2节,实验重复4次,每次重复均统计每瓶内寄主果蝇化蛹数、寄主幼虫死亡数、寄主羽化数、寄生蜂羽化数以及寄主蛹死亡数,以此计算寄生率、出蜂率、寄主幼虫死亡率和寄主蛹死亡率。寄生率=[1-寄主羽化数/供试寄主幼虫数]×100%;出蜂率=(寄生蜂羽化数/供试寄主幼虫数)×100%;寄主幼虫死亡率=(寄主幼虫死亡数/供试寄主幼虫数)×100%;寄主蛹死亡率=(寄主蛹死亡数/寄主化蛹数)×100%。
1.4 日本开臂反颚茧蜂寄生前后寄主黑腹果蝇发育历期测定
取50头交配后的雌性黑腹果蝇放于果蝇瓶中产卵3 h左右,每次能产约200粒卵,待果蝇幼虫发育至2龄幼虫时,立即用羽化后4 d的日本开臂反颚茧蜂寄生,使用寄生蜂数与供试寄主幼虫数比为1∶20,寄生3 h后取出寄生蜂,将寄主放于25±1℃恒温培养箱中培养。每隔12 h统计每瓶化蛹数,根据每个时间点的累计化蛹数占最终化蛹数的百分比作图。实验重复4次,处理组为日本开臂反颚茧蜂寄生的黑腹果蝇,对照组为相近卵数且未被寄生的黑腹果蝇。
1.5 qRT-PCR方法检测黑腹果蝇免疫通路相关基因的转录水平
本研究借鉴Schlenke等(2007)方法,在果蝇3个主要免疫通路,即Toll通路、Imd通路和PO通路,各选取5个关键基因进行转录水平检测。其中,Toll通路基因:SPE(FlyBase ID:FBgn0039102),Toll(FlyBase ID:FBgn0262473),Myd88 (FlyBase ID:FBgn0033402),Dif(FlyBase ID:FBgn0011274)和Drosomycin(FlyBase ID:FBgn0283461);Imd通路基因:PGRP-LE(FlyBase ID:FBgn0030695),PGRP-LC(FlyBase ID:FBgn0035976),imd(FlyBase ID:FBgn0013983),Relish(FlyBase ID:FBgn0014018)和Diptericin(FlyBase ID:FBgn0034407);PO通路基因:Spn27A(FlyBase ID:FBgn0028990),MP2 (FlyBase ID:FBgn0037515),yellow-f2 (FlyBase ID:FBgn0038105),DoxA2 (FlyBase ID:FBgn0261396)和PPO1 (FlyBase ID:FBgn0283437)。对被寄生后6与12 h的黑腹果蝇幼虫整虫进行取样,使用QIAGEN RNeasy Mini Kit提取RNA,Vazyme HiScript Ⅱ Q RT SuperMix (Cat#Q223-01,Vazyme,南京)进行反转录获得cDNA第1链,最终使用ChamQ SYBR qPCR Master Mix Kit(Cat#Q311-02,Vazyme,南京)在AriaMax实时荧光定量PCR仪(Agilent Technologies,CA,USA)上进行qRT-PCR分析。qRT-PCR反应体系(20 μL):SYBR-Green Mix 10 μL,上下游引物(10 μmol/L)各0.4 μL,500 ng/μL的cDNA模板0.2 μL,灭菌水9 μL。反应条件:95℃预变性30 s;95℃变性10 s,57℃退火20 s,72℃延伸20 s,40个循环;熔解曲线:95℃变性15 s,60℃退火1 min,95℃变性15 s。rp49(Flybase ID:FBgn0002626)作为内参基因,使用2-ΔΔCt方法计算目的基因相对表达丰度。qRT-PCR引物详见表1。

表1 qRT-PCR的引物序列Table 1 Primers for qRT-PCR in this study
1.6 数据分析
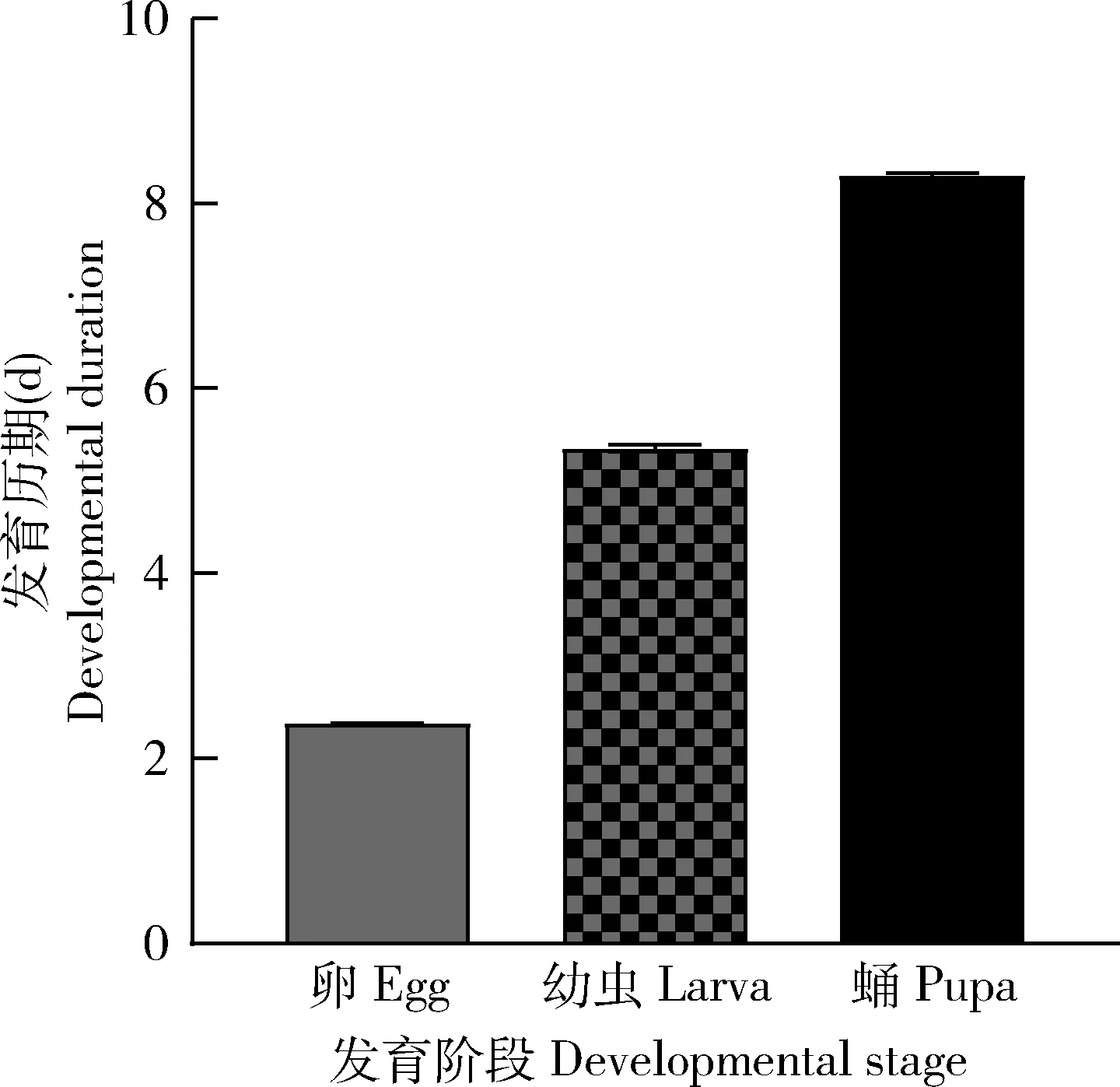
实验数据均在Data Processing System(DPS) Package Version 9.5(Tang and Zhang,2013)中进行分析,使用的分析方法有非配对Student氏t检验。设定0.01 日本开臂反颚茧蜂是一种幼虫-蛹寄生蜂,成熟的雌性寄生蜂将卵产在果蝇2龄幼虫体内,其蜂卵在3龄寄主幼虫体内孵化。待寄主发育至蛹期时,寄生蜂幼蜂通过大量取食蛹期寄主的组织并完成自身世代发育。日本开臂反颚茧蜂的发育经历卵、幼虫、蛹和成虫4个阶段。统计结果表明,在25±1℃的实验室饲养条件下,日本开臂反颚茧蜂的卵期发育需要2.38±0.01 d,幼虫期需要5.36±0.07 d,蛹期需要8.30±0.04 d (图1)。由于本实验所用的日本开臂反颚茧蜂为孤雌生殖品种,因此上述实验数据均为雌性日本开臂反颚茧蜂生长发育所需的时间。 图1 日本开臂反颚茧蜂各发育阶段发育历期Fig.1 Duration of various developmental stages of Asobara japonica图中的数值为平均值±标准误。Data in the figure are mean±SE. 经过解剖成像,我们同时获得了日本开臂反颚茧蜂在寄主体内不同发育阶段的图片(图2)。日本开臂反颚茧蜂卵呈香蕉形(图2:A),在早期发育的胚胎中可见明显的两层膜结构,产卵后约2 d已可见幼虫形态,之后其突破内膜发育为1龄幼虫。日本开臂反颚茧蜂幼虫阶段共分3个龄期,整个1龄幼虫阶段均在外膜内完成,发育初期的1龄幼虫可见轻微的体节分化,头部显著宽于体节,体色乳白色,肠道等结构尚不清晰(图2:B);1龄末期体节部分明显变宽,与头部等宽,肠道明显,约占整个虫体的二分之一,体色透明,且有少量脂肪颗粒积累。产卵后约4 d,1龄幼虫突破外膜,发育成2龄幼虫,能观察到明显的蜕皮(图2:C)。随着寄生蜂2龄幼虫的生长,其肠道逐渐变成不透明的淡黄色,约占身体的2/3,身体四周布满脂肪颗粒,体躯宽于头部(图2:D)。产卵后5 d,日本开臂反颚茧蜂体型较2龄幼虫明显变大,发育成3龄幼虫,幼虫身体弯曲,呈黄色,肠道几乎充满整个身躯(图2:E)。在这一过程中,我们没有看到蜕皮,可能2龄幼虫蜕下的表皮被寄生蜂3龄幼虫快速消化并利用。随后,日本开臂反颚茧蜂幼虫进入预蛹及蛹期(图2:F-H)。 图2 日本开臂反颚茧蜂各发育阶段的形态特征Fig.2 Morphological characteristics of Asobara japonica at different developmental stagesA:卵Egg;B:1龄幼虫初期Early stage of the 1st instar larva;C:2龄幼虫初期Early stage of the 2nd instar larva;D:2龄幼虫晚期 Late stage of the 2nd instar larva;E:3龄幼虫3rd instar larva;F:预蛹Prepupa;G:早期蛹Early stage of pupa;H:晚期蛹Late stage of pupa.箭头示1龄幼蜂蜕下的表皮。The arrow indicates the cuticle exuviated by the 1st instar larva. 寄生蜂与寄主间存在着十分复杂的相互作用关系。一方面,寄生蜂会释放一些寄生因子使其成功寄生;另一方面,寄主会产生一系列的免疫应答,如包囊和黑化反应,最终会导致寄生蜂无法生长发育。在寄主黑腹果蝇上的寄生率及出蜂率,是决定其是否适用于大规模扩繁日本开臂反颚茧蜂并用于生物防治应用的关键因素。因此,我们对日本开臂反颚茧蜂寄生黑腹果蝇的寄生率和出蜂率进行了统计。研究结果表明,在实验条件下,日本开臂反颚茧蜂的寄生率为94.9%±4.0%,出蜂率为64.3%±7.1%(表2)。同时,我们还发现,日本开臂反颚茧蜂寄生能够导致较高的寄主幼虫和蛹死亡率,分别为25.8%±3.7%和6.6%±1.1%,而未寄生的对照组寄主幼虫和蛹死亡率很低,分别只有4.1%±1.4%和0(表2)。 我们对日本开臂反颚茧蜂调控寄主生长发育进行了初步的研究。通过每隔12 h统计寄主成功化蛹数,计算每个时间点的化蛹率,并采用Student氏t检验进行显著性分析。研究结果表明,日本开臂反颚茧蜂寄生后黑腹果蝇化蛹时间发生了显著延迟。在产卵后5,5.5和6 d,被寄生组化蛹率相较未被寄生对照显著降低(P<0.05),其中在50%化蛹率这一节点上,寄生后的寄主化蛹时间延长了约0.5 d(图3)。结果显示,日本开臂反颚茧蜂寄生能够延缓黑腹果蝇的生长发育,和已报道的其他果蝇寄生蜂有相似的作用机制。 图3 日本开臂反颚茧蜂寄生后黑腹果蝇化蛹时间的变化Fig.3 Changes of pupation time of Drosophila melanogaster after being parasitized by Asobara japonica图中数据为平均值±标准误;柱上星号表示同一寄生时间点被寄生组和未被寄生对照之间差异显著(P<0.05,Student氏t检验)。Data in the figure are mean±SE.The asterisks above bars indicate significant difference between the parasitized group and the unparasitized control at the same time point post parasitization (P<0.05,Student’s t-test). 为了弄清楚日本开臂反颚茧蜂寄生是否影响了寄主的免疫通路,我们选择果蝇3个主要免疫通路,即Toll通路、Imd通路和PO通路,各通路分别选取5个重要基因进行转录水平检测。实验结果表明,寄生6和12 h后,Toll通路中的基因SPE,Toll,Myd88和Dif表达量与未被寄生对照组比无显著变化(P>0.05)(图4:A-D),但该通路一个末端效应抗菌肽基因Drosomycin表达量显著上调(P<0.05),其寄生后6 h相较未被寄生对照上调53倍,寄生后12 h相较未寄生对照上调38倍(图4:E);寄生6和12 h后,Imd通路中的基因PGRP-LE,PGRP-LC,imd和Relish表达量与未被寄生对照组比无显著差异(P>0.05)(图4:F-I),但一个末端效应抗菌肽基因Diptericin表达量显著上调(P<0.05),其中寄生后6 h相较未被寄生对照上调36倍,寄生后12 h相较未被寄生对照上调12倍(图4:J)。Toll通路和Imd通路的一些上游基因的表达水平没有受到日本开臂反颚茧蜂寄生的影响,但是其下游的两个抗菌肽基因Drosomycin和Diptericin却显著上调。 在寄生6和12 h后,PO通路基因Spn27A,MP2,yellow-f2和DoxA2表达量与未被寄生对照组比无显著差异(P>0.05)(图4:K-N),但原酚氧化酶基因PPO1表达量发生显著下调(P<0.05),其中寄生后6 h相较未寄生对照下调38%,寄生后12 h相较未被寄生对照下调50%(图4:O)。结果显示寄生蜂能够快速且有效抑制寄主的黑化反应,从而保证日本开臂反颚茧蜂具有很高的寄生效率。 图4 日本开臂反颚茧蜂寄生6和12 h后黑腹果蝇幼虫Toll,Imd和PO通路重要基因相对表达量变化Fig.4 Changes in relative expression levels of important genes of Toll,Imd and PO pathways in Drosophila melanogaster larvae after being parasitized by Asobara japonica for 6 and 12 hA-E:分别为Toll通路中的SPE,Toll,Myd88,Dif和Drosomycin基因 SPE,Toll,Myd88,Dif and Drosomycin,respectively,involved in Toll pathway;F-J:分别为Imd通路中的PGRP-LE,PGRP-LC,imd,Relish 和Diptericin基因PGRP-LE,PGRP-LC,imd,Relish and Diptericin,respectively,involved in Imd pathway;K-O:分别为PO通路的Spn27A,MP2,yellow-f2,DoxA2和PPO1基因Spn27A,MP2,yellow-f2,DoxA2 and PPO1,respectively,involved in PO pathway.图中数值为平均值±标准误;柱上星号表示同一寄生时间点被寄生组和未被寄生对照之间差异显著(Student氏t检验)。Data in the figure are mean±SE.The asterisks above bars indicate significant difference between the parasitized group and the unparasitized control at the same time point post parasitization (Student’s t-test).*0.01 日本开臂反颚茧蜂是果蝇的幼虫-蛹期寄生蜂。通过解剖与成像,我们对日本开臂反颚茧蜂羽化前的6个生长发育阶段(卵期、1龄幼虫期、2龄幼虫期、3龄幼虫期、预蛹期和蛹期)进行了详细观察。在实验室条件下,日本开臂反颚茧蜂从卵发育到成虫需要16 d左右,其中卵期2.38±0.01 d,幼虫期5.36±0.07 d,蛹期8.30±0.04 d(图1)。我们还发现日本开臂反颚茧蜂对黑腹果蝇寄生效率很高,平均寄生率为94.9%±4.0%,平均出蜂率为64.3%±7.1%(表2)。同时,我们也发现寄生会引起黑腹果蝇在幼虫期和蛹期分别产生25.8%和6.6%的死亡率(表2),推测其可能与日本开臂反颚茧蜂具有较强的毒液作用有关。有研究表明日本开臂反颚茧蜂的毒液能导致寄主暂时麻痹瘫软,从而利于寄生蜂的产卵(Furihata and Kimura,2009)。另外,Mitsui等(2007)发现,在日本北部境内发现的日本开臂反颚茧蜂种群的生殖方式为产雌孤雌生殖,而在南部境内发现的日本开臂反颚茧蜂种群为有性生殖。因此,本实验室在浙江台州地区采集的日本开臂反颚茧蜂和日本北部境内的种群较为相似,可能都是由于胞内共生菌Wolbachia所导致的孤雌生殖(Kremer,2009)。 日本开臂反颚茧蜂寄生黑腹果蝇后,果蝇的生长发育速度明显减缓,50%寄主化蛹时,寄主幼虫化蛹时间延长了约0.5 d,占整个幼虫发育期的10%(图3)。寄生蜂寄生引起寄主生长发育延缓这一现象在其他寄生体系中普遍存在,推测其可能满足寄生蜂自身生长发育所需要(周思聪等,2018)。寄生蜂在寄生时通常会将一些寄生因子连同蜂卵一起注射至寄主体内,这些寄生因子包括毒液、多分DNA病毒、类病毒颗粒、畸形细胞、卵巢蛋白和幼蜂分泌物等(叶恭银等,2019)。本实验室前期研究发现菜蛾盘绒茧蜂Cotesiavestalis会释放一些源于多分DNA病毒和畸形细胞的microRNAs至寄主小菜蛾Plutellaxylostella体内,从而下调蜕皮激素受体的表达水平,最终延缓寄主的生长发育(Wangetal.,2018)。有意思的是,日本开臂反颚茧蜂目前只发现有毒液这一种寄生因子,其毒液蛋白如何调控寄主的生长发育还需后续进一步的研究和探索。 寄生蜂往往采取不同的策略去克服寄主的免疫系统,进而成功寄生。其寄生策略主要包括免疫抑制型和免疫逃避型(Labrosseetal.,2003)。所谓免疫抑制型,即寄生蜂通过寄生因子抑制寄主的免疫反应;而免疫逃避型,是指寄生蜂通过粘附或降低寄主识别等机制逃避寄主的免疫反应。果蝇寄生蜂L.boulardi寄生后引起寄主的大量蛋白裂解酶基因、Toll和JAK/STAT信号通路相关基因以及黑化级联反应相关基因的显著上调,其免疫抑制机制不明显。它通过将卵粘附到寄主组织避免寄主的包囊反应,是一种典型的免疫逃避型策略。同一属的L.heterotoma寄生会引起果蝇寄主血细胞的裂解、造血器官淋巴腺消失和免疫相关基因的表达显著降低,免疫抑制作用明显,是一种典型的免疫抑制型策略 (Schlenkeetal.,2007)。研究还发现,L.heterotoma和L.boulardi毒液蛋白组分也存在明显差异,这可能与其采用的不同寄生策略有关(Colinetetal.,2013)。本研究发现,当黑腹果蝇被日本开臂反颚茧蜂寄生后,与体液免疫相关的Toll和Imd通路的大部分基因表达没有变化,而抗菌肽基因Drosomycin和Diptericin表达量均显著上调,表明寄生可能导致Toll通路和Imd通路上游基因的编码蛋白磷酸化,使其编码蛋白活性发生改变(Lemaitre and Hoffmann,2007;Tang,2009),而非直接转录水平的影响。有意思的是,寄生蜂寄生不仅能提高寄主的抗菌能力,而且还能主动分泌一些抗菌肽协助寄主抵御病原微生物的感染,从而保证寄生成功(Gaoetal.,2016)。另外,寄生后,与黑化相关的原酚氧化酶基因PPO1表达量显著下调(图4)。这个结果和日本开臂反颚茧蜂寄生后寄主果蝇无黑化反应的现象相一致,说明日本开臂反颚茧蜂通过下调寄主酚氧化酶(PO)活性,进而抑制寄主体液免疫能力。Furihata等(2013)发现,向果蝇体内注射日本开臂反颚茧蜂的毒液,能引起抗菌肽基因表达量显著上调,这和我们的实验结果相吻合。这些结果表明,寄生蜂一方面通过下调寄主PPO1的表达,去抑制寄主黑化免疫反应;另一方面通过上调寄主抗菌肽,去增强寄主抵抗微生物感染的能力。正是由于这一反一正两种截然不同的免疫调节机制,才能保证寄生蜂后代在寄主体内正常发育。 本研究发现黑腹果蝇是日本开臂反颚茧蜂一种合适的规模化养殖替代寄主。日本开臂反颚茧蜂寄生黑腹果蝇后,通过延缓寄主的生长发育、抑制寄主的体液免疫以及提升寄主的抗菌能力,从而保障了很高的寄生效率。研究结果为大量繁殖与释放日本开臂反颚茧蜂,用以防治斑翅果蝇的危害,提供了必要的理论依据和技术支撑。2 结果
2.1 日本开臂反颚茧蜂的发育历期及形态特征

2.2 日本开臂反颚茧蜂的寄生率及出蜂率
2.3 日本开臂反颚茧蜂寄生对黑腹果蝇生长发育的影响

2.4 日本开臂反颚茧蜂寄生对黑腹果蝇Toll,Imd和PO免疫通路关键基因的影响


3 讨论
