N,N′-二环己基二氮烯-N,N′-二氧化物的合成
2021-03-09张珍明黄文静彭晓含李树安
张珍明, 夏 天, 黄文静, 彭晓含, 陈 达, 李树安
(江苏海洋大学 化学工程学院, 江苏 连云港 222005)
亚硝基烷烃在各种生物的代谢中起重要作用,如一些含氨药物可能被代谢为亚硝基化合物[1].N,N′-二环己基二氮烯-N,N′-二氧化物,是亚硝基环己基二聚体,用X-ray单晶衍射测定出其分子中两个O原子位于—N==N—的异侧,故又称为(E)-偶氮二氧环己烷;光照下二聚体易于转化为环己酮肟,经Beckmann重排得到的已内酰胺是合成尼龙-6的单体[2-3];与活性高分子反应生成功能化聚合物[4];也可作为齐格勒-纳特反应的助催化剂[5].
N,N′-二环己基二氮烯-N,N′-二氧化物制备方法主要有3种:
1) 以环己烷为原料,用亚硝基叔丁酯为亚硝化剂,在7~10 ℃、405 nm光催化下反应48 h,收率81.5%(含8%环己酮肟)[1,6],改用N-羟基邻苯二甲酰亚胺(NHPI)为催化剂以替代光催化,在80 ℃、氩气保护下的醋酸中反应,收率51%[7];2) 以1-二环己基亚硝酸酯为原料,在1~100 mmHg、250~400 ℃及惰性气体保护下,热分解得N,N′-二环己基二氮烯-N,N′-二氧化物(收率44.3%)及环乙酮[8],此法设备要求较高、收率低且难以提纯;3) 以环己胺为原料,采用90%(ω/ω)过氧化氢和乙酸酐先制备过氧乙酸以氧化环己胺,收率44%,由于高浓度过氧化氢存在安全隐患,改用10倍量固体SPC(过碳酸钠,过氧化氢来源)与TAED(四乙酰基乙二胺,酰基供体)为氧化剂,在548倍水与101倍乙酸乙酯(或155倍二氯甲烷)的混合溶剂中,氧化环己胺2~3 h,收率为100%[1,9].方法3)收率高,操作简便,但过氧化物和溶剂用量过大,为了克服该法不足,本文用SPC-50%H2O2-TAED为组合氧化剂,减少溶剂和SPC用量,利用50%过氧化氢中的水溶解部分SPC,不降低过氧化氢浓度,使反应能够在水和乙酸乙酯两相中进行,制备出N,N′-二环己基二氮烯-N,N′-二氧化物,收率为98.3%.反应方程式如下:

1 实验部分
1.1 试剂与仪器
环己胺(CP,北京百顺化工有限公司);过氧化氢(质量分数50%)、乙酸乙酯、氢氧化钾(AR,上海达瑞化工有限公司);过碳酸钠(Na2CO3·1.5H2O2,
纯度>97%,上海麦克林有限公司)、四乙酰乙二胺(工业级,湖北信康医药化工有限公司).
Bruker-Vector22傅立叶红外光谱仪( KBr压片,布鲁克科技有限公司).Bruker-400 MHz ARX400核磁共振仪(TMS为内标,德国布鲁克公司);Agilent Technologies 6230 TOF LC-MC液质联用仪(美国安捷伦公司);SGW X-4型熔点仪(上海仪电光学有限公司).
1.2 实验
取10.0 g(0.10 mol)环己胺、298.0 mL(3.0 mol)乙酸乙酯、288.0 mL(16.0 mol)蒸馏水,电动搅拌速度为180转/min,一定量的TAED(四乙酰乙二胺)、SPC(过碳酸钠)及50%(ω/ω)过氧化氢依次加入反应瓶,用KOH调节pH,室温(25 ℃)下搅拌2.0 h,并室温陈化12.0 h,分离有机层,水层用3×20.0 mL的乙酸乙酯萃取,合并有机层,依次用100.0 mL 水、100.0 mL 10%的稀盐酸洗涤,无水MgSO4干燥4 h,过滤、减压旋蒸,残余物用乙醇重结晶得产物.
2 结果与讨论
N,N′-二环己基二氮烯-N,N′-二氧化物与亚硝基环己烷(单体)之间存在化学平衡[3],最初采用颜色变化进行定性观察:二聚体的无色溶液加热时可逆生成单体的蓝色或绿色溶液,冷却时回到无色二聚体;发现极性介质、0~20 ℃主要以反-二聚体存在,测定25 ℃时从二聚体到单体的解离常数为10-2~10-10.因此,在本文条件下,合成的亚硝基环己烷几乎全部二聚为N,N′-二环己基二氮烯-N,N′-二氧化物.环己胺用组合氧化剂氧化为N,N′-二环己基二氮烯-N,N′-二氧化物为自由基氧化消除反应机理:使用四乙酰基乙二胺替代乙酸的优点是和过氧化氢反应生成过氧乙酸同时产生碱性的有机胺,与酸性的过氧乙酸混合在反应体系内保持反应有较高的pH,不会造成目标产物重排为己内酰胺.过氧乙酸与环己胺发生自由基取代反应,生成环己基羟胺,接着转化为亚硝基环己烷,然后二聚为N,N′-二环己基二氮烯-N,N′-二氧化物.如图1所示.实验固定环己胺和混合溶剂用量,即n(环己胺)∶n(乙酸乙酯)∶n(水)=1∶30∶160,以考察氧化剂各成分投料比、物料是否陈化及陈化时间、反应温度、反应时间和pH对目标产物收率的影响.

图1 推测的反应机理Fig.1 Speculated reaction mechanism
2.1 氧化剂各成分投料比及物料陈化对产物收率的影响
本反应涉及物料较多,若用单因素考察对收率影响,实验次数多.所以采用L8(27)正交实验,在25±1 ℃、pH=10,用SPC-50%H2O2-TAED氧化,考察SPC、50%H2O2、TAED投料量及反应后混合液是否陈化(12 h)对产物收率的影响,因素水平表见表1所列.考虑交互作用的L8(27) 正交实验表头设计与数据分析见表2所列.

表1 L8(27)正交实验因素水平表Tab.1 Factor level table of L8(27) orthogonal experiment
从表2数据分析可知:1) 比较因素水平实验结果的平均值k1、k2可得未计入交互作用时,优选反应条件为A2B2C1D1;2) 极差绝对值大小确定四个影响因素主次顺序为A→B→C→D;3) B和C的交互作用较小(0.4),A与B的交互作用小于A与B单独的影响(2.8),均略去,A与C之间的交互作用(2.0)大于C(1.6)单独的影响,须予以研究,因此,将表2中A与C之间四种搭配的收率平均值列于表3,发现A2C2搭配时收率最高,故计入交互作用时,优选反应条件为A2B2C2D1,即最优的氧化剂配比为n(环己胺)∶n(SPC)∶n(50%H2O2) ∶n(TAED)=1∶3∶3∶1.75,反应后静置陈化12 h收率更高.

表2 L8(27) 正交实验表头设计与数据分析Tab.2 Design and data analysis for L8(27) orthogonal experiments
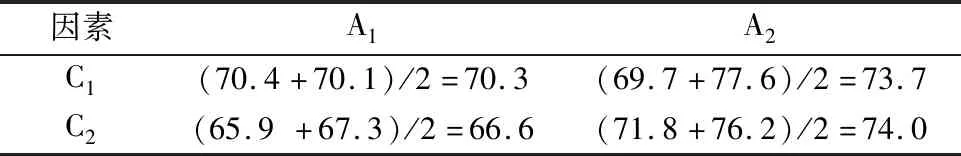
表3 因素A与因素C之间四种搭配的收率平均值Tab.3 The average yield of four combinations between factor A and Factor C
2.2 陈化时间对产物收率的影响
以优化的氧化剂投料比,在25±1 ℃、pH=10,反应2 h后的反应液,分别陈化6、12、18及24 h,以考察陈化时间对产物收率的影响,如图2所示,陈化12 h比6 h产物收率增加1.2%,陈化时间继续增加,产物收率增加缓慢,从经济成本等综合考虑,确定陈化时间为12 h.

图2 陈化时间对产物收率的影响Fig.2 The effect of aging time on yield of desired product
2.3 反应温度和pH对产物收率的影响
优化的氧化剂投料比,反应时间2 h后室温陈化12 h,pH=10,考察反应温度从22~43 ℃对产物收率的影响如图3所示,当反应温度为33 ℃时,反应收率最高,表明33 ℃前反应为热力学控制;温度高于33 ℃,收率下降,原因可能是当反应温度高时单体转化为环己酮肟,使化学平衡从N,N′-二环己基二氮烯-N,N′-二氧化物向生成单体方向移动而使产物收率降低.

图3 反应温度对产物收率的影响Fig.3 The effect of reaction temperature on yield of desired product
优化的氧化剂投料比,温度为33 ℃,反应时间2 h及室温陈化12 h,考察溶液pH 在7.5~10范围对产物收率的影响如图4所示.pH=9时收率最优,当pH大于9.5时收率降低,溶液pH小于8.5时,收率不高.因为过氧化氢在水中可逆电离HOO-和H+,增加反应体系碱性有利于持续提供高浓度HOO-以氧化环己胺生成亚硝基环己烷,同时,环己基与—NO相连的仲碳原子含不稳定的α-H,在酸、碱介质中均易互变异构成肟.
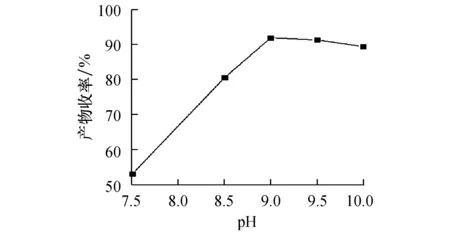
图4 pH对产物收率的影响Fig.4 The effect of pH on yield of desired product
2.4 反应时间对产物收率的影响
优化的氧化剂投料比,溶液pH=9,反应温度为33 ℃,考察反应时间1~5 h(反应后均室温陈化)对产物收率的影响如图5所示.从图可见,反应时间从1 h到3 h增加很快,反应时间3 h产物的收率最高(98.3%),继续增加反应时间,产物收率提高不明显,从成本考虑,选择反应时间为3 h,室温陈化12 h.
图5 反应时间对产物收率的影响Fig.5 The effect of reaction time on yield of desired product
2.5 结构表征
白色晶体,mp:118.5~119.3 ℃(文献[9]值118~119 ℃),IR,σ/cm-1:2 920、2 850 cm-1(环烷基νC—H),1 450、1 390 cm-1(νC—H,与N原子相连的次甲基),1 200 cm-1(痕量亚硝基环己胺单体νN==O),894 cm-1(νN→O),690(νC—NO,面外),对称反式偶氮化合物红外无吸收,反应原料环己胺N—H的特征吸收带在产物中消失,如图6所示;EISMSm/z:理论值C12H22N2O2{[M+H+]}= 227.0,实验值{[M+H+]}=226.9(丰度100%),如图7所示;13C NMR(126 MHz,CDCl3),δ:65.67(环己基上α-C,2C), 28.24(环己基上β-C,4C)、25.02(环己基上δ-C,2C)、24.59(环己基上γ-C,4C),如图8所示,1H NMR(500 MHz, CDCl3),δ5.07(tt,J=11.5,3.8 Hz,2H),1.96(m,J=13.0,2.1 Hz,4H),1.90~1.82(m,4H),1.72~1.62(m,6H),1.42~1.17(m,6H) ,如图9所示.IR、质谱和NMR表征的结构与预期产物的结构一致.

图6 产物的IR谱Fig.6 IR spectrum of desired product

图7 产物的MS谱Fig.7 MS spectrum of desired product

图8 亚硝基环己基二聚体的13C NMR谱Fig.8 13C NMR spectrum of desired product

图9 亚硝基环己基二聚体的1H NMR谱Fig.9 1H NMR spectrum of desired product
3 结论
以SPC-50%H2O2-TAED为氧化剂将环己胺氧化为N,N′-二环己基二氮烯-N,N′-二氧化物,收率为98.3%.与文献报道的方法相比,本文方法具有以下优势:
1) 避免使用有安全隐患的90%H2O2;
2) 用SPC-50%H2O2-TAED作为组合氧化剂,固体SPC、水、乙酸乙酯用量均减少2/3;
3) 50%H2O2可以少量补充反应体系溶解固体SPC需要的水量,同时,因外加过氧化氢和溶剂水量减少,使体系过氧化氢浓度增加了2/3,更利于与TAED生成作为两相氧化剂过氧乙酸;
4) 因H2O2浓度增加使得TAED的投入量减少了2/5.该法原料易得,工艺条件温和、收率高.
致谢:本文得到江苏海洋大学博士启动基金(KQ16001)项目的资助,在此表示感谢.
