猪胸膜肺炎放线杆菌河南株的分离鉴定与药物敏感性分析
2021-03-09彭志锋张晓战蒋增海史洪涛乔宏兴边传周
彭志锋,黄 慧,张晓战,蒋增海,史洪涛,乔宏兴,边传周
(河南牧业经济学院 动物医药学院,河南 郑州 450046)
猪传染性胸膜肺炎(Porcine contagious pleuropneumonia,PCP)是由胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae,APP)引起的一种急性呼吸道传染病[1]。我国多个地区均发生和流行过PCP,每年造成养猪业重大损失[2-4]。近年来,APP分离率及传染性胸膜肺炎的发病率呈上升趋势[2,5]。同时,由于我国养猪业长期大量使用抗菌药,导致细菌多重耐药现象普遍,严重危害到人类健康。为此,我国农业农村部194号公告规定,自2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料。因此,限制抗生素使用情况下如何养好猪成为行业热点。APP细菌血清型众多,且不同地区菌株的耐药性差异较大,因而持续性监测致病菌的流行及药物敏感性,对于减少抗菌药物的使用、为PCP防控的精准用药提供科学依据是非常必要的。为此,分离鉴定APP,并在药敏试验基础上对四环素耐药基因进行PCR扩增和测序,以丰富APP的耐药性现状,并为临床用药提供科学依据,以利于更好地控制PCP。
1 材料和方法
1.1 菌株来源
从河南省信阳、商丘、安阳、洛阳、许昌五地区临床表现猝死、口鼻流血色泡沫的病死猪的肺脏中分离菌株;药敏试验质控菌株APP ATCC27090和大肠杆菌ATCC25922购自中国普通微生物菌种保存中心。
1.2 试剂
TSA、TSB购自北京奥博星生物技术有限责任公司;2×TaqMasterMix、DL2000 DNA Marker购自宝生物工程(大连)有限公司;质粒提取试剂盒和胶回收纯化试剂盒购自生工生物工程(上海)股份有限公司;NAD、琼脂糖、Ⅰ型GoldView购自北京索莱宝科技有限公司;胎牛血清购自浙江天杭生物科技股份有限公司;生化反应管和药敏片购自杭州滨和微生物试剂有限公司。
1.3 菌株分离
用无菌棉拭子采集猪肺脏分泌物。将棉拭子涂布于巧克力琼脂平板上,在37 ℃下恒温培养12~24 h后观察菌落。挑取疑似菌落划线接种到含有NAD的TSA琼脂平板上培养,挑取菌落进行革兰氏染色、镜检。
1.4 NAD依赖性与生化鉴定
将疑似APP菌落分别接种于不含和含有NAD的TSB液体培养基中,37 ℃恒温振荡培养12~24 h,观察液体培养基浑浊度;将NAD依赖性疑似菌分别接种于微量生化鉴定管中,每管加入1 μL NAD(200 g/L),37 ℃下培养18~24 h,观察生化反应结果。
1.5 PCR鉴定
参考BOSSE等[6]设计通用型APP检测引物APP-F:5′-TTATCCGAACTTTGGTTTAGCC-3′,APP-R:5′-CATATTTGATAAAACCATCCGTC-3′。预期扩增条带大小为418 bp,引物由生工生物工程(上海)股份有限公司合成。分别用APP ATCC27090和大肠杆菌ATCC25922作为阳性对照和阴性对照。煮沸法提取分离菌株的核酸。反应体系(25 μL):2×TaqMaster Mix 12.5 μL,ddH2O 9.5 μL,上下游引物各1 μL,模板1 μL。反应程序:95 ℃预变性5 min;95 ℃ 1 min,54 ℃ 30 s,72 ℃ 30 s,30个循环;最后72 ℃ 10 min。取8 μL PCR产物进行1.5%琼脂糖凝胶电泳。PCR产物纯化后送生工生物工程(上海)股份有限公司测序。
1.6 APP分离菌株药物敏感性分析
参照CLSI2009规定的方法,采用K-B法检测APP分离菌株对氧氟沙星(OFL)、左氧氟沙星(LEV)、氨苄青霉素(AMP)、青霉素(PEN)、头孢噻肟(CTX)、头孢曲松(CTR)、庆大霉素(GEN)、卡那霉素(KAN)、阿米卡星(AKI)、环丙沙星(CIP)、多西环素(DOX)、四环素(TET)、磺胺甲噁唑(SMZ)、多黏菌素B(PB)和甲硝唑(MTR)15种抗菌药物的敏感性,用质控菌株进行质控。
1.7 四环素耐药基因检测
根据药敏试验结果,将耐四环素APP分离菌株接种于含NAD的TSB液体培养基中,37 ℃过夜培养,用质粒提取试剂盒提取质粒;选择APP ATCC27090作为四环素耐药基因阴性对照菌株。参照文献[7—9]设计检测四环素耐药基因引物,引物由生工生物工程(上海)股份有限公司合成。用多重PCR方法检测tetA、tetB、tetC、tetD、tetE、tetG、tetH、tetK、tetL、tetM和tetO,引物和退火温度见表1。采用50 μL反应体系:2×TaqMaster Mix 25 μL,上下游引物各1 μL,模板1 μL,ddH2O 22 μL。PCR反应程序:95 ℃预变性5 min;95 ℃ 1 min,55 ℃ 1 min,72 ℃ 80 s,30个循环;最后72 ℃ 10 min。取8 μL PCR产物进行1.5%琼脂糖凝胶电泳。扩增产物用胶回收试剂盒纯化后由生工生物工程(上海)股份有限公司测序。
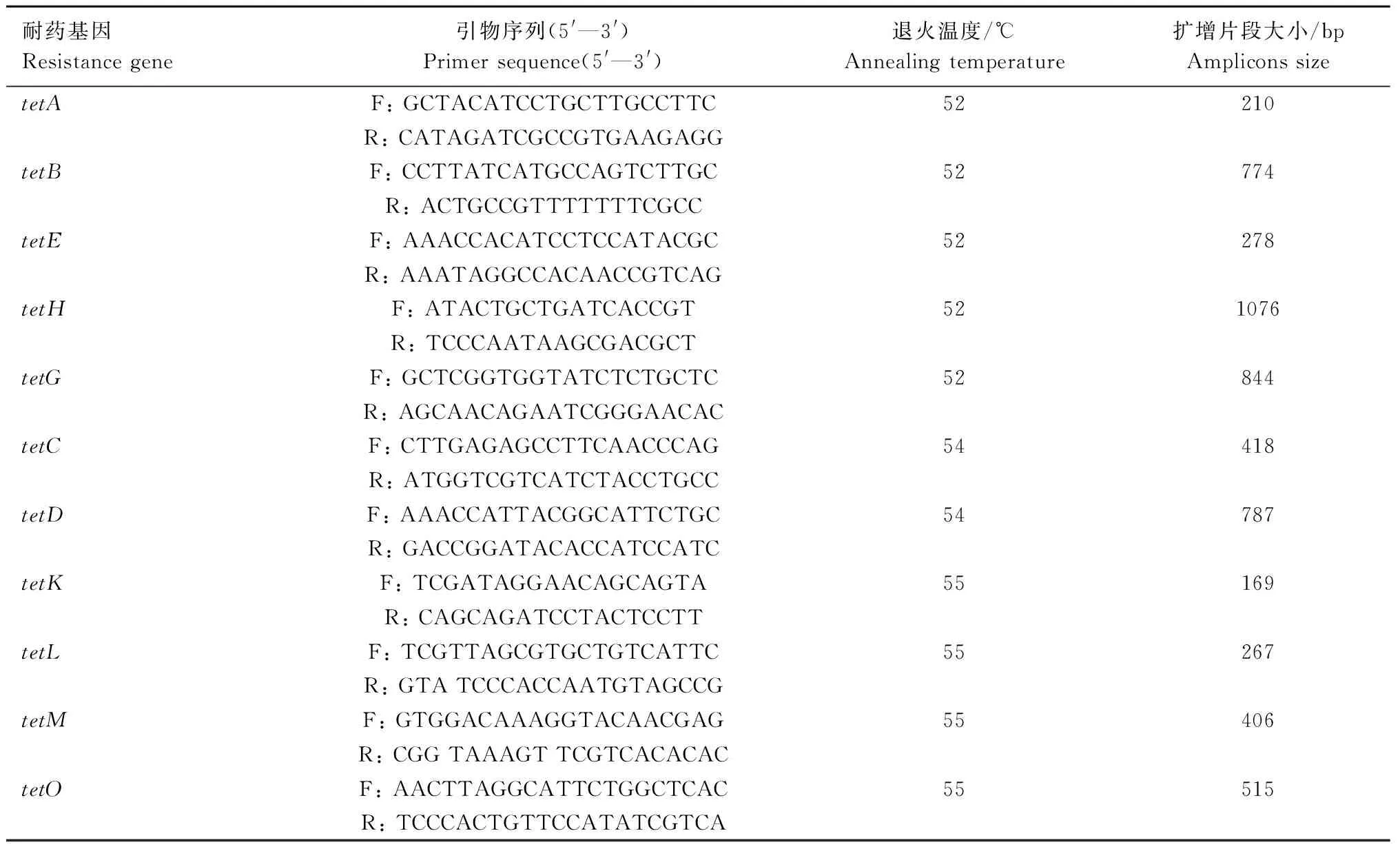
表1 PCR扩增四环素耐药基因引物Tab.1 PCR primers of tetracyline-resistant genes
2 结果与分析
2.1 5株APP菌株的分离鉴定
分离菌株在巧克力琼脂平板上培养后呈灰白色、半透明、针尖大小、中间微微凸起、表面光滑的圆形或椭圆形菌落(图1A)。分离菌株在含NAD的TSA琼脂平板上的菌落呈散在的、大小不均、单个黄白色圆点状。相对于巧克力琼脂平板上的菌落,培养相同时间后,TSA琼脂平板上的菌落较大(图1B)。革兰氏染色的分离菌株呈散在的、红色、大小均匀的短杆菌(图1C),形态特征与APP相符。分离菌株在不含NAD的TSB液体培养基中不生长。5株分离菌株均可发酵葡萄糖、果糖、木糖、蔗糖、麦芽糖产酸,不发酵山梨醇,靛基质、V-P试验、MR试验均为阴性(表2),生化反应结果与APP生化特性一致。
用APP通用型引物进行PCR检测,结果显示,扩增片段大小与预期相符(图2)。培养试验、生化试验和PCR鉴定结果均表明成功地分离了5株APP菌株,分别命名为APP-XY、APP-SQ、APP-AY、APP-LY、APP-XC。
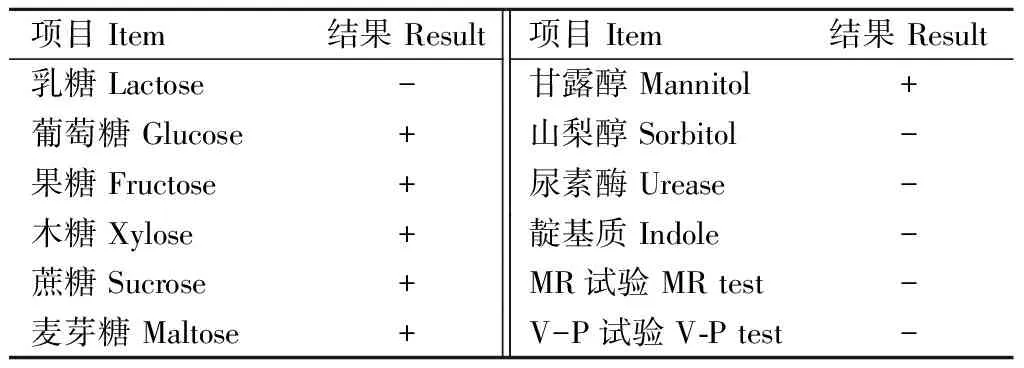
表2 APP分离菌株生化反应结果Tab.2 Results of biochemical tests for isolated APP strains
2.2 5株APP分离菌株的耐药表型
按照K-B法测定的5株APP分离菌株耐药表型见表3。APP菌株对四环素(5/5,100%)、氨苄青霉素(3/5,60%)、青霉素G(3/5,60%)、甲硝唑(3/5,60%)耐药;5株APP分离菌株均对氧氟沙星、左氧氟沙星、头孢噻肟、头孢曲松、磺胺甲噁唑、多黏菌素B敏感。

表3 APP分离菌株对不同抗菌药的药敏试验结果Tab.3 Results of susceptibility test of APP strains
2.3 5株APP分离菌株的四环素耐药基因检测
5株APP分离菌株扩增的目的条带与预期的tetB和tetA扩增长度符合(图3),且测序结果表明,5株APP分离菌株均含有四环素耐药基因tetB和tetA;而5株APP分离菌株中均未检测出四环素耐药基因tetC、tetD、tetE、tetG、tetH、tetK、tetL、tetM和tetO。
3 结论与讨论
APP是感染猪呼吸系统的主要致病菌之一,常与支原体、猪繁殖与呼吸综合征病毒、巴氏杆菌、副猪嗜血杆菌混合感染,造成猪群严重伤亡。由于没有明确的鉴别培养基,且APP对营养要求苛刻,其分离鉴定需要采用不同的方法依次进行。本研究首先利用巧克力琼脂培养基培养出疑似菌株,选取NAD依赖性菌株进行生化鉴定。不同地区APP菌株的生化反应存在一定差异。本研究中,APP河南分离菌株与四川分离菌株均能发酵蔗糖产酸,但尿素酶反应结果不同[10-11],而且APP河南分离株与天津分离株蔗糖反应结果也不同。这些生化反应的差异反映出不同地区APP分离菌株的生物学特性不完全一致。
APP菌株四环素耐药性普遍。我国新疆、四川、天津、河南等多个地区APP分离菌株均表现出较强的四环素耐药性[11-14]。本研究中,APP分离菌株表现出的四环素耐药性再次反映了当前APP流行菌株对四环素普遍不敏感。为预防和治疗病原菌引起的呼吸道感染,在养殖过程中通过饮水、饲料或肌肉注射使用了大量β-内酰胺类、大环内酯类和四环素类药物,病原菌长期接触抗菌药物产生抗药性[15-16]。APP菌株普遍的四环素抗性与农场长期使用四环素类药物有密切关系。
不同地区APP菌株耐药谱存在差异。2016年,李海利等[14]报道河南省APP分离菌株对磺胺甲噁唑和磺胺甲噁唑/甲氧苄啶均耐药;2017年,余波等[17]报道贵州等地分离出的31株APP菌株均对磺胺二甲嘧啶钠耐药;2018年,王申森[18]报道APP对磺胺异噁唑的耐药率为100%。而本研究中,5株APP分离菌株对磺胺甲噁唑、左氧氟沙星、氧氟沙星、头孢曲松、头孢噻肟均敏感。这一方面可能与不同地区的用药习惯有一定关系;另一方面,不同地区流行的菌株不同,不同菌株携带的耐药基因存在差异。
四环素类抗菌药通过干扰氨酰基-tRNA与细菌核糖体的结合来抑制细菌蛋白质合成发挥抑菌作用,而革兰氏阴性细菌对四环素的耐药机制之一是利用外排作用有效降低胞内四环素浓度。2006年,BLANCO等[19]报道,四环素APP西班牙分离菌株中tetB、tetO、tetH检测率分别为70%、17%、4%;而在耐四环素APP澳大利亚分离菌株中tetB的检出率更高(92.5%),仅有1株耐四环素APP检测到tetH,其他四环素耐药基因均未检测到[9]。本研究中,耐四环素APP菌株全部检测到编码外排泵蛋白的tetB(5/5,100%)和tetA(5/5,100%),没有检测到其他四环素耐药基因,与上述报道一致。tetB和tetA的检出提示,APP药物敏感度下降、四环素抗性与外排泵蛋白的药物外排作用有关[20]。四环素耐药基因通常在可接合的质粒或转座子上,使得四环素耐药基因可以在菌株间水平传播[20]。加拿大和西班牙APP菌株中均曾检测到tetH[19,21],尽管鲜有国内APP菌株检出tetH的报道,加强其监测对于了解四环素耐药基因传播仍非常有意义。综上,APP河南分离株具有多重耐药性,且其四环素耐药性主要由药物外排机制介导。
