背根神经节血红素加氧酶1 过表达缓解小鼠神经病理性疼痛 *
2021-03-09邵寒雨符元元赵林霞高永静张志军
邵寒雨 符元元 王 娟 赵林霞 高永静 张志军,3
(1 南通大学医学院人体解剖学系,南通226001;2 南通大学特种医学研究院,南通226019;3 南通大学疼痛医学研究院,南通 226019)
神经病理性疼痛是指躯体感觉系统的损伤或疾病而直接造成的疼痛,是临床上难治性疾病,据流行病学统计,其影响7%~10% 社会人口,我国的神经病理性疼痛病人约9000 万人;神经病理性疼痛症状存在时间长,可在原发疾病治愈后,痛觉异常(痛觉过敏、触诱发痛和自发性疼痛)依然存在,甚至持续终生[1,2];这种长期存在的痛觉异常会使病人痛苦不堪、精神异常,严重影响病人的躯体和社会功能,也给家庭和社会带来沉重的经济负担[1]。目前,临床常用的镇痛药如阿片类药物、抗惊厥类药物、局部麻醉药、抗抑郁药等对神经病理性疼痛的治疗效果并不理想[1,2]。深入了解神经病理性疼痛的机制,必将为临床治疗提供有力的依据。
血红素加氧酶1 (heme oxygenase 1, HO-1) 分子量为32 KD,位于微粒体内,是一种应激反应蛋白,能被多种氧化应激产物所诱导表达[3]。HO-1 是体内分解血红素(heme)的限速酶,分解产生CO、自由铁 (Fe2+)和胆绿素,胆绿素随即被胆绿素还原酶还原成胆红素。HO-1 也称为热休克蛋白32 (heat shock protein 32, HSP32),作为保护性基因在多系统及组织细胞中被广泛研究,具有抗炎、抗氧化、抗凋亡、抗增殖等特性[4]。HO-1 在正常细胞内表达很少,但在炎症氧化应激下,HO-1 可被诱导表达,因此在细胞炎症状态下,HO-1 是关键的分解血红素 (heme) 的限速酶[5]。内源性的CO 作为第二信使分子,影响细胞的炎症、增殖、凋亡;胆绿素和胆红素都具有抗氧化特性;铁离子能诱导细胞内铁蛋白表达增加,进而能有效清除细胞内的铁离子。HO-1 基因缺失的人表现和HO-1 基因敲除的小鼠表现相似,可表现为慢性炎症反应、组织中铁沉积、淋巴结病、白细胞增多以及细胞易受到氧化应激损伤[6]。
接受皮肤痛觉信息的外周感觉神经元 (peripheral sensory neurons) 的胞体主要位于背根神经节(dorsal root ganglion, DRG) 和三叉神经节 (trigeminal ganglion, TG) 中[7~9]。这些感觉神经元可以根据细胞大小和基因表达特征分为不同类型,如肽能和非肽能的中小直径神经元负责伤害性信息感受,而大直径神经元负责触觉和本体感受[7,10]。本课题组前期的研究显示,外周神经损伤小鼠脊髓背角中HO-1诱导过表达后能缓解多种疾病诱导的神经病理性疼痛[11~13],但HO-1 在DRG 中表达和分布以及DRG中HO-1 在外周神经损伤诱导的神经病理性疼痛中的作用还未见报道。外周神经损伤后可导致DRG中神经元炎症氧化应激[7],为此,本研究将探讨DRG 中的HO-1 表达分布,以及在神经病理性疼痛中作用。本研究结果将为临床研发治疗神经病理性疼痛新药物提供新的策略和实验依据。
方 法
1. 实验动物
成年雄性ICR 小鼠(25~35 g)购自南通大学实验动物中心。小鼠饲养于独立通风笼具,维持12 h/12 h的明暗光照循环,环境温度为22±2°,相对湿度为40%~70%,保持食水充足。本研究中的动物实验依据国际疼痛学会的指南,并经南通大学动物伦理委员会批准进行。保留性坐骨神经损伤 (spared nerve injury, SNI) 诱导的神经病理性疼痛模型的构建是在腘窝中将坐骨神经的胫神经和腓总神经两大分支用6-0 丝线紧紧结扎,并去除远侧端2 mm神经组织,手术过程中完整保留坐骨神经的腓肠神经分支[14,15]。
2. 药物和给药途径
HO-1 诱导剂原卟啉IX 氯化钴 (cobalt protoporphyrin-IX, CoPP) 购自Santa Cruz 公司,溶于含2% DMSO 的0.01 M 的PBS 中。CoPP 腹腔注射剂量为1 mg/kg 和5 mg/kg 两种剂量,首次于SNI 造模后立即给药,连续给药5 天;对照组注射相应的溶剂(含2% DMSO 的0.01 M 的PBS),注射时程与CoPP 相同[11,12]。
3. 疼痛行为学检测
小鼠在行为检测前两天适应测试环境,行为检测过程中环境温度和湿度保持相对稳定。机械性触诱发痛测试时,小鼠放置在金属网格架上方的塑料盒中适应30 min 后开始检测[11,12]。用系列von Frey细丝(0.02~2.56 g)刺激小鼠足底,垂直刺激5 次,每次2~3 s。如果有3 次以上的抬爪或舔爪反应,即为阳性反射。最终用机械缩足阈值表示,其数值根据Dixon 的up-down 计算方法得出,机械缩足阈值数值越低说明机械性触诱发痛越严重。
4. 免疫荧光染色
小鼠用异氟烷(深圳市瑞沃德生命科技有限公司)气体麻醉后,从主动脉起始处灌注0.01 M 的PBS,随后用4%多聚甲醛 (Sigma-Aldrich) 固定液灌注。DRG 和脊髓组织在固定液中固定4°过夜,随后在30%蔗糖 (Sigma-Aldrich) 中脱水。冰冻切片机 (Leica) 中脊髓行30 μm 漂片,DRG 行15 μm 贴片。组织切片先用5%驴血清室温封闭2 h,随后孵育一抗4°过夜:HO-1 (rabbit, 1:1000, Enzo Life Sciences)、CGRP (mouse, 1:3000, Sigma-Aldrich)、NF200 (mouse, 1:1000, Millipore);切片漂洗后加下列荧光试剂或二抗:IB4-FITC (1:200, Sigma-Aldrich)、Donkey anti-rabbit cy3 (1:1000, Jackson ImmunoResearch)、Donkey anti-rabbit 488 (1:1000, Jackson ImmunoResearch)、Donkey anti-mouse 488 (1:1000, Jackson ImmunoResearch)。切片的荧光信号用荧光显微镜拍摄 (Nikon Eclipse Ni-E),并用Image J 软件分析统计。
5. Western blot
小鼠L4和L5的DRG 取材后用含蛋白酶抑制剂 (Sigma-Aldrich) 的蛋白裂解液 (RIPA, Millipore) 提取蛋白质,BCA 法测定蛋白质浓度(BCA 购自ThermoFisher scientific)。SDS-PAGE 凝胶电泳每孔加30 μg 总蛋白,电泳后转膜至PVDF 膜,用5%脱脂牛奶封闭,随后孵育一抗:HO-1 (rabbit, 1:1000, Enzo Life Sciences)、GAPDH (rabbit, 1:1000, Millipore);PVDF 膜漂洗后加下列荧光二抗:IRDye 800CW goat-anti-rabbit (1:10 000, LI-COR), 用Odyssey CLx system 获取条带图片。条带的显色强度分析使用Image J 软件。
6. 病毒鞘内注射
小鼠用异氟烷吸入麻醉后,在小鼠L4和L5腰椎间隙中,将过表达HO-1 的AAV (AAV2/9-hSyn-HO-1-mCherry) 和对照病毒 (AAV2/9-hSyn-MCSmCherry) 行鞘内注射,剂量为10 μl,病毒滴度为1.0E + 13 v.g./ml。小鼠苏醒后立即放回饲养笼中,饲养3 周后小鼠机械缩足阈值测定后行SNI 模型,在SNI 后的设定时间点进行疼痛行为学检测。
7.统计学分析
统计分析软件用GraphPad Prism 8.0.1,所有数据采用均数±标准误 (±SEM)表示。行为学数据用双因素重复测量方差分析 (Two-way repeated measures ANOVA),如果有差异,进一步用Bonferroni's test 比较不同时间点差异。免疫荧光和western blot 数值的两组比较用Student's t test,三组比较用 One-way ANOVA。P < 0.05 为差异具有统计学意义。
结 果
1. SNI 诱导DRG 中HO-1 阳性神经元数量减少
本研究使用免疫荧光来检测DRG 中HO-1 的表达定位和分布,免疫荧光染色显示结果:在正常小鼠和手术对照组小鼠DRG 中有大量的HO-1 阳性神经元,约占总神经元数量的22%(见图1 A, B, E);而SNI 造模后3 天和10 天时,HO-1 阳性神经元的数量较正常组大幅度下降,分别为9.6%和8.2%(见图1 C-E)。
2. DRG 中HO-1 阳性神经元的定位分布
DRG 感觉神经元根据胞体大小和基因表达模式分成几种类型:非肽类神经元是IB4 阳性并且是小直径无髓鞘的神经元;肽类神经元是中直径的薄髓鞘的神经元表达CGRP;大直径神经元的髓鞘较厚,表达NF200[10]。本研究用免疫荧光双标显示:HO-1 与IB4 共标较多(见图2A-C),统计显示HO-1 阳性神经元中93.4%是IB4 阳性神经元,IB4 阳性神经元中96.5%是HO-1 阳性神经元(见图2J);而HO-1 与CGRP 以及与NF200 共标很少(见图2D-I),统计显示HO-1阳性神经元中只有1.5%左右的CGRP 神经元,同样的CGRP 阳性神经元中也只有0.9%的HO-1 阳性神经元(见图2K);另外,HO-1 阳性神经元中只有1.3%左右的NF200 神经元,NF200 阳性神经元中也只有1.1%的HO-1 阳性神经元(见图2L)。胞体大小分布统计显示HO-1 阳性神经元主要集中在300 μm²面积以下的小型细胞(见图2M)。
3. HO-1 诱导剂CoPP 减轻SNI 诱导的神经病理性疼痛
在SNI 造模后立即腹腔注射HO-1 诱导剂CoPP,每天1 次,连续注射5 天(见图3A)。行为学结果显示,在造模前各自的机械缩足基础阈值(baseline, BL)无显著性差异,注射溶剂对照组的SNI 小鼠在造模后1 天机械缩足阈值就显著降低,表明小鼠产生了机械性触诱发痛,并且持续21 天以上(见图3B);连续注射高剂量的CoPP (5 mg/kg)后,SNI 诱导的机械性触诱发痛在7 天时较溶剂对照组减轻,疼痛缓解持续到造模后14 天以上(见图3B);连续注射低剂量的CoPP (1 mg/kg)后,SNI 诱导的机械性触诱发痛较溶剂对照组无显著性差异(见图3B)。
4. DRG 神经元过表达HO-1 显著缓解SNI 诱导的神经病理性疼痛

图1 免疫荧光染色显示DRG 中HO-1 阳性神经元在SNI 后的变化 (n = 5, ±SEM)(A)正常组DRG 中HO-1 阳性神经元;(B) 假手术10 天组DRG 中HO-1 阳性神经元;(C) SNI 3 天组DRG 中HO-1 阳性神经元;(D) SNI 10 天组DRG 中HO-1 阳性神经元;(E)各组DRG 中HO-1 阳性神经元占总神经元数量的百分比统计;*P < 0.05,与正常组相比,#P < 0.05,与假手术10 天组相比Fig. 1 Immunofluorescence staining shows the change of HO-1+ neurons in the DRG after SNI (n = 5, ±SEM)(A) DRG HO-1+ neurons in the Naive mice; (B) DRG HO-1+ neurons in the Sham 10 d mice; (C) DRG HO-1+ neurons in the SNI 3 d mice; (D) DRG HO-1+ neurons in the SNI 10 d mice; (E) Statistical data show the percentage of HO-1+ neurons in the DRG. *P < 0.05, compared with the Naive group; #P < 0.05, compared with the Sham 10 d group.
小鼠在测定机械缩足的基础阈值后,鞘内注射过表达HO-1 的AAV 和对照病毒(见图4A),21 天后行SNI 造模,造模前1 天再测两组机械缩足的基础阈值。鞘内注射病毒28 天后DRG 组织切片显示AAV 能浸染大部分DRG 神经元(见图4B),脊髓组织切片显示AAV 能显示DRG 神经元到达脊髓背角的末梢,而未见AAV 浸染脊髓神经元(见图4C)。Western blot 结果显示过表达HO-1的AAV 较对照病毒能显著上调DRG 中HO-1 的表达,上调幅度约3 倍(见图4D, E)。免疫荧光染色显示对照AAV 病毒浸染的神经元中约50%能表达内源性HO-1,而约82%内源性HO-1 神经元能被AAV 病毒浸染(见图4F-I)。行为学检测显示,鞘内注射病毒前两组基础阈值没有差别,注射病毒后SNI 造模前的基础阈值也没有差异。SNI 造模后3 天起过表达HO-1 小鼠的机械性触诱发痛明显较对照AAV组缓解,这种缓解能持续21 天以上(见图4J)。
讨 论
本课题组前期研究的结果显示HO-1 诱导剂CoPP 能有效缓解骨癌痛[13],还能有效减轻长春新碱诱导的化疗痛和脊神经结扎诱导的神经病理性疼痛。这与腹腔注射CoPP 能上调脊髓部位的HO-1的蛋白和基因表达有关[11~13];特异性在脊髓部位注射过表达HO-1 的病毒能缓解长春新碱诱导的化疗痛和脊神经结扎诱导的神经病理性疼痛[11,12]。免疫荧光定位结果显示化疗痛和外周神经损伤诱导的神经病理性疼痛的脊髓中HO-1 主要表达于星形胶质细胞和小胶质细胞。上调表达脊髓中HO-1 能使胶质细胞的激活减轻和炎症因子表达下调[11,12]。然而外周感觉神经元,如DRG 中的HO-1 表达情况还一无所知。本研究用免疫荧光染色显示DRG 中有大量的HO-1 神经元,并且大部分与IB4 阳性神经元共标,胞体大小分布统计也显示HO-1 阳性神经元主要为小型神经元。外周神经损伤后小型神经元较大型神经元容易损伤[10];而且小型神经元是传导痛觉信息的神经元,所以这些小型神经元的病变与神经病理性疼痛密切相关。因而,这些结果提示小型神经元中HO-1 表达可能与神经损伤后的病理性疼痛相关。
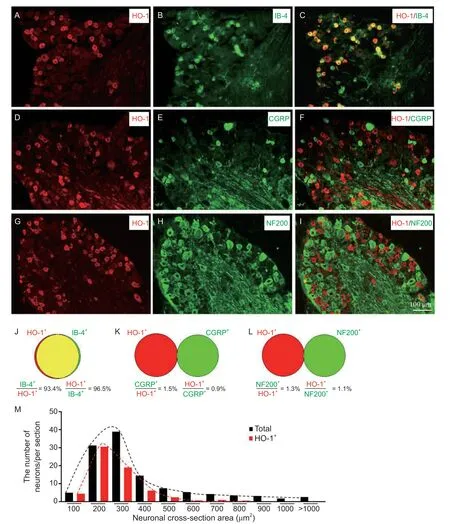
图2 免疫荧光双标染色显示DRG 中HO-1 分别与IB4、CGRP、NF200 共标以及HO-1+神经元大小分布(A-C) HO-1 与IB4 免疫荧光共标染色;(D-F) HO-1 与CGRP 免疫荧光共标染色;(G-I) HO-1 与NF200 免疫荧光共标染色;(J-L) 韦恩图显示DRG 中HO-1+分别与IB4+、CGRP+、NF200+神经元共标百分比;(M) DRG 中HO-1+神经元和总神经元细胞大小分布频率统计Fig. 2 The double immunostaining of HO-1 with IB4, CGRP, NF200 and the cell-size distribution of HO-1+ neurons in the DRG(A-C) The double immunostaining of HO-1 with IB4; (D-F) The double immunostaining of HO-1 with CGRP; (G-I) The double immunostaining of HO-1 with NF200; (J-L) The Venn diagrams showing the double immunostaining of HO-1+ with the IB4+, CGRP+, and NF200+; (M) The cell-size distribution frequency of HO-1+ neurons and total neurons in the DRG.

图3 HO-1 诱导剂CoPP 能缓解SNI 诱导的机械性触诱发痛 (n = 5, ±SEM)(A) 行为学检测和SNI 以及CoPP 给药的时间流程图;(B) CoPP 缓解了SNI 诱导的机械性触诱发痛;*P < 0.05,与溶剂组相比Fig. 3 HO-1 inducer CoPP alleviates SNI-induced mechanical allodynia (n = 5, ±SEM)(A) The timeline of behavioral test and SNI and CoPP treatments; (B) The CoPP attenuated SNI-induced mechanical allodynia. * P < 0.05, compared with the vehicle group.
SNI 模型能诱导小鼠快速(小于24 h)、长时程(大于6 个月)的机械性触诱发痛[14]。本研究的行为学结果也同样显示小鼠在SNI 后1 天就能产生机械性触诱发痛,并能持续21 天(观察时间点内)以上。对于SNI 后3 和10 天的DRG 免疫荧光染色显示HO-1 阳性神经元数量明显较正常组和对照组减少。此前大量文献报道了HO-1 在氧化应激和炎症反应中作用[5,6,16],本课题组前期研究也揭示了脊髓中星形胶质细胞和小胶质细胞中过表达HO-1 能缓解神经炎症反应[11,12],这些分子机制参与了慢性疼痛的进程。因而,我们推断SNI 后DRG 神经元中的HO-1 表达下调可能导致了或加强了神经病理性疼痛的发生和发展。对此,本研究和多个课题组发现腹腔注射CoPP 后行为学检测结果表明诱导HO-1 表达能缓解神经病理性疼痛,然而腹腔注射CoPP 是发挥全身作用,也会影响脊髓和DRG 中HO-1 表达[17,18]。
为了特异性检测DRG 神经元中HO-1 在神经病理性疼痛中的作用,本研究使用了新的策略,即在鞘内注射过表达HO-1 的AAV。形态学结果显示AAV 能高效特异浸染DRG 神经元,并且这些DRG神经元的突起能进入脊髓背角,进一步说明病毒浸染的是DRG 神经元。另外,脊髓中并未观察到病毒浸染的神经元,这说明鞘内注射的病毒不会透过血脑屏障或者脑脊液屏障进入脊髓神经元。Western blot 结果显示过表达HO-1 的AAV 能使DRG 中HO-1大幅度增加,结合行为学结果显示,DRG 中过表达HO-1 组的小鼠神经病理性疼痛能有效缓解,持续缓解21 天以上。在脊髓中,已经证明了上调HO-1表达能缓解神经炎症反应,如胶质细胞激活、炎症因子产生等[11,12]。在外周,我们课题组结果也显示DRG 中神经炎症在神经病理性疼痛的发生发展中发挥了重要作用[7,9,19]。因此,DRG 中HO-1 在神经损伤后的表达减少可能与神经炎症发生有关,而过表达HO-1 可能通过减轻神经炎症反应进而缓解神经病理性疼痛,但具体机制还需要深入研究。在临床上,对DRG 神经元的调控,如电刺激等也能很好地缓解神经病理性疼痛[20],而这种临床治疗是针对DRG 中所有神经元的调控。本研究中用AAV 上调了DRG 中几乎所有类型神经元中的HO-1,原因是目前还没有特异感染IB4 阳性神经元的AAV,但考虑到HO-1 具有抗炎作用,而外周神经损伤后DRG神经元几乎都会受到炎症氧化应激损伤[7,21]。因此,不管是IB4 阳性还是阴性神经元中HO-1 表达上调对神经病理性疼痛缓解是有利的。
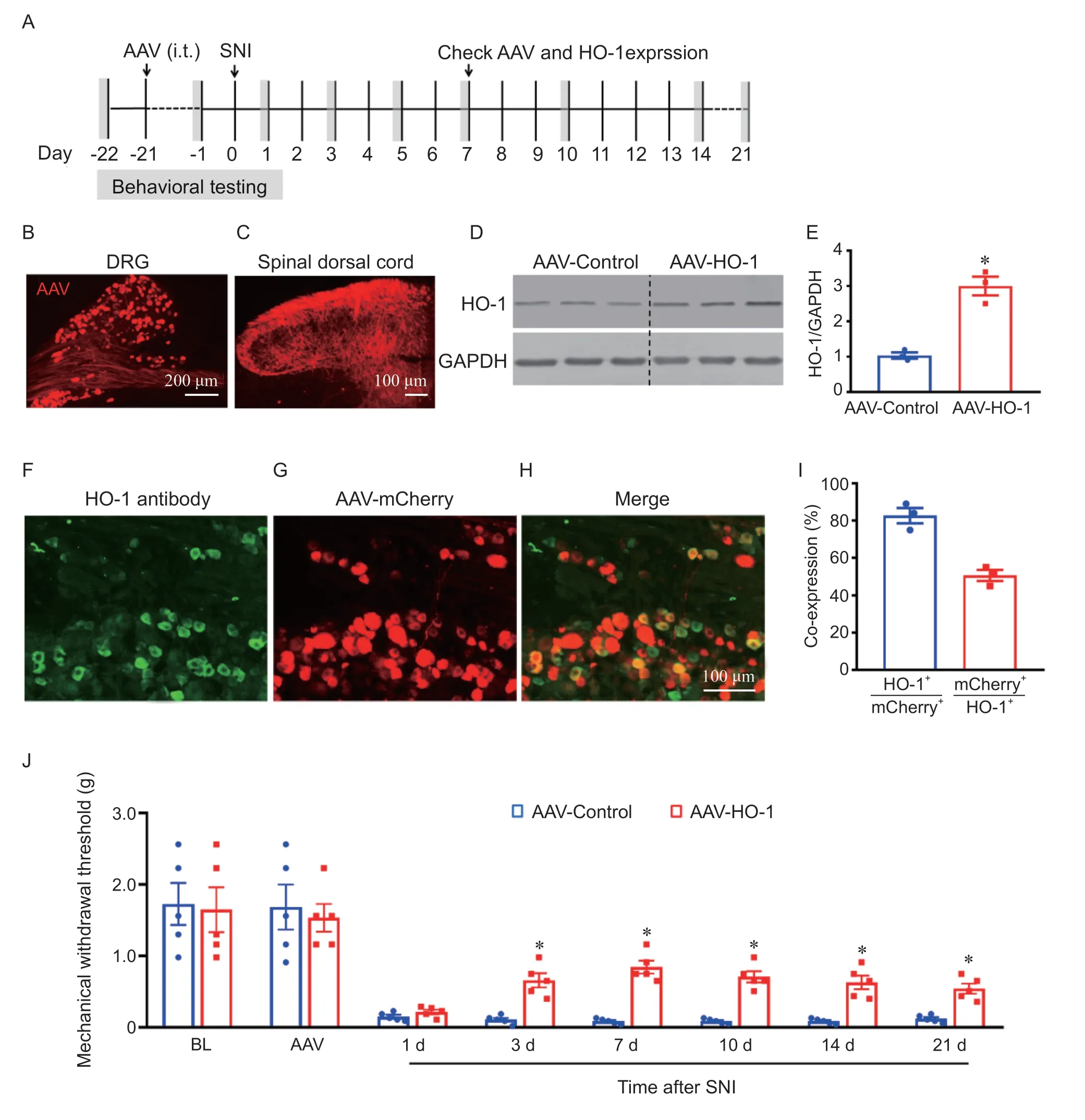
图4 鞘内注射过表达HO-1 病毒能长时程缓解SNI 诱导的机械性触诱发痛 (±SEM)(A)行为学检测和SNI 以及病毒给药的时间流程图;(B) 鞘内注射AAV 后mCherry 荧光蛋白表达在DRG 神经元,(C) mCherry 荧光蛋白标记神经纤维在脊髓中的分布;(D, E) Western blot 结果显示AAV-HO-1 鞘内注射后DRG 中HO-1 蛋白表达显著增加,*P < 0.05,与对照AAV 组相比 (n = 3);(F-I)免疫荧光结果显示HO-1 与对照AAV 病毒的mCherry 双标染色及统计结果 (n = 3);(J) AAV-HO-1 鞘内注射后能持续缓解SNI 诱导的机械性触诱发痛,能持续3 周以上,*P < 0.05,与相对应的对照AAV 组相比 (n = 5)Fig. 4 SNI-induced mechanical allodynia is persistently attenuated by the intrathecal injection of AAV-HO-1 (±SEM)(A) The timeline of behavioral test and SNI and intrathecal injection of AAV; (B) Representative fluorescence photomicrograph showing mCherry expression in DRG neurons; (C) The distribution of mCherry positive neuronal fibers in the spinal cord; (D, E) Western blot shows that HO-1 protein was significantly increased after intrathecal injection of AAV-HO-1. *P < 0.05, compared with the AAV-Control group (n = 3); (F-I) Immunostaining and statistical results show the double staining of HO-1 with mCherry (n = 3); (J) Intrathecal injection of AAV-HO-1 attenuated SNI-induced mechanical allodynia for more than 21 days. *P < 0.05, compared with the AAV-Control group (n = 5).
综上所述,HO-1 作为一种抗炎症分子,在神经损伤后DRG 部位减少。上调DRG 神经元中HO-1表达,可能具有减轻神经炎症作用,进而缓解了神经病理性疼痛。
