基于高通量测序重茬草莓土壤细菌和真菌多样性分析
2021-03-08肖蓉张春芬邓舒
肖蓉 张春芬 邓舒

摘 要:研究利用Illumina Miseq高通量测序技术,比较新茬草莓和连作3年草莓根际土壤细菌、真菌群落多样性,旨在了解其微生物群落生态特征,为防治连作障碍奠定基础。结果:重茬3年后土壤中细菌物种多样性及丰富度降低;新茬土壤中丰度最高的鞘氨醇单胞菌被节杆菌属取代,肠杆菌属丰度显著升高。对于真菌来讲,重茬3年后土壤中真菌物种多样性和丰富度增大;新茬土壤中含有植物病原菌链格孢菌和茎点霉菌,重茬3年后枝顶孢属、被孢霉属、镰刀菌属等病原菌大量积累。结论:重茬土壤中细菌多样性降低、真菌多样性增高,病原真菌积累是引起草莓连作障碍的主要原因。
关键词:重茬;高通量测序;多样性分析;草莓
文章编号:2096-8108(2021)01-0028-06 中图分类号:S668.4 文献标识码:A
Abstract:In order to understand the ecological characteristics of rhizosphere soil microbial communities for strawberrys continuous obstacle controlling, the diversity of bacteria and fungi communities of newly cropped strawberry and continuously cropped strawberry for 3 years by high-throughput sequencing were compared. The results showed that the diversity and richness of bacterial in the soil decreased after continuous cropping. Sphingomonas with the highest abundance in new soil was replaced by Arthrobacter, and Enterobacter abundance increased significantly. For fungi, the diversity and richness increased after continuous cropping. There were Alternaria and Phoma in the new soil. But after 3 years of continuous cropping, a large number of other phytopathogens were accumulated such as Acremonium, Mortierella and Fusarium. In conclusion, the decrease of bacterial diversity, the increase of fungal diversity and the accumulation of pathogenic fungi in the soil were the main causes of strawberry continuous cropping obstacles.
Keywords:continuous cropping;high-throughput sequencing;diversity analysis;strawberry
生产中大棚草莓种植每年都要换新苗,因此重茬在所难免。连作障害是制约草莓发展的最大因素,据调查,连作4年草莓能减产40%以上[1]。目前,大家公认的连作障害的形成机理主要包括连作土壤中病原微生物积累[2]、土壤营养元素失衡[3]、化感作用[4-6]3个方面。而土壤微生态失衡是研究者所公认的连作障害发生的根本。其中微生物因素在整个连作障碍发生发展过程中一直扮演着关键角色。
在土壤这个黑匣子中到底有多少微生物,以及他们之间的结构信息、群体相互作用、与植物重茬障碍之间的关系等等吸引着人们持续而深入的研究。由于目前土壤中可培养的微生物仅占土壤微生物总数的1%左右,因此依赖于平板培养技术来研究土壤微生物生态显然是不够的[7]。近些年来,随着现代生物技术和基因组学的蓬勃发展,以土壤中全部微生物基因組DNA序列为依据的微生物分子生态学研究方法正日益成为大家普遍接受的方法[8]。
本研究以同一个农业园区新茬草莓大棚和连作3年的重茬草莓大棚土壤为研究对象,直接提取草莓根际土壤总DNA,通过Illumina Miseq测序平台对新茬土壤及重茬土壤细菌和真菌结构及功能多样性进行比较分析,旨在找到重茬土壤中的优势细菌和真菌类群,从微生物生态学角度研究草莓重茬障害发作时的生物学病因,为草莓重茬障碍防治提供理论依据。
1 材料与方法
1.1 供试土样
土壤样品采自山西省太原市阳曲县同一个农业园区新茬草莓大棚和连作3年的重茬草莓大棚,于6月草莓刚收获结束后采样。每个大棚内按“S”形于大棚中间随机挑选草莓植株4株,整株挖出置于冰盒中用无菌袋带回实验室,抖掉根部多余的土后用无菌毛刷刷取根际土,4个土样混合成1个样置于无菌离心管中,新茬土壤样品命名为XJS1,重茬土壤样品命名为CJS1。各类型选取4座大棚为采样地,共获得XJS1和CJS1样本各4个,视为4次重复。
1.2 土壤微生物总DNA提取及测序
土壤微生物总DNA提取方法参考本课题组前期方法[9]。用0.8%琼脂糖凝胶电泳检测DNA的完整性后用Nanodrop 2000分光光度计测定其浓度,DNA合格样品送生工生物工程(上海)股份有限公司完成后续多样性测序工作。细菌多样性测序选取V3-V4区作为靶向扩增区域,真菌多样性测序选取ITS1-ITS2区作为靶向扩增区域。
3 结论与讨论
本研究结果表明,重茬3年后土壤中细菌数量减少、真菌数量上升,这与前人的研究结果相似。甄文超等研究指出,连续种植草莓的农田土壤微生态环境有利于真菌的增殖而不利于细菌和放线菌,草莓根际和根表微生物真菌种群数量上升、细菌和放线菌的增殖减少,最终导致连作障碍发生[10]。薛超指出重茬土壤微生物从细菌主导型向真菌主导型转化[11]。
本研究结果表明,重茬3年后,新茬土壤中丰度最高的鞘氨醇单胞菌被节杆菌属取代,肠杆菌属丰度显著升高。王志刚从植物根际获得一株鞘氨醇单胞菌,能高效解磷和分泌IAA,促进连作西瓜生长[12]。另外,很多文献都指出鞘氨醇单胞菌和节杆菌与多环芳烃、苯酚、菲等芳香族污染物的降解有关[13-15]。而肠杆菌具有缓解镉-砷富集对植物的胁迫[16]、降解植物的次生代谢产物缩合单宁(原花青素)[17]、降解除草剂阿特拉津的功能[18, 19]。因此,这可能暗示该园区土壤中有有机物污染。
本研究发现,重茬3年后的土壤真菌优势菌与新茬土壤大相径庭。原来在新茬土壤中占优势的真菌丰度值大幅下降,而新崛起的丰度值增高的真菌大多与植物病害发生相关。比如重茬土壤中占优势的丝核菌能引起多种植物(包括草莓)的黑根病、立枯病、叶腐病、茎腐等病害,是植物真菌病害防治的主要对象,也是草莓产区普遍发生的病害之一[20];轮枝菌属导致黄萎病[21];镰刀菌属可危害多种植物,破坏植物的维管束系统,引起植物萎蔫死亡和器官腐烂,是生产上防治最艰难的土传病害之一,在草莓上可引起枯萎病[22]。另一类占据优势地位的菌是营腐生生活的菌属,比如青霉菌和接合菌,这类菌常生长在腐烂的蔬菜、水果、肉类和各种潮湿的有机物上。由此可以推测:重茬3年的草莓地土壤中积累了相当数量的植物病原菌,残枝败叶的积累养育着一批腐生菌,土壤真菌环境不容乐观。另外,值得注意的是,该园区新茬土壤中检测到优势菌链格孢菌和茎点霉属细菌,链格孢菌能够引起植物黑斑病、腐烂病等,也能引起草莓采后黑腐病[23];茎点霉菌寄主广泛,能够引起多种植物叶斑病、茎枯病等,其中部分种是检疫性植物病原菌[24],提示该地块虽然是第1年栽种草莓,但前茬作物留下的病原菌也不容忽视。
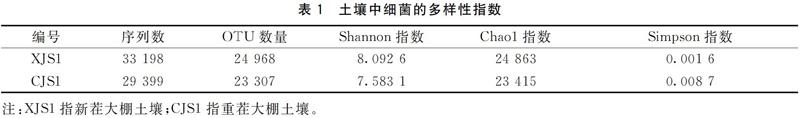
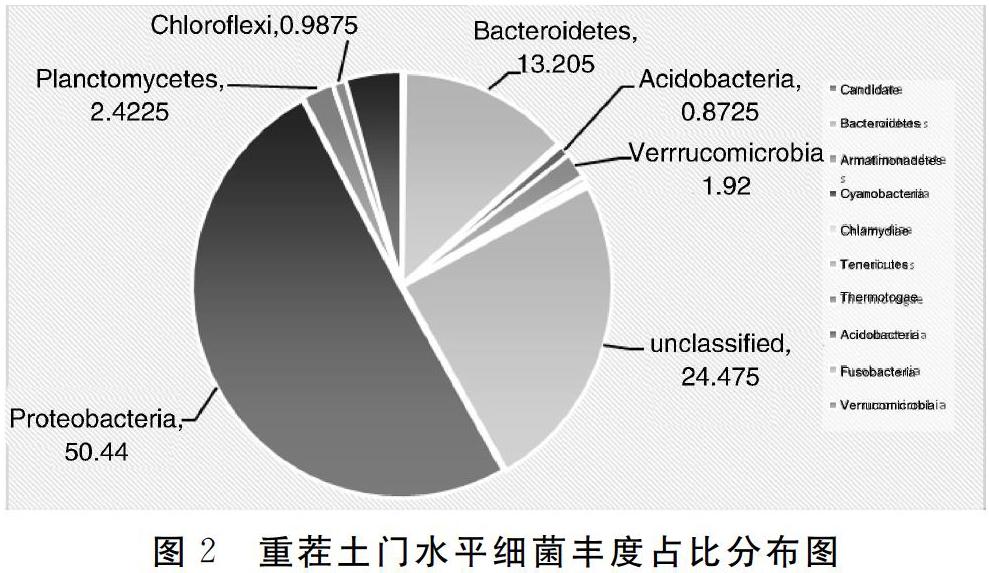
综上所述,对于细菌来讲,重茬3年后土壤中细菌物种多样性及丰富度降低;变形菌门和拟杆菌门是两种生境中的优势细菌;在属水平上,新茬土中,丰度最高的前3位是鞘氨醇单胞菌、根瘤菌和假单胞菌,而在重茬土中,丰度最高的前3位是节杆菌、Olivibacter和根瘤菌;与新茬土相比,重茬土中鞘氨醇单胞菌、地杆菌和Skermanella丰度显著降低,而节杆菌和肠杆菌丰度显著升高。对于真菌来讲,重茬3年后土壤中真菌物种多样性增大;在门水平上,子囊菌门为两种生境中的第一优势菌;接合菌门在新茬土壤中含量很低,但重茬3年后的土壤中该菌丰度快速增长;在属水平上,新茬土壤中含有植物病原菌链格孢菌和茎点霉菌,重茬3年后枝顶孢属、被孢霉属、镰刀菌属等病原菌大量积累。因此,重茬土壤中细菌多样性降低、真菌多样性增高,病原真菌积累是引起草莓连作障碍的主要原因。
参考文献
[1]王明喜,谷 军.草莓重茬减产原因及对策[J].新农业,1995(9):30-31.
[2]侯 慧,董 坤,杨智仙,等.连作障碍发生机理研究进展[J].土壤,2016,48(6):1068-1076.
[3]蔡祖聪.我国设施栽培养分管理中待解的科学和技术问题[J].土壤学报,2019,56(1):36-43.
[4]齊永志.根系化感物质与病原菌在草莓连作障碍中的协同作用研究[D].河北农业大学,2008.
[5]甄文超,王晓燕,孔俊英,等.草莓根系分泌物和腐解物中的酚酸类物质及其化感作用[J].河北农业大学学报,2004(4):74-78.
[6]李庆凯,郭 峰,唐朝辉,等.三种酚酸类物质在花生连作障碍中的生态效应分析[J].中国油料作物学报,2019,41(1):53-63.
[7]马万里,TIBBITS JOSQUIN,ADAMS MARK.土壤微生物多样性研究的新方法[J].土壤学报,2004(1):103-107.
[8]张 彤,方汉平.微生物分子生态技术:16S rRNA/DNA方法[J].微生物学通报,2003(2):97-101.
[9]肖 蓉,曹秋芬,聂园军,等.基于高通量测序患炭疽病草莓根际与健康草莓根际细菌群落的比较研究[J].中国农学通报,2017,33(11):14-20.
[10]甄文超,代 丽,胡同乐,等.连作草莓土壤微生物区系动态的研究[J].河北农业大学学报,2005(3):70-72.
[11]薛 超,黄启为,凌 宁,等.连作土壤微生物区系分析、调控及高通量研究方法[J].土壤学报,2011,48(3):612-618.
[12]王志刚,胡云龙,徐伟慧,等.鞘氨醇单胞菌菌株CL01的分离鉴定及其对连作西瓜的促生效应[J].农业生物技术学报,2015,23(10):1360-1367.
[13]纪婷婷,高 莉,侯 彬,等.降解多环芳烃的鞘氨醇单胞菌ahdA1c基因的生物信息学分析[J].科学技术与工程,2017,17(31):163-169.
[14]邓维琴,刘书亮,姚 开,等.3-苯氧基苯甲酸降解菌Sphingomonassp.SC-1降解苯酚环境条件及其降解中间产物的研究[J].微生物学通报,2015,42(3):497-503.
[15]任 磊.芳香族污染物降解菌的分离及降解机理研究[D].中国农业科学院,2017.
[16]李 艺,王炳森,黄媛媛,等.肠杆菌对蓼科植物镉砷污染土壤修复机理研究[J].农业环境科学学报,2020,39(2):304-312.
[17]陈度宇,王 森,张 宇,等.一株缩合单宁降解菌的筛选、鉴定及降解效果分析[J].生物技术进展,2018,8(4):345-350.
[18]李阳阳.阿特拉津降解菌LY-1和LY-2的降解特性及土壤修复能力的研究[D].东北农业大学,2018.
[19]刘丹丹,刘 畅,王 琳,等.Enterobacter sp.对土壤莠去津污染修复及代谢途径分析[J].农药,2017,56(12):887-889.
[20]尹沙亮,钟 珊,刘奇志,等.草莓丝核菌根腐病病原菌鉴定及7种杀菌剂的抑菌作用测定[J].植物保护,2019,45(4):132-136.
[21]李欣欣,王秀红,史向远,等.堆肥提取液诱导草莓对黄萎病抗性及抑菌机理研究[J].中国生物防治学报,2018,34(2):294-302.
[22]雷恒树,华战迎,范灵姣,等.北京地区草莓枯萎病病原的鉴定与防治[J].中国农业大学学报,2019,24(6):66-72.
[23]ZHANG X Y,SUN Y,YANG Q,et al.Control of postharvest black rot caused by Alternaria alternata in strawberries by the combination of Cryptococcus laurentii and Benzo-(1,2,3)-thiadiazole-7-carbothioic acid S-methyl ester[J].Biological Control,2015,90:96-101.
[24]杨玲玉,王 颖,程颖慧,等.茎点霉生物学特性研究[J].山东农业大学学报(自然科学版),2016,47(4):501-505.
