设计综合性实验强化物理化学理论课教学探索
——以原电池设计为例
2021-03-08司玉军刘新露张瀚丹刘珊珊刘旖歆
司玉军,刘新露,张瀚丹,刘珊珊,刘旖歆
四川轻化工大学化学与环境工程学院,四川 自贡 643000
物质化学反应过程中常伴随有热、电、光、声、磁等物理现象。物理化学就是从化学现象和物理现象之间的联系来探求化学变化基本规律的一门学科。物理化学采纳物理学的理论成就与实验技术,借助数学方法探索、归纳和研究化学的基本规律和理论,构成化学科学的理论基础。物理化学的水平在相当大程度上反映了化学发展的深度。课程的教学目标是使学生了解和掌握物理化学的基本内容,逐步培养学生独立思考以及解决实际问题的能力[1]。
初学者往往感到物理化学的概念、理论太抽象,学习难度大。实际上物理化学作为理论与实验并重的学科,课程的每个知识板块都有特定教学实验与之对应。但是常规教学实验项目重实验操作、轻实验设计。教师若能同步将学生吸引到实验室,鼓励学生将知识、能力、思考融于一体,把在课堂内学习的理论知识,设计成对应的综合性实验,无疑将会加深学生对理论知识的理解,锻炼手脑并用,提高学生对物理化学的学习兴趣,提升学生的科研与创新能力。
电化学是物理化学课程中理论与应用紧密结合的核心板块之一。电化学研究电能和化学能之间相互转化及转化过程中的有关规律,其中电能转变为化学能的应用为电解,化学能转变为电能的应用为原电池(简称电池)。原电池设计和应用是解决当今社会能源问题的途径之一,与人类生产生活密切相关。本工作以物理化学电化学章节中原电池设计与实现为例,将部分本科生吸引至实验室开展相关实验研究,让学生真实领会理论学习与研究实践之间的紧密关联,体会到学以致用的乐趣。
1 原电池设计基本理论
由吉布斯函数的物理意义可知,在等温等压、可逆条件下进行的自发反应,对环境所做的最大非体积功等于该反应的吉布斯函数变。若设计合适的原电池使化学反应在电池内进行,且当非体积功只有电功时,该电池的电动势与化学反应吉布斯函数变之间的关系可由式(1)表示[2]:

式中,ΔrGm为电池反应的摩尔吉布斯函数变,z为反应进度ζ= 1 mol时的电子转移数,F为法拉第常数,E为可逆电池的电动势。
在电化学中,将一个自发反应设计为电池的基本思路为:
(1) 对于氧化还原反应,根据某元素在反应前后化合价的变化,确定氧化还原电对,写出得电子的正极反应和失电子的负极反应方程式,从而确定电池的正极、负极和电解质溶液体系。
(2) 对于非氧化还原反应,需在反应方程式两边加上同一物质,且该物质中某元素与原反应中的相同元素具有不同化合价,从而与原有物质构成氧化还原电对,据此写出电池的正、负极电极反应方程式,确定电池的正极、负极和电解质溶液体系。
(3) 设计可逆电池,写出电池简式,考虑电极材料、溶液浓度、相界面(如双液电池必须加盐桥)等影响电池电动势的因素。
(4) 检查所设计电池反应是否与原反应相吻合,判断电池设计的正确性。
2 酸碱中和反应原电池的理论设计
酸碱中和反应为典型的自发反应,其反应方程式如式(2)所示:

式中a+和a−是氢离子和氢氧根离子的活度。已知298.15 K下,氢离子、氢氧根离子、液态水的标准摩尔生成吉布斯函数分别为0、−157.244、−237.129 kJ·mol−1,由此可计算出反应式(2)的标准摩尔吉布斯函数变由此表明,在标准状态下该反应能自发进行;在近标准态下,吉布斯函数变没有显著变化,该反应也能自发进行,因此可以将酸碱中和反应设计为原电池。
学生学习电化学理论知识的时候,对于将非氧化还原反应的酸碱中和反应设计为原电池比较难于理解。因为这个反应中元素的化合价没有变化,表观上没有涉及到电子的转移,不能直接判断出电池的正负极反应。为了将该反应设计成原电池,在反应方程式两边分别加入氧气或者氢气,就可以“造出”氧或氢元素的氧化还原电对,从而得到电池的正极和负极[2]。基于实际操作的便利性,氧气可以来源于空气、易于控制,因此,本工作采用添加氧气的方式来设计原电池,其总反应方程式如式(3)所示:
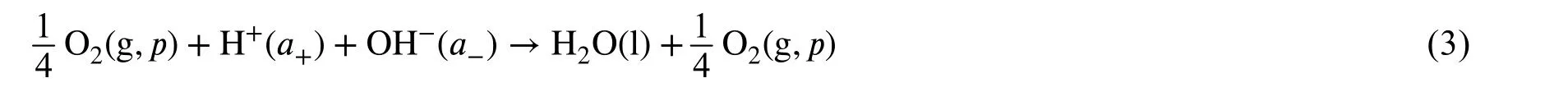
阳极(负极,失去电子)反应为氧气析出反应,如式(4)所示:

综上所述,经过设计后,非氧化还原反应的酸碱中和反应可以由两个涉及电子转移的电极半反应实现,从而具备将其设计为原电池的基础。
3 酸碱中和反应原电池的实现
由于式(4)、式(5)所述的电极反应涉及到酸、碱两种不同性质的溶液,因此,酸碱中和反应原电池应为双液电池。可将一定浓度的酸溶液和碱溶液盛装于不同容器中,通过盐桥将两种溶液连接起来。本工作所用电解液分别为0.5 mol·L−1H2SO4(正极,加1滴甲基橙指示剂,显红色)和1.0 mol·L−1KOH溶液(负极,加1滴甲基橙指示剂,显黄色)。
该电池的电动势由能斯特方程计算,如式(6)所示:
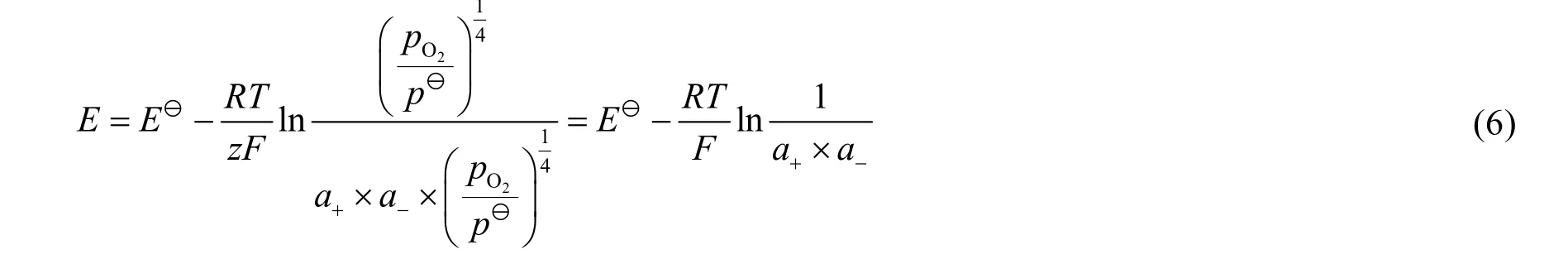
可以看出,欲计算电池电动势,需要知道0.5 mol·L−1H2SO4溶液中氢离子和1.0 mol·L−1KOH溶液中氢氧根离子的活度a+、a−。若知道离子的质量摩尔浓度b和活度因子γ,则离子活度可由式(7)计算:

强电解质溶液中,单个离子的活度因子无法测定,可近似认为离子的活度因子等于电解质溶液的平均活度因子,即γ+≈ γ−≈ γ±[2]。对于 0.5 mol·L−1H2SO4溶液,298.15 K 时密度约为 1.03 g·cm−3,溶液、氢离子的质量摩尔浓度分别为0.53、1.06 mol·kg−1;对于1.0 mol·L−1KOH溶液,298.15 K时密度约为 1.06 g·cm−3,溶液、氢氧根离子质量摩尔浓度均为 1.06 mol·kg−1。查文献[2]得 0.5 mol·kg−1H2SO4溶液的γ±=0.154,则氢离子活度a+= 0.163;查文献[3]得 1.0 mol·kg−1KOH 溶液的γ±=0.679,则氢氧根离子活度a−= 0.720。将a+、a−的数值代入式(6),从理论上计算出本工作设计电池的电动势E= 0.743 V,即氢离子和氢氧根离子对标准态的偏离使电池电动势下降0.055 V。
酸碱中和反应原电池的实现需要克服的一个阻碍是催化剂,这涉及到物理化学中热力学和动力学之间联系的问题:即热力学主要研究过程的方向和限度,动力学主要研究反应速率和机理;在热力学上可行的反应,在实际条件下往往需要催化剂促进才能有效进行。针对这样的问题提示,学生查阅了有关氧还原、氧析出反应催化剂的文献,有效地开阔了视野、丰富了知识结构,为后续毕业论文等教学环节的学习打下基础。
基于以上分析,项目组学生将0.5 mol·L−1H2SO4和1.0 mol·L−1KOH溶液装入不同的玻璃槽,通过盐桥将二者连接起来,并用泡沫镍作为电极集流体,电池装置如图 1(a)所示。图 1(b)为以空白泡沫镍为正、负极集流体兼催化剂所得的电池;图 1(c)为以空白泡沫镍为负极集流体兼催化剂、以自制氮掺杂炭黑为正极氧还原反应催化剂的电池[4]。为确保负极析出的氧气能够及时排出,正极反应需要的氧气能够从空气中及时供给,在组装电池时,让两个泡沫镍集流体电极都处于电解液表面。

图1 (a) 酸碱中和反应电池;(b) 空白泡沫镍为正极反应催化剂;(c) 氮掺杂炭黑为正极反应催化剂
酸碱中和反应原电池的性能通过测试电池开路电压初步表征,测试在 CHI760E(上海辰华)电化学工作站上进行。对于负极氧析出反应,IrO2和RuO2是较好的催化剂[5],而对于正极氧还原反应,Pt基催化剂表现出良好的性能[6]。显然这两类催化剂都是贵金属物质,储量有限、成本较高,开发其替代催化剂是科学研究中需要解决的问题。本工作中,学生在以泡沫镍为集流体的同时,也直接将其作为氧析出、氧还原反应催化剂,测量电池的开路电势,结果如图 2(a)曲线所示。可以看出,该电池的开路电压约为 0.092 V。这一数值为正值说明,将酸碱中和反应设计为原电池是可以实现的,但是测量值与理论值0.743 V差异较大。原因之一是电池电动势理论值的计算是建立在可逆、平衡的基础之上,但是在实际测量时氧电极反应难于达到真正的平衡,从而降低原电池的电压输出;不同催化剂性能的差异也会引起不同程度的电化学极化,而使原电池的实际输出电压低于理论值。针对催化剂性能差异的影响,项目组学生将自制的氮掺杂炭黑氧还原反应催化剂涂敷在正极泡沫镍上,以促进氧还原反应的有效进行。由此所得原电池的开路电压测试如图2(b)所示,可以看出,在催化剂的促进之下,原电池开路电压大幅度提升至0.55 V以上,在测试时间范围内还出现上升的趋势,项目组学生在对实验效果表示惊奇的同时,也对催化剂的作用有了直观的认识。

图2 酸碱中和反应原电池开路电压测试曲线
以上结果初步表明,将一个自发反应设计为原电池是可以实现的。但是,原电池要具有一定的实用价值还需要考虑很多因素,如反应体系选择、催化剂性能、电池结构设计、电池寿命、实际放电特性等多方面的影响都需要进行综合考虑。解决这些问题需要学生具有全面而扎实的理论知识,阅读大量的文献,并通过团队的协同努力才有可能实现,这为促进学生建立正确学习观起到了良好的推动作用。
4 结语
本工作将本科生吸引至实验室,以物理化学电化学理论为基础,将酸碱中和反应设计为原电池,并予以实现。在综合实验开展中,学生遇到了在常规教学实验中难以遇到的各种问题,这促使学生发挥主观能动性,通过查文献、问老师、做实验等不同的途径予以解决。通过实验项目的实施,使学生认识到自身知识的局限性,强化了其在今后学习中需要更加努力提高自觉性,有效激发了学生对科学研究的兴趣,为大学后续阶段的学习指出方向。
