稳定同位素技术在肉羊产地溯源中的应用
2021-03-08王倩李政赵姗姗郄梦洁张九凯王明林郭军赵燕
王倩,李政,赵姗姗,郄梦洁,张九凯,王明林,郭军,赵燕
稳定同位素技术在肉羊产地溯源中的应用
王倩1,2,李政1,3,赵姗姗1,郄梦洁1,张九凯4,王明林3,郭军2,赵燕1*
1中国农业科学院农业质量标准与检测技术研究所/农业农村部农产品质量安全重点实验室,北京 100081;2内蒙古农业大学食品科学与工程学院,呼和浩特 010018;3山东农业大学食品科学与工程学院,山东泰安 271018;4中国检验检疫科学研究院,农产品安全研究中心,北京 100176
【】通过比较不同部位羊肉中碳氮稳定同位素差异,以及对羊肉、全骨粉、脱脂骨粉与骨胶原的稳定同位素分析,为肉羊产地溯源鉴别提供技术支持。利用同位素比率质谱仪(IRMS)测定不同部位脱脂羊肉中δ13C和δ15N值,进而比较不同产地来源(新西兰和中国宁夏、甘肃、安徽)的羊肉、全骨粉、脱脂骨粉与骨胶原中δ13C和δ15N值,并对结果进行方差分析、线性判别分析与相关性分析,确定碳氮稳定同位素对肉羊产地的溯源能力。后腿、排骨与胸叉、腹腩、脖子中δ13C值具有显著性差异(<0.05),δ15N值在后腿、胸叉、排骨、腹腩和脖子5个部位间无显著差异(>0.05)。不同产地(宁夏、甘肃、安徽和新西兰)的脱脂羊肉、全骨粉、脱脂骨粉与骨胶原中δ13C和δ15N值差异显著(<0.05),其中脱脂羊肉对产地溯源判别效果最佳,原始判别正确率为84.9%,交叉验证判别正确率为82.4%。全骨粉与骨胶原对产地判别正确率达65%以上。相关性分析结果表明脱脂羊肉、全骨粉、脱脂骨粉与骨胶原中δ13C、δ15N具有极显著相关性(<0.01),骨胶原与脱脂骨粉、全骨粉中碳同位素相关性最高,相关系数分别为0.903和0.866。稳定同位素可有效鉴别不同产地来源的肉羊样品,羊肉、全骨粉、脱脂骨粉及骨胶原中稳定同位素组成变化趋势基本一致,因此,利用稳定同位素技术对肉羊进行产地溯源是可行的。
稳定同位素;羊肉;羊骨;产地溯源
0 引言
【研究意义】随着人们生活水平的提升,消费者越来越关注食品的来源信息,食品的可追溯性已成为食品科学中的重要课题[1]。食品可追溯性是食品安全管理的一种有效工具,因此,使用食品溯源技术来证明其来源及食品质量,是提高食品供应链质量和透明度的关键措施[2]。【前人研究进展】目前,较多的溯源技术被应用于食品追溯中,其中稳定同位素溯源技术是追溯不同来源食品的一项有效技术[3-4],生物中稳定同位素组成与其生长环境密切相关,作为食品的自然指纹,不易改变,能为食品溯源提供可靠的地理信息[5]。近年来,稳定同位素技术被广泛应用于肉类产地溯源与真实性判别中[6-9],在国外稳定同位素技术已经被有效应用于羊肉产地溯源与生产方式的鉴别中[10-11]。ERASMUS等[12]测定了不同地区南非羔羊的腰长肌匀浆肉和脱脂肉碳氮同位素比值,产地判别的准确率达90%,由此说明,稳定同位素对不同来源的羔羊肉具有足够的鉴别能力。PIASENTIER等[13]对欧洲6个国家3种饲养方式羔羊肉进行了分析,结果表明在相同饲养方式下,δ15N值在不同国家有显著性差异;采用典型判别分析方法对饲养方式进行了分析,结果表明91.7%的肉样被正确分配,说明稳定同位素可用于羊肉的判别分析。我国是羊肉生产与消费大国,羊肉的来源对羊肉价格和品质具有一定影响,因此,对羊肉进行溯源有利于保证羊肉的品质及减少食品安全问题[14-15]。羊肉品质不仅受到产地及生产方式的影响[16-17],部位也是重要影响因素之一[18],因此有必要对不同部位的羊肉进行鉴别及产地溯源研究。肉羊屠宰后产生大量副产物羊骨,其富含必需氨基酸、胶原蛋白和矿物质,营养价值极高[19]。目前羊骨主要被加工成骨粉作为动物蛋白饲料,但是用患病的牛、羊等动物的骨头制成的骨粉喂养动物会导致牛海绵状脑病或口蹄疫的传播[20],对食品安全造成了威胁。【本研究切入点】目前,我国尚未建立羊肉及羊骨粉追溯体系,进行羊肉及羊骨溯源对食品安全具有重要作用。【拟解决的关键问题】本研究测定不同部位羊肉与不同产地脱脂羊肉、全骨粉、脱脂骨粉和骨胶原中δ13C、δ15N值,进行差异显著性分析,并比较不同来源样品的判别结果,探讨稳定同位素对羊肉及羊骨溯源的潜力,为羊肉和羊骨稳定性同位素溯源研究奠定基础,以保护广大消费者的利益,确保食品安全及消费者的健康。
1 材料与方法
试验于2018年12月至2019年4月在中国农业科学院农业质量标准与检测技术研究所进行。
1.1 样品采集
采集12只甘肃黑山羊的后腿、胸叉、排骨、脖子和腹腩5个不同部位的羊肉样品共计59份;新西兰和中国宁夏、甘肃、安徽4个产地的排骨部位羊肉共78份,同时选取其对应的羊骨并提取全骨粉、脱脂骨粉和骨胶原3种物质共计234份样品,样品置于-20℃冰箱中保藏。
1.2 羊骨中全骨粉、脱脂骨粉和骨胶原的提取及前处理
全骨粉:将羊骨表面的羊肉剔除并清洗干净,放入60℃烘箱中干燥至恒重,随后将干燥完全的骨样用破碎机研磨成粉末状,收集放入10 mL离心管中备用。
脱脂骨粉:称取磨好的粉末状羊骨粉0.6 g于10 mL离心管中,取氯仿﹕甲醇=2﹕1的溶液3 mL(固﹕液=1﹕5)进行离心脱脂,干燥后用破碎机研磨成粉末,收集放入10 mL离心管中备用。
骨胶原:将羊骨表面的羊肉剔除并清洗干净,放入60℃烘箱中干燥至恒重,取300—600 mg骨样置于玻璃烧杯中,加入2 mol∙L-1的HCl溶液至完全将骨样浸泡脱钙,直至骨样松软、无气泡冒出。取出松软漂浮的骨样,加去离子水洗至中性,继而加入0.125 mol∙L-1的NaOH溶液浸泡24 h以去除腐殖酸。将处理后的骨样移入离心管中加入去离子水进行离心处理直至骨样呈中性,加入0.001 mol∙L-1的HCl溶液,锡纸封口后放入90℃烘箱中进行明胶化,明胶化后将剩余液体过滤,取上清液于新的10 mL离心管中,冷冻干燥后制得骨胶原,将制得的骨胶原用研磨机磨粉备用。
1.3 羊肉样品前处理
称取样品5 g(瘦肉)放入培养皿中,-20℃条件下预冻12 h,在冷冻干燥机中冻干,将冻干后的样品放入离心管,在研磨机中粉碎,使用氯仿-甲醇提取法进行离心脱脂,样品处理后蒸发至干燥并粉末化。
1.4 测定方法
1.4.1 样品测定 碳氮同位素比率的测定:称取样品放入锡箔杯后用自动进样器送至元素分析仪(Flash 2000,Thermo Fisher,Germany),样品中碳和氮在960℃下燃烧被转化为CO2和NOx气体,然后NOx气体通过铜线被还原成N2,再经过Conflo IV稀释仪(Thermo Finnigan, Germany),最后进入Delta V Advantage质谱仪进行检测。具体测定参数为:元素分析仪:载气(He)流量为100 mL∙min-1,氧气流量为175 mL∙min-1,注入氧气时间为3 s,气相色谱柱温度为50℃。Conflo IV条件设定:氦稀释压力为0.6 bar,N2参考气压为1.0 bar,CO2参考气压为0.6 bar。按照国际标准物质B2151(高有机质沉积物)、USGS 40(L-谷氨酸)、USGS 43(Indian human hair powder)进行校准。碳氮稳定同位素比值分析精度均为0.15‰。
1.4.2 计算公式 碳氮稳定同位素比率分别用δ13C ‰、δ15N ‰表示,δ13C的相对标准为V-PDB,δ15N的相对标准为空气。计算公式为:δ‰=(R样品/R标准-1)×1000。
1.5 数据处理
用SPSS 20.0对数据进行方差分析及Duncan多重比较,分析不同来源样品中稳定同位素组成的差异,采用线性判别分析(LDA)评价稳定同位素值对不同来源样品的判别效果。用Excel软件进行相关性分析。
2 结果
2.1 碳、氮稳定同位素组成对同一品种羊肉不同部位的鉴别分析
甘肃黑山羊的后腿、胸叉、排骨、脖子和腹腩5个不同部位脱脂肌肉样品中稳定同位素比值见表1。胸叉中δ13C值最高,排骨中δ13C值最低,排骨、后腿与胸叉、腹腩和脖子的δ13C值存在显著性差异(<0.05);排骨、腹腩、胸叉、后腿和脖子5个部位中δ15N值无显著差异(>0.05)。总体来说,不同部位脱脂羊肉中δ13C值存在显著性差异,这说明不同部位中碳稳定同位素值分馏效应不同。因此在后续的肉羊产地溯源试验中,不同来源的肉羊样品确定统一的部位来进行试验,本研究选择羊排部位开展肉羊产地溯源。

表1 不同部位脱脂羊肉中δ13C和δ15N值
数值为平均值±标准差,Duncan多重比较,不同小写字母表示差异显著(<0.05)。下同
Values are means ± SD, Duncan multiple comparison, different lowercase letters show significant difference (<0.05). The same as below
2.2 不同地区羊肉及羊骨中碳、氮稳定同位素组成的差异分析
不同地区脱脂羊肉、全骨粉、脱脂骨粉及骨胶原中δ13C值见表2,不同样品在地域间显示出显著性差异。甘肃地区羊肉中的δ13C值最高,与其他3个地区样品存在显著性差异(<0.05),中国安徽地区羊肉中δ13C值最低;全骨粉中新西兰地区的样品中δ13C值最高,中国宁夏与甘肃地区全骨粉中δ13C值无显著差异;中国宁夏、甘肃与安徽地区的脱脂骨粉中的δ13C值差异性显著(<0.05);骨胶原样品中中国安徽与其他3个地区样品差异显著(<0.05)。整体来看,中国安徽地区样品中的δ13C值均显著低于其他3个地区的样品;中国宁夏与甘肃地区样品中δ13C值较为接近。
对不同地区脱脂羊肉、全骨粉、脱脂骨粉及骨胶原中δ15N值进行差异分析(表3),在脱脂羊肉样品中,中国安徽和新西兰脱脂羊肉中δ15N值与中国宁夏及甘肃地区有显著性差异(<0.05)。在全骨粉、脱脂骨粉与骨胶原中,中国甘肃地区样品中的δ15N值与其他3个地区的样品存在显著性差异(<0.05)。
2.3 不同地区羊肉及羊骨中碳氮同位素指标的判别分析
从表4可以看出,脱脂羊肉对产地判别效果最好,其原始整体判别正确率为84.9%,交叉验证整体判别正确率为82.4%。而全骨粉、骨胶原与脱脂骨粉中δ13C、δ15N值的产地判别结果相对较差,交叉验证整体判别正确率分别为66.8%、67.0%、63.5%。
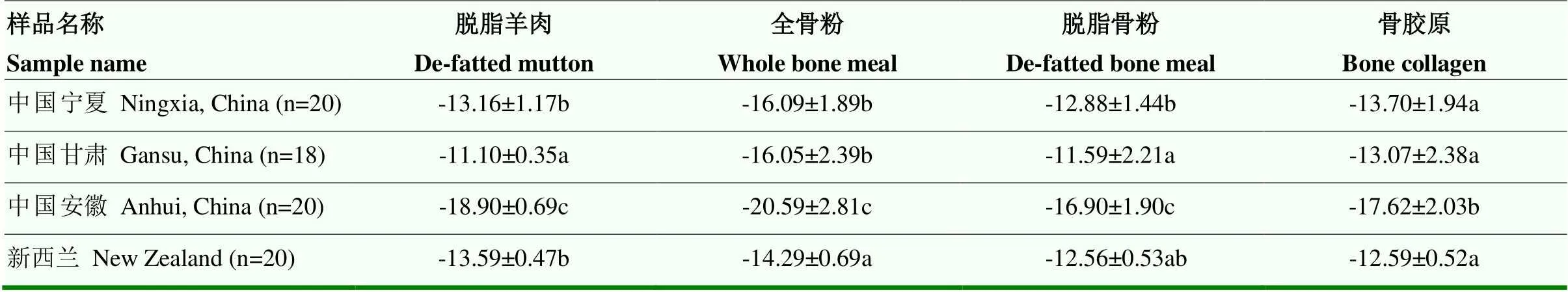
表2 不同地区样品中δ13C值

表3 不同地区样品中δ15N值

表4 不同样品中δ13C、δ15N值对产地的判别分析结果
2.4 羊肉与羊骨中同位素组成的相关性分析
相关性分析结果表明,脱脂羊肉、全骨粉、脱脂骨粉与骨胶原中δ13C、δ15N具有极显著相关性(图1,图2),其中碳同位素相关性整体高于氮同位素之间的相关性。骨胶原与脱脂骨粉、全骨粉中碳同位素相关系数分别为0.903和0.866(<0.01);脱脂骨粉与脱脂羊肉、全骨粉中碳同位素相关系数分别为0.855和0.850(<0.01)。相比之下,脱脂羊肉与骨胶原、全骨粉中碳同位素相关系数为0.772和0.706(<0.01);骨胶原与脱脂骨粉、全骨粉和脱脂羊肉中氮同位素具有较高相关性,分别为0.692、0.659和0.505(<0.01)。这表明碳氮同位素值在脱脂羊肉、全骨粉、脱脂骨粉与骨胶原中的积累模式相同,在产地来源判别中结果基本一致。
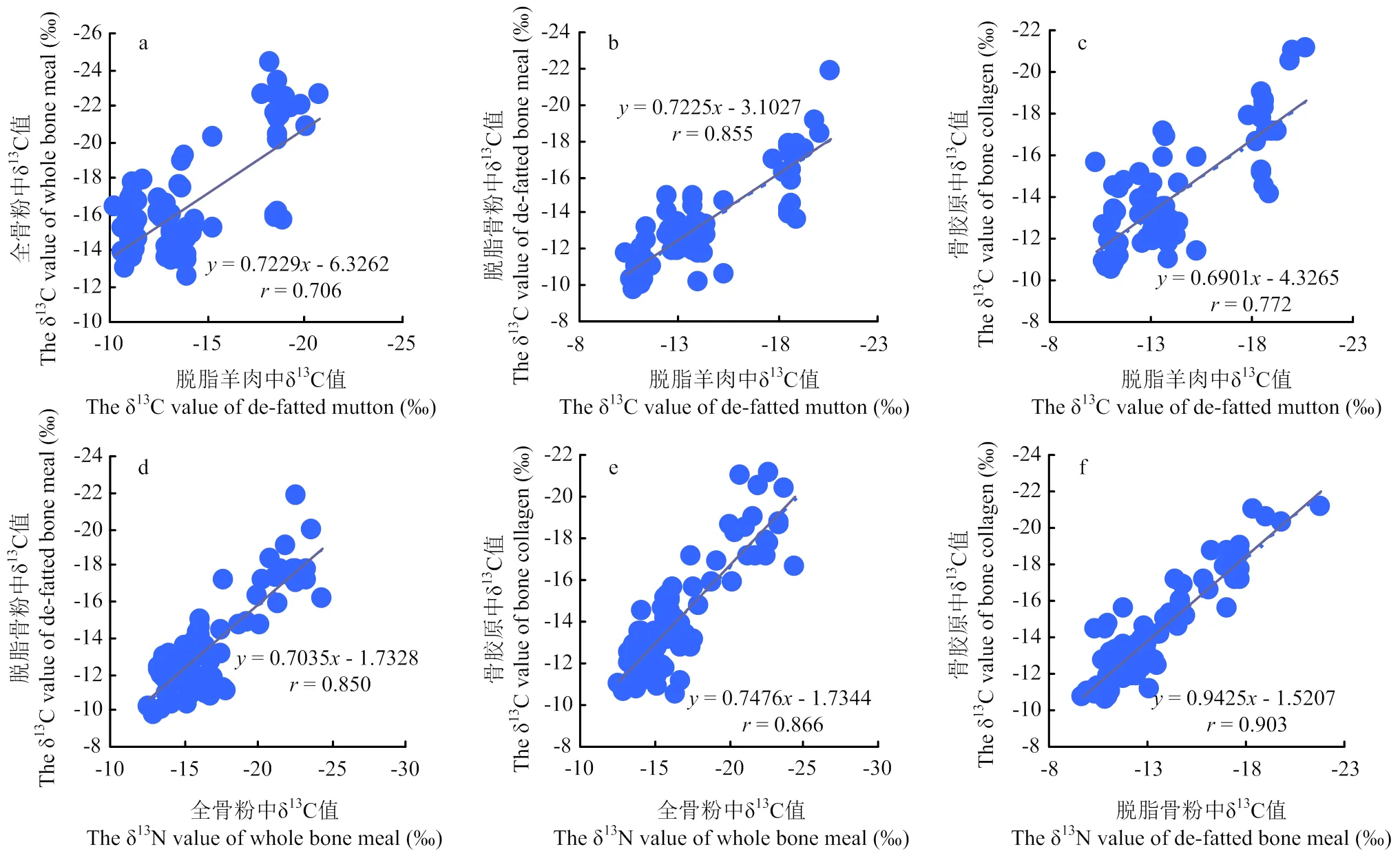
图1 脱脂羊肉、全骨粉、脱脂骨粉与骨胶原中δ13C值的相关性分析
3 讨论
3.1 稳定同位素组成与不同部位的关系
中国甘肃黑山羊的羊肉样品的后腿、排骨与胸叉、腹腩、脖子中碳同位素比值存在显著性差异,说明取样部位对样品中稳定同位素值产生影响,不同部位羊肉中碳同位素分馏效应不一致。HARRISON等[21]对不同部位肌肉中碳同位素的差异进行了分析,结果显示不同部位间存在差异。本研究结果中后腿、胸叉、排骨、腹腩和脖子5个部位间δ15N值无显著性差异,郭莉等[22]对内蒙古141只羊的4个肌肉部位中碳氮同位素组成进行了研究,结果不同部位脱脂肌肉中δ15N值没有显著性差异,与本试验结果相同。试验表明不同部位中稳定同位素存在一定差异,后续应增加测定样品中氢、氧等同位素,继续深入研究羊肉不同部位中稳定同位素组成及其分馏效应。
3.2 脱脂羊肉与羊骨中碳、氮同位素在产地中的鉴别
进一步选取排骨部位的样品对肉羊进行产地溯源研究,方差分析结果表明脱脂羊肉及羊骨样品中的碳、氮同位素可对产地进行溯源。研究表明,δ13C值主要反映饲料的组成[23],C4植物组织中δ13C值高于C3植物,动物进食C3和C4植物对碳同位素比率的影响进而反映在肉中[24]。宁夏和甘肃位于中国西北地区,玉米是主要农作物之一,肉羊主要饲喂C4植物,安徽位于中国华东地区,羊的饲料中含有C3和C4植物。新西兰地区与宁夏和甘肃的样品中δ13C值接近,说明新西兰羊的饲料中C3、C4饲料配比与这两个地区相近,中国安徽地区的羊肉、全骨粉、脱脂骨粉及骨胶原中δ13C值显著低于其他3个地区的样品,DE SMET等[25]的研究说明动物各组织中δ13C值可预测C4植物在饲料中所占的比例。动物中δ15N值主要受土壤状况、气候及农业施肥等因素的影响[26]。研究表明,施用有机肥可提高土壤和植物中氮含量,而施用化肥则降低土壤与植物中氮含量[27]。中国甘肃地区的羊肉、全骨粉、脱脂骨粉及骨胶原中δ15N值显著低于其他3个地区样品中δ15N值,引起这一现象的原因可能与当地施肥情况有关;其次,饲喂豆科植物也会导致动物中δ15N值降低[28-29]。全骨粉与脱脂骨粉中δ13C值低于羊肉与骨胶原中δ13C值,而δ15N值高于羊肉与骨胶原中δ15N值,可见骨样与肉样中碳、氮同位素组成不同,但整体分馏趋势一致。全骨粉中δ13C值低于脱脂骨粉中δ13C值,这是由于粗脂肪在合成过程中对δ13C值有贫化作用[3]。
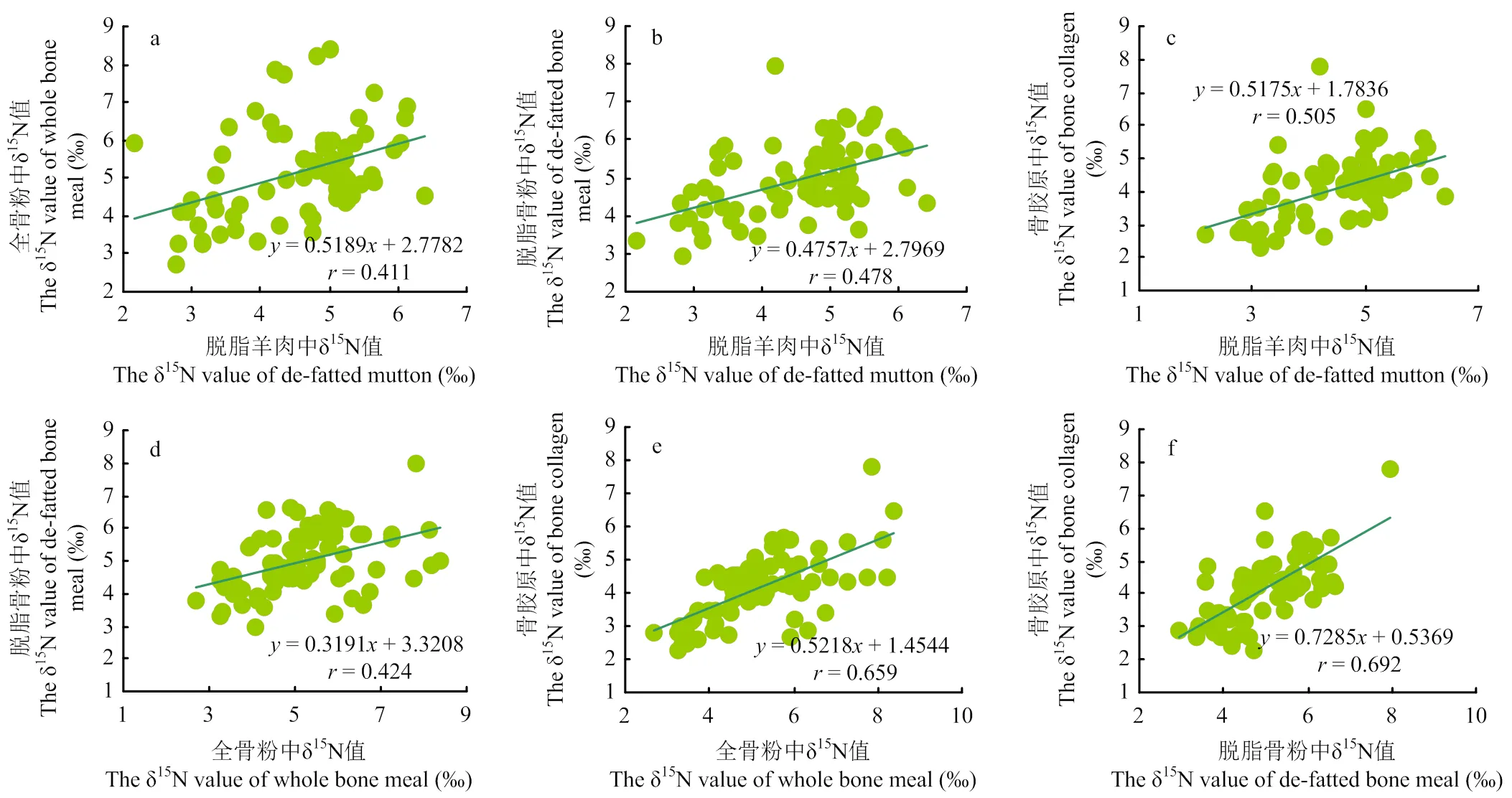
图2 脱脂羊肉、全骨粉、脱脂骨粉与骨胶原中δ15N值的相关性分析
3.3 脱脂羊肉与羊骨中碳、氮同位素的判别分析与相关性分析
相关性分析与判别分析结果都表明可利用碳、氮同位素对脱脂羊肉、全骨粉、脱脂骨粉与骨胶原进行产地判别。其中对脱脂羊肉样品的产地判别有较好的效果,因此碳氮稳定同位素可有效用于肉羊产地追溯中。此外,各个样品在产地判别中对新西兰样品有较高的判别率,其中脱脂羊肉对新西兰样品的整体判别率达95%。骨胶原与其他3个样品高度相关,总体变化趋势一致,全骨粉、脱脂骨粉及骨胶原中碳、氮同位素也可有效用于产地溯源中。CARRIJO等[30]对饲喂牛肉和骨粉的鸡肉进行了溯源研究,结果显示不同样品中碳、氮同位素有显著差异,表明碳、氮同位素可对样品进行溯源。研究表明,各组织中同位素的分馏在合成代谢过程中存在生理和时间差异[31],骨生长相对缓慢,其同位素组成可能主要反映身体同位素值的长期平均值[32],但羊肉与羊骨的相关性受环境因素影响的变化机理尚不明确[33],需在今后进一步进行探讨,后续试验应考虑增加氢氧同位素指标的测定,以达到更好的鉴别效果。
4 结论
羊肉不同部位肌肉中碳稳定同位素值存在一定差异,而氮同位素无显著差异,今后应结合其他指标对不同部位羊肉进行鉴别研究;脱脂羊肉、全骨粉、脱脂骨粉及骨胶原中δ13C值可提供其产地来源信息,并且脱脂羊肉、全骨粉、脱脂骨粉及骨胶原中碳氮同位素之间呈极显著相关性,利用羊肉及羊骨中碳氮同位素对肉羊进行产地溯源是可行的,同时也表明稳定同位素也可以对骨粉产品进行来源指示。
[1] MAI Z H, LAI B, SUN M W, SHAO J L, GUO L X. Food adulteration and traceability tests using stable carbon isotope technologies. Tropical Journal of Pharmaceutical Research, 2019, 18(8): 1771-1784.
[2] VIOLINO S, ANTONUCCI F, PALLOTTINO F, CECCHINI C, FIGORILLI S, COSTA C. Food traceability: A term map analysis basic review. European Food Research and Technology, 2019, 245(10): 2089-2099.
[3] BONER M, FORSTEL H. Stable isotope variation as a tool to trace the authenticity of beef. Analytical and Bioanalytical Chemistry, 2004, 378(2): 301-310.
[4] FRANKE B M, KOSLITZ S, MICAUX F, PIANTINI U, MAURY V, PFAMMATTER E, WUNDERLI S, GREMAUD G, BOSSET J, HADORN R, KREUZER M. Tracing the geographic origin of poultry meat and dried beef with oxygen and strontium isotope ratios. European Food Research and Technology, 2008, 226(4): 761-769.
[5] FOERSTEL H. The natural fingerprint of stable isotopes-use of IRMS to test food authenticity. Analytical and Bioanalytical Chemistry, 2007, 388(3): 541-544.
[6] LV J, ZHAO Y. Combined stable isotopes and multi-element analysis to research the difference between organic and conventional chicken. Food Analytical Methods, 2017, 10(2): 347-353.
[7] ZHAO Y, ZHANG B, CHEN G, CHEN A L, YANG S M, YE Z H. Tracing the geographic origin of beef in china on the basis of the combination of stable isotopes and multielement analysis. Journal of Agricultural and Food Chemistry, 2013, 61(29): 7055-7060.
[8] 郭波莉, 魏益民, 魏帅, 孙倩倩, 张磊, 师振强. 牦牛肉中稳定同位素指纹特征及影响因素. 中国农业科学, 2018, 51(12): 2391-2397.
GUO B L, WEI Y M, WEI S, SUN Q Q, ZHANG L, SHI Z Q. The characters and influence factors of stable isotope fingerprints in yak muscle. Scientia Agricultura Sinica, 2018, 51(12): 2391-2397. (in Chinese)
[9] MONAHAN F J, SCHMIDT O, MOLONEY A P. Meat provenance: Authentication of geographical origin and dietary background of meat. Meat Science, 2018, 144: 2-14.
[10] BIONDI L, D'URSO M G, VASTA V, LUCIANO G, SCERRA M, PRIOLO A, ZILLER L, BONTEMPO L, CAPARRA P, CAMIN F. Stable isotope ratios of blood components and muscle to trace dietary changes in lambs. Animal, 2013, 7(9): 1559-1566.
[11] BONTEMPO L, CAMIN F, ZILLER L, BIONDI L, D'URSO M G, VASTA V, LUCIANO G. Variations in stable isotope ratios in lamb blood fractions following dietary changes: A preliminary study. Rapid Communications in Mass Spectrometry, 2016, 30(1): 170-174.
[12] ERASMUS S W, MULLER M, BUTLER M, HOFFMAN L C. The truth is in the isotopes: Authenticating regionally unique South African lamb. Food Chemistry, 2018, 239: 926-934.
[13] PIASENTIER E, VALUSSO R, CAMIN F, VERSINI G. Stable isotope ratio analysis for authentication of lamb meat. Meat Science, 2003, 64(3): 239-247.
[14] VINCI G, PRETI R, TIERI A, VIERI S. Authenticity and quality of animal origin food investigated by stable-isotope ratio analysis. Journal of the Science of Food and Agriculture, 2013, 93(3): 439-448.
[15] SUN S M, GUO B L, WEI Y M. Origin assignment by multi-element stable isotopes of lamb tissues. Food Chemistry, 2016, 213: 675-681.
[16] GARBOWSKA B, RADZYMINSKA M, JAKUBOWSKA D. Influence of the origin on selected determinants of the quality of pork meat products. Czech Journal of Food Sciences, 2013, 31(6): 547-552.
[17] SAEED O A, SAZILI A Q, AKIT H, EBRAHIMI M, ALIMON A R, SAMSUDIN A A. Effects of corn supplementation on meat quality and fatty acid composition of Dorper lambs fed PKC-Urea treated rice straw. BMC Veterinary Research, 2019, 15: 233.
[18] 刘畅, 罗玉龙, 张亚琨, 李文博, 赵丽华, 苏琳, 靳烨. 苏尼特羊不同部位肌肉抗氧化系统的差异. 中国食品学报, 2020, 20(3): 291-297.
LIU C, LUO Y L, ZHANG Y K, LI W B, ZHAO L H, SU L, JIN Y. Differences of muscle antioxidant system in different positions of sunit sheep. Journal of Chinese Institute of Food Science and Technology, 2020, 20(3): 291-297. (in Chinese)
[19] 韩克光, 甄守艳, 高文伟, 霍乃蕊. 单酶水解羊骨粉效果比较及水解指标相关性分析. 食品科技, 2016, 41(1): 110-114.
HAN K G, ZHEN S Y, GAO W W, HUO N R. Comparison of hydrolyzing effect of sheep bone powder by different proteases and correlation analysis for hydrolysis indicators. Food Science and Technology, 2016, 41(1): 110-114. (in Chinese)
[20] JIANG D, DU L, GUO Y C, MA J F, LI X Y, HAN L, XU Y S, QIAN Y. Potential use of stable isotope and multi-element analyses for regional geographical traceability of bone raw materials for gelatin production. Food Analytical Methods, 2020, 13(3): 762-769.
[21] HARRISON S M, MONAHAN F J, MOLONEY A P, KELLY S D, CUFFE F, HOOGEWERFF J, SCHMIDT O. Intra-muscular and inter-muscular variation in carbon turnover of ovine muscles as recorded by stable isotope ratios. Food Chemistry, 2010, 123(2): 203-209.
[22] 郭莉, 张寰, 王燕, 高岩, 郑玉山, 张宏博. 基于碳、氮稳定同位素技术的羊肉产地溯源可行性研究. 肉类工业, 2020(2): 25-30.
GUO L,ZHANG H,WANG Y,GAO Y,ZHENG Y S,ZHANG H B. Feasibility study on origin traceability of mutton based on carbon and nitrogen stable isotope technology. Meat Industry, 2020(2): 25-30. (in Chinese)
[23] FRANKE B M, GREMAUD G, HADORN R, KREUZER M. Geographic origin of meat - elements of an analytical approach to its authentication. European Food Research and Technology, 2005, 221(3/4): 493-503.
[24] ERASMUS S W, MULLER M, VAN DER RIJST M, HOFFMAN L C. Stable isotope ratio analysis: A potential analytical tool for the authentication of South African lamb meat. Food Chemistry, 2016, 192: 997-1005.
[25] DE SMET S, BALCAEN A, CLAEYS E, BOECKX P, VAN CLEEMPUT O. Stable carbon isotope analysis of different tissues of beef animals in relation to their diet. Rapid Communications in Mass Spectrometry, 2004, 18(11): 1227-1232.
[26] SCHWERTL M, AUERSWALD K, SCHAUFELE R, SCHNYDER H. Carbon and nitrogen stable isotope composition of cattle hair: ecological fingerprints of production systems? Agriculture Ecosystems & Environment, 2005, 109(1/2): 153-165.
[27] ROGERS K M. Nitrogen isotopes as a screening tool to determine the growing regimen of some organic and nonorganic supermarket produce from New Zealand. Journal of Agricultural and Food Chemistry, 2008, 56(11): 4078-4083.
[28] MEKKI I, CAMIN F, PERINI M, SMETI S, HAJJI H, MAHOUACHI M, PIASENTIER E, ATTI N. Differentiating the geographical origin of Tunisian indigenous lamb using stable isotope ratio and fatty acid content. Journal of Food Composition and Analysis, 2016, 53: 40-48.
[29] DEVINCENZI T, DELFOSSE O, ANDUEZA D, NABINGER C, PRACHE S. Dose-dependent response of nitrogen stable isotope ratio to proportion of legumes in diet to authenticate lamb meat produced from legume-rich diets. Food Chemistry, 2014, 152: 456-461.
[30] CARRIJO A S, PEZZATO A C, DUCATTI C, SARTORI J R, TRINCA L, SILVA E T. Traceability of bovine meat and bone meal in poultry by stable isotope analysis. Brazilian Journal of Poultry Science, 2006, 8(1): 63-68.
[31] POUPIN N, MARIOTTI F, HUNEAU J F, HERMIER D, FOUILLET H. Natural isotopic signatures of variations in body nitrogen fluxes: A compartmental model analysis. PLoS Computational Biology, 2014, 10(10): e1003865.
[32] STEVENS R E, O'CONNELL T C. Red deer bone and antler collagen are not isotopically equivalent in carbon and nitrogen. Rapid Communications in Mass Spectrometry, 2016, 30(17): 1969-1984.
[33] JANSEN O E, AARTS G M, DAS K, LEPOINT G, MICHEL L, REIJNDERS P J H. Feeding ecology of harbour porpoises: stable isotope analysis of carbon and nitrogen in muscle and bone. Marine Biology Research, 2012, 8(9): 829-841.
Application of Stable Isotope Technology in the Origin Traceability of Sheep
WANG Qian1,2, LI Zheng1,3, ZHAO ShanShan1, QIE MengJie1, ZHANG JiuKai4, WANG MingLin3, GUO Jun2, ZHAO Yan1*
1Institute of Agricultural Quality Standards & Testing Technology, Chinese Academy of Agricultural Sciences, Key Laboratory of Agricultural Product Quality and Safety, Ministry of Agriculture and Rural Areas, Beijing 100081;2College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018;3College of Food Science and Engineering, Shandong Agricultural University, Taian 271018;4Chinese Academy of Inspection and Quarantine, Agro-Product Safety Research Center, Beijing 100176
【】By comparing the differences of carbon and nitrogen stable isotopes in different parts of mutton and analyzing the stable isotopes of mutton, whole bone meal, de-fatted bone meal and bone collagen, the technical support was provided for the origin traceability identification of sheep. 【】Isotope Ratio Mass Spectrometer (IRMS) was used to determine δ13C and δ15N values in different parts of sheep, and δ13C and δ15N values in de-fatted mutton, whole bone meal, de-fatted bone meal and bone collagen of the sheep bones from different origins (New Zealand, and Ningxia, Gansu, Anhui, China). ANOVA test, linear discriminant analysis and correlation analysis were carried out on the results to determine the traceability of carbon and nitrogen stable isotope to the origin of sheep.【】The δ13C values of hind legs and ribs were significantly different from those of chest fork, abdomen and neck (<0.05), and there was no significant difference in δ15N values among the five parts of hind legs, chest fork, ribs, abdomen and neck (>0.05). The δ13C and δ15N values of de-fatted mutton, whole bone meal, de-fatted bone meal and bone collagen from different origins (Ningxia, Gansu, Anhui and New Zealand) were significantly different (<0.05). De-fatted mutton had the best effect on the origin traceability, with the original discrimination accuracy rate was 84.9% and the cross-validation discrimination accuracy rate was 82.4%. The accuracy rate of distinguishing the origin by whole bone meal and bone collagen was over 65%. The correlation analysis results show that de-fatted mutton, whole bone meal, de-fatted bone meal and bone collagen had extremely significant correlation (<0.01), and the carbon isotope in bone collagen had the highest correlation with de-fatted bone meal and whole bone meal, with correlation coefficients of 0.903 and 0.866, respectively. 【】Stable isotope could effectively identify sheep samples from different origins, and the change trend of stable isotope composition in mutton, whole bone meal, de-fatted bone meal and bone collagen was basically the same, so it was feasible to trace the origin of sheep by using stable isotope technology.
stable isotope; mutton; sheep bone; origin traceability

10.3864/j.issn.0578-1752.2021.02.014
2020-05-21;
2020-09-03
国家“十三五”重点研发计划(2017YFC1601703)
王倩,Tel:15049144206;E-mail:1639828031@qq.com。李政,Tel:15652057927;E-mail:408209783@qq.com。王倩和李政为同等贡献作者。通信作者赵燕,Tel:010-82106558;E-mail:zhaoyan01@caas.cn
(责任编辑 赵伶俐)
