注射用硫代硫酸钠治疗血液透析钙化防御患者的效果
2021-03-06王盛喜
王盛喜
钙化防御是真皮内及皮下组织内微血管闭塞、钙化而出现以皮肤红斑、紫癜、网状青斑等为主要表现的疾病,又可称为钙性尿毒症性小动脉病[1]。该疾病极为罕见,在血液透析人群中患病率仅约0.01%,其危害性大,不仅会使患者出现持续性疼痛症状,且会造成睡眠障碍,使患者产生抑郁、焦虑等悲观情绪,严重影响患者生活质量。钙化防御会破坏皮肤微环境,引起败血症,据不完全统计,超过45%患者1年内因合并败血症导致死亡[2]。因此,及早予以钙化防御患者有效治疗具有积极作用。硫代硫酸钠为抗氧化剂,可结合血液中Ca2+形成硫代硫酸盐,抑制血管钙化[3]。笔者医院针对透析钙化防御患者采用注射用硫代硫酸钠治疗效果良好,现报道如下。
1 资料与方法
1.1 一般资料 选取2016年1月-2019年3月邵阳市中心医院收治的透析钙化防御患者68例为研究对象,采取随机数字表法分为试验组和对照组,每组34例。对照组男23例,女11例,年龄23~68(45.51±19.24)岁,血液透析时间6~68(33.62±21.23)个月;试验组男24例,女10例,年龄22~69(45.41±19.15)岁,血液透析时间6~70(34.09±22.13)个月。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,患者及家属均签署知情同意书。
1.2 纳入及排除标准 纳入标准:血液透析时间>3个月;均经影像学、组织病理学检查确诊。排除标准:血管钙化因胆固醇血栓、糖尿病溃疡等疾病所致;合并恶性骨肿瘤患者;有外伤或创伤手术史者;合并先天性心脏病患者;合并高钙血症患者;有血液透析禁忌证者。
1.3 治疗方法 2组均应用FX80透析器行常规血液透析,透析液选择碳酸氢盐溶液,流量500 ml/min,流速200~250 ml/min,每次透析4 h,每周3次。根据患者症状予以个体化治疗,如镇痛、抗感染治疗等。对照组在此基础上给予碳酸钙胶囊(辽宁康辰药业有限公司生产,国药准字H20074237,规格:0.25 g)1.0 g+骨化三醇胶丸(罗盖全,上海罗氏制药有限公司生产,国药准字J20150011,规格:0.25 μg)0.25 μg口服,每天1次。
试验组给予注射用硫代硫酸钠(上海新亚药业有限公司生产,国药准字H31020534,规格:0.64 g)12.8 g混合生理盐水100 ml静脉滴注,每周3次。2组均连续用药3个月。
1.4 观察指标 比较2组治疗效果,治疗前后血管钙化因子水平及生活质量评分。(1)血管钙化因子:抽取2组空腹肘静脉血,经离心处理后取上清液冻存。采用酶联免疫吸附法检测骨保护蛋白(OPG)、基质Gla蛋白(MGP)、成纤维细胞生长因子(FGF-23)水平,采用电化学发光法检测Ⅰ型前胶原氨基端前肽(P1NP)水平,严格按照试剂盒要求进行操作。(2)采用肾脏病生存质量简表(KDQOL-SFTM1.3)[4]评估生活质量评分,量表包括症状与不适(DRS)、生活负担(KDB)、生活影响(KDE)、性功能(SE)、睡眠(SL)、认知功能(CF)、工作状态(WS)、社交质量(SI)8个维度,共43个条目,评分0~100分,得分越高表示患者生活质量越好。
1.5 疗效评定标准 采用超声心动图检测心脏瓣膜钙化情况,应用腹部侧位X线平片检测腹主动脉钙化情况,采用半定量评分法评估钙化程度,其中心脏瓣膜钙化评分(CVCS)范围为0~6分,腹主动脉钙化评分(AACS)范围为0~24分。根据2组治疗前后血管钙化评分评估疗效。显效:治疗后CVCS及AACS评分下降>80%;有效:治疗后CVCS及AACS评分下降50%~80%;无效:治疗后CVCS评分及AACS评分下降<50%。总有效率=(显效+有效)/总例数×100%。
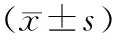
2 结 果
2.1 治疗效果比较 治疗3个月后,试验组总有效率为97.06%,高于对照组的82.35%,差异有统计学意义(χ2=3.981,P<0.05)。见表1。

表1 2组患者治疗效果比较 [例(%)]
2.2 血管钙化因子水平比较 治疗前,2组OPG、MGP、FGF-23、P1NP水平比较均无显著差异(P>0.05);治疗3个月后,2组OPG、FGF-23、P1NP水平均低于治疗前,MGP水平高于治疗前,且试验组优于对照组,差异有统计学意义(P<0.01或P<0.05)。见表2。
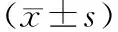
表2 2组患者治疗前后血管钙化因子水平比较
2.3 生活质量评分比较 治疗前,2组KDQOL-SFTM1.3量表单项维度评分及总评分比较差异均无统计学意义(P>0.05);治疗3个月后,2组单项维度评分及总评分均高于治疗前,且试验组高于对照组,差异有统计学意义(P<0.01)。见表3。
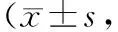
表3 2组患者治疗前后KDQOL-SFTM1.3量表评分比较分)
3 讨 论
钙化防御是终末期肾病出现的严重并发症,好发于柔软且富含脂肪的组织如腹部、臀部及乳房等,随着患者病情加重,会损害机体脑、肺、骨骼肌等血管[5]。因皮肤微小动脉只能供应1~3 cm范围内扇形区域组织,故患者发病早期通常会出现网格状红斑或青斑,逐步进展为皮肤溃疡、坏死,治疗不及时伤口迁延难愈,会继发感染引起败血症。该疾病发病机制目前尚未明确,笔者整理国内外相关资料,归纳疾病发生与以下因素有关:(1)肥胖:大量脂肪堆积增加小动脉拉伸应力及弹性纤维隔膜,进而减少局部血流灌注。(2)基因:钙化防御形成过程中基因表达也发挥一定作用,杨璞等[6]研究表明,NT5E49基因及ENPP1基因突变会破坏焦磷酸代谢通路,诱发动脉钙化。张春华等[7]通过实践发现,钙化防御患者中NT54基因多态性表达比例增加,予以心血管钙化小鼠注射ENPP1抑制剂后,钙化程度明显减轻,提示基因学在钙化防御治疗中的重要作用。(3)血液高凝状态:局部血液高凝会形成小动脉血栓,加剧皮肤损伤。(4)原发性疾病及透析:慢性肾病患者多存在钙磷代谢失衡,导致细胞内Ca2+水平增加,进而造成血管钙化;再者,血液透析时间过长会引起炎性反应、营养不良等,导致血清C反蛋白等炎性因子浓度增加,进而促进钙化因子生成,加剧钙磷沉积。
以往临床上钙化防御多采用钙剂、活性维生素D等药物治疗,可在一定程度上缓解患者临床症状。但有研究表明,长期大剂量使用钙剂、活性维生素D,不仅会抑制甲状旁腺素水平,引起无动力骨病,且会加剧骨外钙化沉积[8]。大量研究报道证实,硫代硫酸钠在减轻血管钙化方面作用显著[9]。陈玉秀等[10]研究发现,采用硫代硫酸钠治疗者总有效率为96.70%,显著高于采用常规治疗者,说明硫代硫酸钠可与血液中多种金属离子结合并形成水溶性复合物,因此可有效缓解患者病情。本结果显示,2组治疗后血管钙化因子水平均明显改善,分析原因:OPG属于肿瘤坏死因子,可竞争性结合破骨细胞分化因子,抑制破骨细胞生成,当其表达水平升高,表明钙化程度加重;MGP广泛分布于软骨、骨髓内,可被维生素K依赖性—羟化酶激活,与Ca2+结合形成复合物,保护血管免于钙化;FGF-23对机体内磷代谢具有调控作用,当其血清浓度上升时,其会抑制磷重吸收,加剧钙化;P1NP会促进骨释放钙、磷,导致细胞内Ca2+水平上升,诱导血管钙化。结果还显示,试验组治疗后总有效率、生活质量评分均高于对照组,分析原因:硫代硫酸钠可螯合血清中游离Ca2+,抑制钙盐沉积,清除血液中炎性因子,保护血管内皮,避免血管硬化、狭窄,该药可生成硫化氢、谷胱甘肽,促进血管扩张,发挥消炎止痛效果。
综上所述,注射用硫代硫酸钠治疗透析钙化防御患者效果显著,可中断血管钙化进程,提高患者生活质量,值得临床推广应用。
