3D-BRAVO增强成像组学分析评估儿童脑胶质瘤IDH1基因突变的价值
2021-03-06白慧萍张增俊魏思文
白慧萍,张增俊,魏思文
西安市儿童医院影像科,陕西西安 710000;
脑胶质瘤占儿童原发性脑肿瘤的 40%~65%,是儿童发病率最高的实体肿瘤[1]。异柠檬酸脱氢酶-1(isocitrate dehydrogenase 1,IDH1)基因状态是胶质瘤诊断及预后的重要补充信息。早期获取IDH1基因突变信息,有助于提高胶质瘤的诊断准确率、评估患儿的恶性程度及预后[2]。目前,IDH1的检测依赖手术获取的病理标本,但鉴于手术对患儿造成的创伤,术前寻找准确判断IDH1状态的无创检查方法十分必要。
三维颅脑容积成像(three-dimensional brain volume imaging,3D-BRAVO)是颅脑薄层容积MRI扫描技术,具有组织分辨率高、多角度重建等优势[3-4]。影像组学能够通过计算机工具挖掘高通量的医学图像信息,为图像解读和信息挖掘提供更多的定量数据[5]。本研究拟探讨基于3D-BRAVO增强图像的组学分析术前预测儿童脑胶质瘤IDH1基因状态的价值。
1 资料与方法
1.1 研究对象 回顾性分析2012年1月—2020年5月于西安市儿童医院行术前 MRI扫描的129例脑胶质瘤患儿,纳入标准:①年龄<18岁;②经手术或活检穿刺确诊为脑胶质瘤;③术前2周内行1.5T颅脑MRI检查,且扫描序列包括3D-BRAVO增强扫描;④术后病理组织均通过聚合酶链反应检测,获取IDH1基因突变信息;⑤临床资料完整;⑥MRI检查和外科手术前未接受局部或全身抗肿瘤治疗。129例脑胶质瘤患儿中,IDH1基因突变型51例,野生型78例。将129例患儿按7∶3随机分为训练组90例和验证组39例。收集患儿的年龄、性别、病灶大小、胶质瘤病理分级。本研究已获得伦理委员会批准,所有患儿家属均已签署知情同意书。
1.2 仪器与方法
1.2.1 MRI检查 采取GE 1.5T MRI扫描仪,患儿取仰卧位,行颅脑常规自旋回波序列轴位 T1WI扫描,参数:TR 500~600 ms,TE 8 ms,层厚5 mm,间隔1.0 mm,矩阵256×256;快速自旋回波序列轴位T2WI扫描参数:TR 4500~5000 ms,TE 102 ms,层厚 5 mm,间隔1.0 mm,矩阵256×256;3D-BRAVO增强扫描参数:TR 7.8 ms,TE 3.0 ms,视野24 cm×24 cm,矩阵512×512,扫描层厚1.2 mm,层间距0.6 mm,对比剂使用钆喷替酸葡甲胺,剂量0.1 mmol/kg。
1.2.2 组学模型构建
1.2.2.1 图像处理及病灶分割 将颅脑 MRI-DWI扫描数据传至GE AW 4.5工作站,以DICOM格式导入ITK-SNAP 3.6.0软件进行病灶分割。分别由2名具有5年儿科 MRI影像诊断经验的医师采用盲法沿病灶边缘逐层勾画感兴趣区(ROI)。第1位观察者进行2次病灶分割(间隔时间6个月),行观察者内一致性检验(ICC),用于评估观察者内的组学特征稳定性;第2位观察者进行1次病灶分割,用于评估观察者间的组学特征稳定性。
1.2.2.2 组学特征处理及模型建立 采用 GE Artificial Intelligent Kit软件进行像素重采样及强度归一化,并提取组学特征。共618个组学特征:大小、形状、直方图特征、高阶特征(Haralick特征、灰度共生矩阵、灰度步长矩阵、灰度区域大小矩阵)。特征选择步骤:观察者内及观察者间一致性检验、最大相关最小冗余算法、最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)算法,并基于上述选择的组学特征,建立Logistic回归模型,经十折交叉验证方法,构建最优组学模型。
1.3 统计学方法 使用R 3.6.0软件,符合正态分布且方差齐的计量资料比较采用独立样本t检验;计数资料比较采用χ2检验,P<0.05为差异有统计学意义。将临床参数和组学模型中的参数联合,构建多元Logistic回归联合模型。采用受试者工作特征(ROC)曲线分析模型诊断效能,采用校准曲线和决策曲线分析模型校准效能和临床应用价值。
2 结果
2.1 临床基本资料IDH1突变型和IDH1野生型患儿年龄、性别、病灶大小比较,差异均无统计学意义(P>0.05);两组病理分级比较,差异有统计学意义(P<0.05)(表1,图1)。
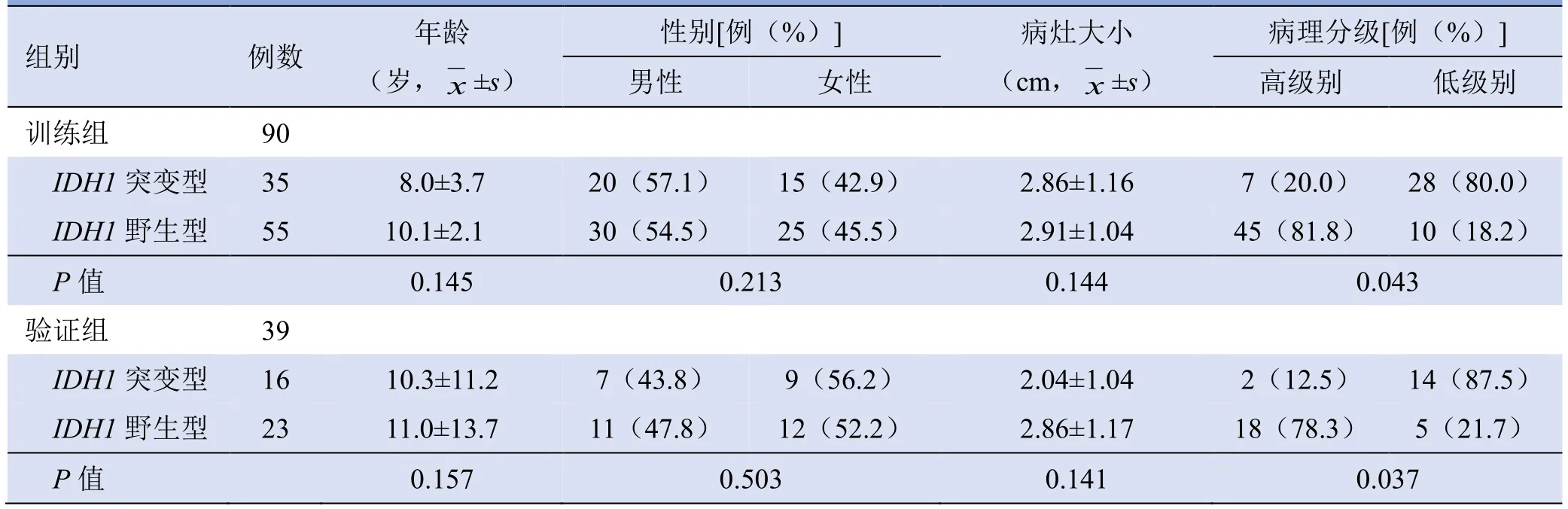
表1 训练组和验证组患儿一般临床资料比较
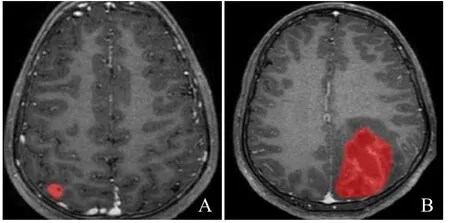
图1 3D-BRAVO增强扫描图像。A.男,15岁,低级别脑胶质瘤,IDH1为野生型;B.女,10岁,高级别脑胶质瘤,IDH1为突变型
2.2 组学模型结果 经特征降维,筛选后得到的组学特征有6个(图2示LASSO特征选择图及组学特征系数图)。组学模型的计算公式为:


图2 LASSO特征选择图及组学特征系数图。A、B.组学特征经LASSO算法降维。A为垂直虚线对应最佳值的λ值:Log(λ)=-3.211,纵轴为每个组学参数的权重系数,当系数收敛为0时,则将该参数剔除,经筛选后,剩余特征6个。B为LASSO算法中在不同的调整参数Ln(λ)下的均方误差,垂直虚线对应最佳调整参数(λ)。C为组学特征系数图:Uniformity(系数= -0.041)、ClusterProminence_angle90_offset3(系数=0.243)、LongRunEmphasis_angle135_offset1(系数=0.385)、LongRunLowGreyLevelEmphasis_AllDirection_offset7_SD(系数=0.179)、Compactness1(系数=1.083)、ClusterShade_angle0_offset1(系数=-0.289)
2.3 诊断效能分析 临床参数(即病理分级)联合组学模型后,诊断效能最优:验证组和训练组的AUC分别为0.92(95%CI0.85~0.98)、0.87(95%CI0.77~0.96),敏感度分别为89.70%、84.36%,特异度分别为86.72%、89.15%(表2,图3)。基于临床组学联合模型的训练组和验证组数据绘制校准曲线(图4)及决策曲线(图5)。

表2 预测儿童脑胶质瘤IDHl基因状态的ROC分析
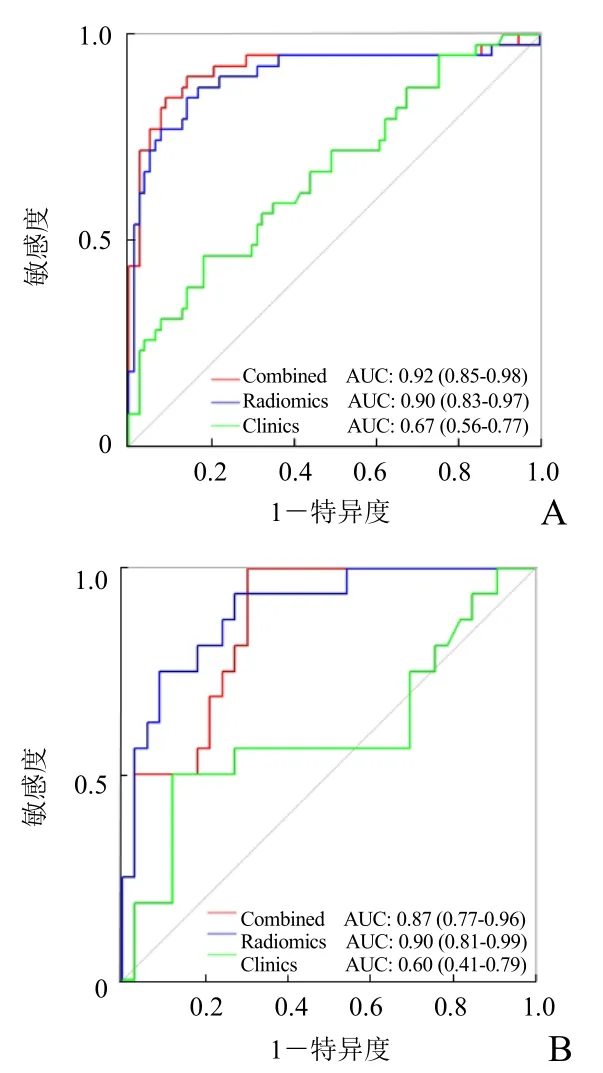
图3 不同模型预测儿童脑胶质瘤IDH1基因状态的ROC曲线,A为验证组,B为训练组
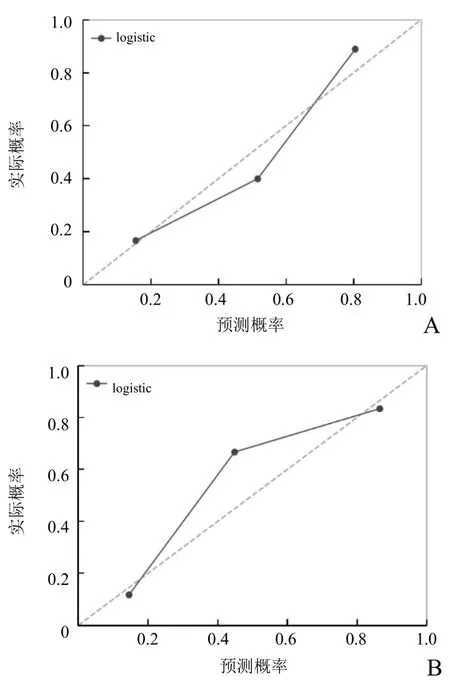
图4 模型预测脑胶质瘤 IDH1基因状态的校准曲线。A为验证组,B为训练组。对角虚线表示理想状况,实线表示校准曲线,用于预测模型的实际状况。实线与对角虚线越接近,表示模型一致性越好
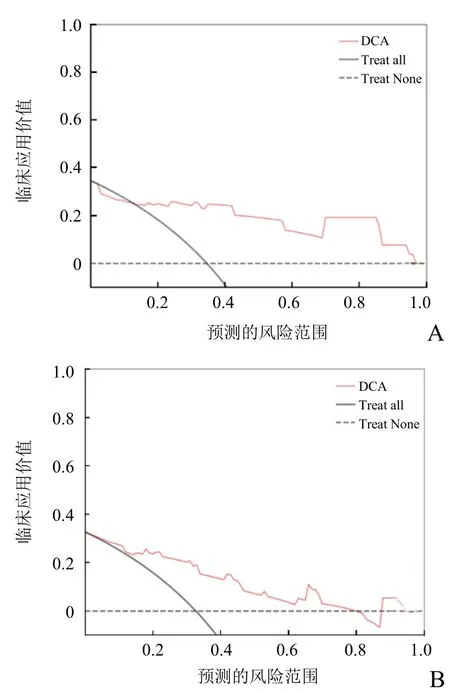
图5 模型预测脑胶质瘤 IDH1基因状态的决策曲线。A为验证组,B为训练组。黑色曲线表示全部患儿均视为IDH1突变状态,黑色虚线表示全部患儿均视为 IDH1未突变状态。红色曲线下面积越大,表示临床应用价值越高
3 讨论
3D-BRAVO是三维梯度回波影像技术,在组织的观察和细微结构的显示方面具备显著优势[6-7]。影像组学能够获得医师肉眼识别难以获取的定量参数,在辅助医师进行诊断、疗效预测等方面发挥重要作用[8-9]。基于MRI组学模型预测IDH1突变状态的研究较少,且诊断效能有限[10-11]。
本研究纳入618个影像组学特征,从病灶的三维大小、形状、纹理、高维度特征进行全面描述。首先通过ICC检验,剔除了观察者内稳定性低的参数,为提高模型鲁棒性提供了基础。此外,通过最大相关最小冗余算法获得了与IDH1突变相关性大的参数,剔除了组学参数之相关性高的参数,降低了参数的共线性。LASSO算法进一步降低了组学参数维度,找到最优的组学参数,用于纳入组学模型。综上所述,本研究针对618例高维度组学参数进行严格筛选,为建立模型提供了最优的组学参数。本研究的组学参数处理方法与文献报道一致,已成为较成熟的模型处理流程[12]。
组学模型共纳入6个组学参数,从不同角度反映了图像的异质性。其中,Compactness反映了图像轮廓中像素值的紧密度,Uniformity反映了ROI内部像素值的一致性,LongRunEmphasis、LongRunLow GreyLevelEmphasis、ClusterShade反映了图像灰度值分布的随机性及分散程度。Philip等[13]报道,IDH1突变更多见于低级别胶质瘤,此类患者的恶性程度低,肿瘤细胞增殖活跃度较低,故更易表现出较低的异质性。组学模型对预测儿童脑胶质瘤IDH1突变的效能较高,验证组和训练组的AUC分别为0.90和0.90,显示出较好的预测潜力。
本研究结果发现,病理级别在IDH1基因突变及野生型组间存在差异,与孙怡等[14]的研究结果一致,即发现不同WHO病理级别胶质瘤间IDH1基因突变阳性率存在差异。WHO病理级别与胶质瘤的恶性程度存在显著相关性,而IDH1基因突变者更倾向于具有较好的预后,可在一定程度上解释胶质瘤病理分级与IDH1基因突变的相关性。将有组间差异的临床参数(即病理分级)与组学参数进行联合诊断,获得临床组学联合模型,结果发现验证组和训练组的AUC分别为0.92和0.87,与组学模型效能相当,提示临床参数对胶质瘤IDH1基因突变的诊断价值有限,即使纳入联合模型,仍未显著提升效能,进一步反映组学模型在预测IDH1基因突变中的价值。
本研究的局限性为:样本量较小,后续研究需扩充样本量进一步验证;未纳入更多的高阶组学参数。
总之,基于MRI的3D-BRAVO增强成像的组学分析,可在术前无创评估儿童脑胶质瘤IDH1基因突变状态,为儿科医生诊断和治疗脑胶质瘤提供更多的信息。
