光动力疗法在治疗消化道肿瘤中的应用与研究进展
2021-03-05石霞飞陈茜茜车伯琛阴慧娟李迎新
石霞飞,陈茜茜,2,车伯琛,阴慧娟*,李迎新*
(1. 中国医学科学院北京协和医学院生物医学工程研究所,天津 300192;2. 国家康复辅具研究中心,北京 100176)
光动力疗法(photodynamic therapy,PDT)作为一种新型的肿瘤治疗方法,于20世纪80年代早期首次用于食管癌的治疗[1]。由卟吩姆钠(porfimer sodium)和630 nm准分子染料激光器介导的PDT治疗浅表食管癌取得了令人瞩目的效果后[2],PDT于1994年和2005年先后被日本和韩国批准作为浅表食管癌的姑息性治疗方法;并于1995年,被美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于晚期食管癌的姑息性治疗。
但与许多治疗方法类似,PDT不能对靶病变部位进行组织学检查(可用于评估肿瘤的侵袭)。此外,如果使用剂量不当,可能会导致胃肠道狭窄。当使用卟啉(photofrin),即首个被批准上市的的光敏剂(photosensitizer,PS)进行PDT时,可能会出现严重的皮肤和眼部光毒性反应[3]。上述弊端导致PDT在胃肠道疾病中的应用减少。但由于其微创性、对肿瘤的高选择性以及操作简单而具有良好的患者依从性,它仍被广泛用于姑息性治疗和挽救性治疗。近年来,随着科学研究的发展,先进的PDT技术,如纳米颗粒、新的光敏剂和光源更容易到达局部病变部位。目前PDT使用的大多数光敏剂都是带荧光的,这使得其在治疗过程中可以成像。最近,这个特性得到了极大的利用。随着这些新技术的发展,结合内窥镜设备的改进,PDT可能被用于治疗各种胃肠道疾病。内窥镜下切除(endosccopic resection,ER)包括黏膜下剥离术(endosccopic submucosal dissection,ESD)和黏膜下切除术(endosccopic mucosal resection,EMR),已成为早期浅表消化道肿瘤盛行的标准治疗方法[3]。
本文中,我们将对目前PDT在消化道肿瘤中的应用和研究进行总结,并在此基础上介绍PDT最新的临床应用。
1 原理和机制
PDT是一种利用光能破坏异常和恶性病变组织的临床治疗方法,包括特定波长的光、氧分子和光敏剂三大要素。在特定波长光的照射下,光敏剂从基态(S0)到激发单重态(S1),经过系统间交叉到寿命较长的激发三重态(T1)[4-5]。光敏剂在T1状态下有两种可能的反应类型[6]:1)Ⅰ型反应,即激发分子与底物反应生成活性基团,活性基团又与生物成分如质膜、肽、蛋白质和核酸反应[7-8];2)Ⅱ型反应,其涉及激发单重态的活化光敏剂向氧分子的能量转移。能量从T1态转移到生物底物(R)和分子氧,通过Ⅰ型和Ⅱ型反应产生活性氧物质(reactive oxygen species,ROS),包括1O2、H2O2、O2*、HO*等,最终引起细胞损伤,从而导致肿瘤细胞坏死或凋亡,具体作用原理如图1所示[9]。这两种反应都是瞬时发生的,其发生的可能性取决于所用光敏剂的类型、底物和氧的丰度以及光敏剂对底物的结合亲和力[10]。此外,由于活性氧物质的半衰期较短,PDT效应仅限于局部和邻近细胞[10]。
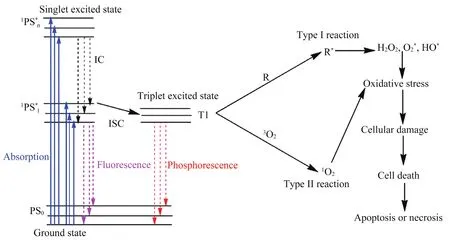
图1 PDT的作用原理图[11]Fig. 1 Schematic diagram of PDT[11]
随着光纤技术的发展,PDT被广泛地应用于各种腔系肿瘤的治疗。其在肿瘤治疗方面具有很多优势,如创伤小、毒性低、特异性强、重复性好等。此外,它可以消除复发性病变,激活继发性免疫反应[12]。美国FDA已批准将内窥镜光动力疗法(endoscopic photodynamic therapy,EPDT)用于一系列肿瘤的治疗,包括肺癌、宫颈癌及各种消化道恶性肿瘤(如食管癌、胆管癌、胃癌、结直肠癌等)[13-14]。
消化道由口开始,以肛门结束,并被腔体包围。大多数消化道肿瘤发生在黏膜层,即最暴露的部分。随着柔性内窥镜技术的发展,光能可以直接传输到消化道的恶性病变部位,这使得PDT成为一种受欢迎的微创局部治疗方式[15]。结合成像剂量学和标定,其应用潜力甚至更大[16]。
2 PDT治疗消化道肿瘤的研究
2.1 食管癌PDT
PDT在美国和日本被批准作为一种内窥镜手术后,食管癌成为其第一个临床适应症。目前PDT已被用于内窥镜下切除巴雷特食管(Barrett’s esophagus,BE),并在一定程度上消除高度异常病变[17-20]。表1是对目前PDT治疗食管癌的代表性研究详细整理的结果,包括肿瘤类型、纳入的病例数、病理分期、所用光敏剂及其给药方式和治疗效果等。通过这些研究可以发现,使用PDT可以在浅表病变治疗中达到完全缓解(complete remission,CR)的效果。关于将PDT用于局限在黏膜层的食管鳞状细胞癌(squamous cell carcinoma,SCC)的研究表明,虽然这些患者大部分有严重的共病,无法手术切除,但这些患者淋巴结转移风险较低,因此PDT可以代替食管切除术对其进行治疗[19]。既往研究表明PDT治疗食管黏膜鳞状细胞癌患者的总生存(overall survival,OS)与食管癌切除术患者相似,无重大并发症及治疗相关死亡[21-22]。与内窥镜切除相比,PDT并发症发生率低,操作简单,不受病变大小和周长的限制。鉴于这些结果,对于有严重的共病及无法在内窥镜下完全切除的大面积或多病灶性浅表鳞状细胞癌患者,PDT似乎是替代内窥镜切除术的理想治疗方法。
2.1.1 放化疗局部失败的食管癌的挽救性治疗
最近的研究表明,PDT在食管癌最终放化疗(chemoradiotherapy,CRT)局部失败的挽救性治疗中发挥了有益作用。CRT后发现局部残留病变时,应优先考虑将挽救性食管切除术作为治疗方案。然而,与计划性食管切除术相比,该方法具有更高的术后死亡率和复发率[33]。虽然EMR可能是这些病例的另一种治疗方法,但其仅限于表面病变,而且手术需要经验丰富的内窥镜医师。另一方面,PDT可用于浅表肿瘤和晚期食道鳞状细胞癌的姑息性治疗。最初,卟吩姆钠介导的PDT被引入作为CRT后局部失败的挽救性治疗。为了达到更好的治疗效果,PDT作为挽救性治疗的适应症如下:1)PDT前电子计算机断层扫描(computed tomography,CT)未见淋巴结或远处转移;2)原发部位残留或复发肿瘤,分期不超过T2;3)未侵犯颈段食管;4)ER包括ESD未见因放射治疗伴深部溃疡或严重纤维化或病变侵入深部黏膜下层;5)患者拒绝手术或身体并发症导致无法忍受手术。在目前的研究中PDT显示了良好的疗效,同时对CRT局部失败患者有长期疗效[28,34]。Yano等[35]的前瞻性研究证实了挽救性PDT治疗CRT局部失败后的有效性和安全性。试验中25例局限于黏膜下层的局部失败患者被纳入,治疗时光敏剂卟吩姆钠以2 mg/kg静脉注射,48 h后用630 nm准分子燃料激光器(EDL-1,日本滨松)照光,以光功率密度160 mW/cm2照射7 min 48 s,达到的能量密度为75 J/cm2。治疗后19例PDT患者获得了CR(CR率为76%)。其中1例与治疗相关的死亡是由胃肠出血导致的,怀疑是治疗部位的食管主动脉瘘在腹膜透析后约1个月发生的[29,35]。另一项对113例CRT后T2内局部衰竭的患者进行的大规模研究显示:中位随访时间为5年或更长时,PDT后5年无进展生存率(progression-free survival,PFS)和OS分别为22.1%和35.9%,但治疗后再复发的死亡率仅为1.8%[28]。在一项37例连续局部衰竭患者(CRT前的病例对应分期为T1/T2/T3/T4 的患者数分别为3/4/24/6,对应N0/N1的患者数为13/24)的回顾性研究中,使用卟吩姆钠介导的PDT进行挽救性治疗,卟吩姆钠以2 mg/kg静脉注射,于注射后48 h和72 h分别照光,总的光剂量为75 J/cm2。在为期55个月的后期随访中有22例(59.5%)出现CR,5年PFS为20.7%,中位OS为36.1%。因此,对于无转移患者,PDT可以作为一种很好的治疗选择[27]。
2.1.2 完全或部分梗阻性食管癌的姑息性治疗
由局部晚期食管癌引起的吞咽困难是一个严重的问题,而在实践中放置自膨胀金属支架(selfexpandable metallic stent,SEMS)可以快速缓解症状。卟吩姆钠介导的PDT在日本只被批准用于治疗浅表食管癌,但PDT最初被FDA批准用于症状梗阻性食管癌的姑息性治疗。既往研究表明,SEMS是姑息性治疗的首选,其疗效优于PDT等其他激光治疗[36]。然而,由于严重的疼痛或放疗,有些病例在放置SEMS时存在困难(图2)。Lindermann等[31,37]对250例接受包括PDT在内的多模式姑息性治疗的食管癌不可手术患者进行了回顾性研究,比较了包括支架放置和近距离治疗在内的多模式姑息性治疗的疗效。其中PDT治疗时光敏剂以2 mg/kg静脉注射给药,48 h后进行照光,所用光源为630 nm KTPNd : YAG激光器(Laserscope;Surgical Systems,Gwent,UK),照射能量为100 J/cm2,治疗后与其他治疗方法相比,PDT显示了最有利的生存结果:中位生存期为50.9个月。而如果最初使用其他疗法(内窥镜扩张、腔内近距离放射治疗、外照射、化疗、支架植入、饲管或姑息性切除),中位生存期为17.3个月[31]。Heier等[38-39]进行了两项随机对照试验,比较了PDT和Nd:YAG热消融治疗对晚期食管癌吞咽困难的缓解效果。总的来说,两种疗法在改善吞咽困难方面的效果是一样的,但是PDT的反应时间更长。
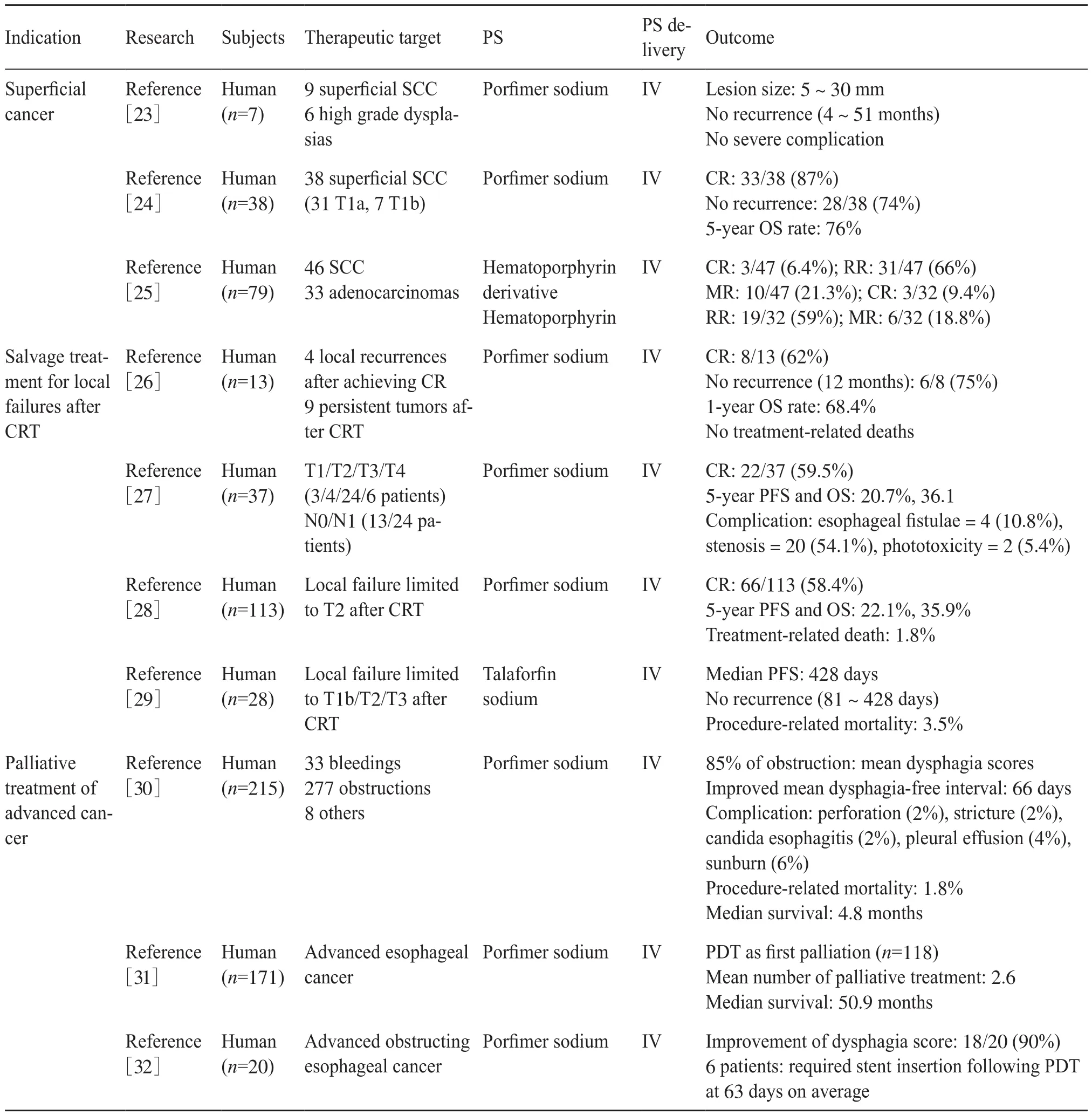
表1 食管癌的光动力治疗Tab. 1 Photodynamic therapy for esophageal carcinoma

图2 1例阻塞性食管癌CRT术后复发患者使用卟吩姆钠介导的PDT进行姑息性治疗[40]Fig. 2 Palliative treatment of PDT using porfimer sodium for a patient with obstructive recurrent esophageal cancer after CRT[40]
2.1.3 食管癌PDT的主要并发症和副作用
在PDT治疗食管癌的研究和临床应用中,使用更多的是第一代光敏剂卟吩姆钠,但是由于避光期较长,吞咽困难缓解的时间较长,卟吩姆钠的适应症可能比较有限。目前世界范围内市场上有几种可供临床应用的光敏剂,包括卟吩姆钠、替莫泊芬、塔拉泊芬钠和5-氨基酮戊酸。表2为上述光敏剂的最佳激发波长和获批国家。其中日本治疗食管癌的两种主要的光敏剂是第一代的卟吩姆钠和第二代的塔拉泊芬钠。PDT的临床试验使用卟吩姆钠治疗食管癌的主要并发症包括食管狭窄需要球囊扩张6例(25%)和食管主动脉瘘1例(4%)[41]。因此,在使用塔拉泊芬钠的PDT试验中,放疗前出现基线T4主动脉侵犯或病变大于3 cm或管腔半周的患者被排除。根据修订后的标准,使用塔拉泊芬钠进行PDT试验时未见食管穿孔或狭窄的报道[29]。在治疗前评估病变的深度和确定其与大动脉的距离是很重要的,尤其是在使用塔拉泊芬钠时,因为与第一代光敏剂相比,塔拉泊芬钠使用了更长波长的激光。这两种药物最显著不同的并发症是皮肤光毒性。在基于塔拉泊芬钠的PDT中没有患者出现皮肤光毒性,而32%的患者在使用卟吩姆钠后至少一个月的避光期内出现皮肤光毒性[29,42]。

表2 光敏剂在世界食管癌治疗中的临床应用Tab. 2 Clinical application of photosensitizers for esophageal cancer worldwide
2.1.4 PDT治疗食管癌的展望
随着第二代光敏剂的出现,PDT在世界范围内的食管癌治疗中将会越来越普及。新的光敏剂制剂应开发具有更高选择性的分子靶向制剂,代谢更快,渗入聚集更深。成本效益也是广泛使用PDT的一个关键问题。这种手术需要昂贵的光敏剂和激光设备,然而,在日本这种手术是由全民保险覆盖的,比外科手术更便宜。对于使用第一代光敏剂的PDT,卟吩姆钠提供了最长的质量调整后的预期寿命,使其比手术干预更具成本效益。然而,最近的一项研究表明,与其他内窥镜技术或食管切除术相比,其有效性的证据还不够充分和确定[43]。此外,第二代光敏剂在食道的PDT治疗的成本-效果分析还比较缺乏,需要进一步研究。随着社会老龄化,PDT作为一种比手术更方便、更简单的方法,有可能应用于更多的患者。
2.2 胆管癌PDT
胆管癌(cholangiocarcinoma,CCC)早期诊断困难,发现时常已处于晚期,难以切除。胆管支架植入术主要通过使用自扩张金属支架,已成为恶性狭窄无法切除的CCC的姑息性治疗的主要手段[44]。然而,预防肿瘤的生长和维持支架的通畅仍是亟待解决的问题[45]。肺门癌患者可用的姑息性治疗法包括PDT,这是一种单一的微创疗法,并发症少,耐受性好。PDT联合胆管支架是一种很有吸引力的治疗方法,因为它通过产生单线态氧减少肿瘤组织的局部阻塞,并可能维持长期通畅。几项无对照和对照研究比较了单独支架植入术与PDT支架植入术对不可切除的CCC的影响[46-54]。如表3所示,在胆管癌的PDT治疗中,所用光敏剂主要是卟吩姆钠,相比于对照组,PDT联合胆管支架治疗后,患者的中位生存期显著延长,最长达630 d。这些试验表明,PDT通过减少支架翻修和经皮胆管引流等进一步手术的需要,改善了患者胆汁淤积状况,并提高了其生活质量。PDT可能导致肿瘤“重塑”,以延长或增强减压效果,从而延长了支架的开放时间。PDT也与不能切除的CCC患者的OS增加有关。PDT的不良反应是可预测的,而且相对容易治疗。两项研究都没有报道严重的光毒性或与手术相关的死亡[53-54]。因此,作为不可切除的CCC的姑息性疗法,PDT可能有很好的应用前景。

表3 光动力疗法联合胆管支架对胆管癌患者的姑息性治疗Tab. 3 Palliative treatment of patients with cholangiocarcinoma by photodynamic therapy combined with biliary stent
2.3 胰腺癌PDT
目前,胰腺癌(pancreatic cancer,PanCa)的生存统计数据并不理想,手术仍是其主要的治疗手段。对于那些无法手术切除的患者来说,迫切需要寻求新的治疗方法。PDT在不可切除性疾病的治疗中具有重要作用。已有两篇关于使用PDT缓解不可切除性PanCa的报道[55-56],虽然这两项研究使用了不同的光敏剂,但结果都很理想,均符合肿瘤坏死的标准。在一项关于维替泊芬的研究中,15例不能手术的癌症晚期患者静脉注射维替泊芬(0.4 mg/kg)60~90 min后,在CT引导下用690 nm的激光进行照射(光能量分别为5、10、20、40 J),重复治疗直至出现直径为12 mm大小的坏死区域。其中1名患者恢复到了可切除状态,并接受了胰十二指肠切除术(whipple procedure),实现R0切除[55]。与其他治疗学和纳米医学相结合,PDT在PanCa治疗中具有巨大潜力。
2.4 胃癌PDT
2.4.1 光动力诊断(photodynamic diagnosis,PDD)
随着内窥镜诊断准确性的提高以及内窥镜治疗如EMR和ESD的侵袭性的降低,胃癌患者的预后有了显著的改善。但是对于肠上皮化生的患者,恶性病变的检测和切除范围的评估仍然是困难的。近年来,PDD和PDT已经成为一种备受青睐的胃癌的诊断和治疗方法。作为一种诊断方式,PDD利用了吸收光能量后,光敏剂从激发态回到基态时发射的荧光。PDD的原理与传统的荧光引导手术方法有重叠,但通过使用光敏剂来区别自身。事实上,大多数PDD都是用5-氨基乙酰丙酸(5-aminolevulinic acid,ALA)及其衍生物作为光敏剂的。ALA是血红素生物合成途径中的一种天然氨基酸和早期中间体。口服ALA主要与恶性细胞结合,代谢为具有光动力活性的原卟啉IX(protoporphyrin IX,PpIX)。PpIX是一种强光敏剂,在409 nm左右(Soret波段)有很强的吸收,在505、540、575 nm和630 nm(Q波段)效率较低。在激发时,荧光发射在635 nm和705 nm[57],即在蓝光激发下发出红色荧光。这些荧光特征对于手术过程中识别肿瘤组织非常有用,可以提高对肿瘤的准确定位和更全面的荧光介导的组织切除。此外ALA的主要优点是代谢迅速,大大缩短了皮肤的光敏期,其介导的光动力诊断荧光定位可以提供良好的胃恶性病变的可视化,以确定病变程度。除ALA外,卟吩姆钠、吲哚菁绿、间-四羟基氯苯酚、焦脱叶绿酸-a、苯并卟啉衍生物等光敏剂也用于PDD的研究。其中,间-四羟基氯苯酚、焦脱叶绿酸-a和苯并卟啉衍生物的应用还处在临床前研究阶段;而ALA、卟吩姆钠、吲哚菁绿等已被分别批准用于临床PDD,具体信息如表4所示[58-61]。

表4 PDD和PDT的临床和试验用光敏剂综述Tab. 4 An overview of clinically used and experimental photosensitizers for PDD and PDT
2.4.2 PDD和PDT在胃癌中的应用
多项研究表明,ALA-PDD是一种理想的诊断胃癌微小病变和腹膜转移的手段。Namikawa等[62-64]比较了用15~25 mg/kg ALA预处理或未处理情况下进展期胃癌的分期腹腔镜检查结果,显示该方法可接受的敏感度为80%~90%,特异性为45%~100%。尽管特异性存在异质性,但与传统白光下观察相比,其检出率仍有提高,至少10%的患者有新发现的腹膜转移[61,63-64]。Kishi等[63]还特别报道了术前化疗会导致假阳性率升高,特异性降低。然而,在一项较小的研究中,使用更低的ALA剂量(10~15 mg/kg)时,胃癌患者白光手术的敏感性和特异性为100%[65]。日本的一项研究表明,利用激光内窥镜在27个病变中发现了23个上消化道肿瘤为红色荧光定位(PDD阳性)[66]。有趣的是,除了1例肠道型癌外,其余均为PDD阳性,而印戒细胞癌为PDD阴性。为了评价对胃癌腹膜转移的检测价值,有研究将ALA-PDD加入到52例晚期胃癌的常规腹腔镜诊断中。使用ALA-PDD的24例患者中有5例在白光下发现腹膜播散,肉眼未见腹膜转移[65]。在另一项研究中,Kishi等[67]对13例血清侵袭性胃癌患者进行了ALA-PDD分期腹腔镜检查,发现PDD组腹膜转移检出率明显高于白光组。这些结果表明,ALA-PDD可能对进展期胃癌的术前分期有帮助。
晚期胃癌的治疗,尤其是血清阳性胃癌的治疗,主要集中在预防腹膜复发,因为腹膜是治疗性胃切除术后最常见的复发部位之一。虽然已经尝试了几种治疗方案,包括全身辅助化疗和腹腔内化疗(无论是否伴有热疗和CRT)[68-70],但还没有标准有效的治疗方法来预防腹膜复发并显著提高生存率。PDT可能是一个很好的替代治疗方案,因为腹膜表面的微转移结节和腹腔内浮动的癌细胞可能是合适的PDT治疗靶点。在一项使用腹膜转移小鼠模型的研究中发现了另一个第二代光敏剂塔拉泊芬(talaporfin),腹腔注射时在转移结节中相比正常组织富集更多。塔拉泊芬介导的PDT在体内也发挥了相当大的抗肿瘤作用。用纳米颗粒装载吲哚菁绿给药后48 h,所用光源为808 nm光纤耦合激光器(FC-W-808,最大输出功率为10 W),以功率密度500 mW/cm2进行照光,照射时间为1 000 s(总的光能量密度为500 J/cm2),PDT 2周后统计小鼠扩散性结节的数量和大小。结果发现腹腔转移结节的总重量较低,这些小鼠也有显著的体重减轻和更高的存活率[71]。这表明PDT可能是一种有前途的诊断和治疗胃癌腹膜转移的方式。
2.5 结直肠癌PDT
结直肠癌是一种常见的消化道肿瘤,对不宜手术或经过手术、放疗、化疗后复发的中晚期患者,采用PDT或PDT联合其他疗法能改善肠道症状,延长生存期。Huang等[14]报道,肠镜下卟啉介导的PDT治疗中晚期结直肠癌患者12例,总有效率为75%,患者肠道刺激症状及排便习惯改变,便血和不完全性肠梗阻等主要症状均得到显著改善,症状改善率分别为80%、100%和50%。Dohmoto等[72]对71例晚期直肠癌患者行PDT治疗,结果表明79%患者症状有所缓解。Hodgkinson等[73]用PDT治疗早期结肠癌患者2例,后经肠镜检查,发现病变消失,病检未见癌细胞,无瘤生存期分别达到20和28个月。由此可见,PDT对早期结直肠癌可达到根治效果,对早期、晚期结直肠癌都具有确定疗效。
3 PDD和PDT在消化道肿瘤应用中的挑战和新进展
尽管PDD和PDT在消化道肿瘤的诊断和治疗中取得了很好的效果,但也呈现出许多问题。大多数临床研究在样本量和指标方面受到限制,迫切需要更大规模的随机/对照临床试验。关于临床试验的设计,必须尽可能做到标准化,这样个体试验更容易进行比较。每种具有不同光学特性的新光敏剂都需要确定最大耐受光敏剂剂量、光剂量和最佳给药后照光时间。后续研究需要对原发肿瘤的类型、先前的治疗方法和报道的结果参数进行均质化。
为了使PDT的效果最大化,需要进一步研究增强其3个核心元素:光敏剂、光和氧。图3显示了克服PDT局限性的最新进展[74-99]。
3.1 光敏剂
3.1.1 光敏剂给药方式改进

图3 关于提高PDT治疗消化道肿瘤疗效的最新进展和未来展望Fig. 3 Recent developments and future perspectives with regard to improving the efficacy of PDT to treat gastrointestinal tract cancers
通过静脉给药,特别是多次给药,光敏剂会引起过敏、毒副作用和未知的生物分布。未知的生物分布会导致光敏剂在眼睛和皮肤等易受光照射的非受累组织中积累,这可能导致患者在环境光照射下产生光毒性和延长光敏性。光敏剂局部给药可以解决这些问题。局部给药可缩短治疗时间,提高疗效,彻底消除皮肤光敏。针对胃肠道肿瘤局部实施PDT有几种方法,包括通过内窥镜腔进行喷涂,瘤内注射以及使用光筛涂层支架。近年来的研究也关注于增强光敏剂在皮肤及肿瘤组织中的渗透性,以达到更好的PDT效果。渗透性的增强可用物理方法实现,如离子导入、激光渗透、微针、超声导入,也可加入化学促渗剂,如二甲基亚砜、油酸等[74-77]。最近还有通过纳米颗粒载体和量子点来修饰光敏剂以提高吸收效果的研究报道。
3.1.2 光敏剂新药开发
光动力技术在消化道恶性肿瘤的早期诊断和治疗中的应用已得到广泛研究。分子成像可用于早期发现病变,是消化道内窥镜检查领域的研究热点。分子成像不仅能反应目标细胞的大致形态,更能使其纹路可视化。随着新成像技术的发展(如虚拟彩色内窥镜和放大内窥镜等),分子成像技术也在不断发展。在分子成像中,疾病特异性的生物标志物是使用荧光标记的外源性分子探针,包括抗体、抗体片段、多肽、纳米颗粒和可激活的探针[78]。将分子探针与光敏剂结合可以增强肿瘤的靶向性和内窥镜对微小病变的检测。Han等[79]利用噬菌体展示技术分离出一种特异性的结肠癌肽,并将其与有望成为第二代光敏剂的血卟啉(hematoporphyrin,HPP)结合。使用荧光素异硫氰酸酯或HPP结合肽进行免疫组化染色显示,它们对结肠癌细胞系具有很高的亲和力。与单独的HPP相比,HPP结合肿瘤特异性肽具有增强的PDT效应。这些结果表明,肽探针靶向PDT有望成为结肠癌诊断和治疗的新方法。
光敏剂嵌入支架允许可重复的腔内PDT,这将抑制周围的消化道恶性肿瘤并增加支架的通畅性。最近一项关于聚合物光敏剂(丙酮酸普鲁兰偶联脱镁叶绿酸 A)-内嵌自扩张无血管金属支架的研究,在局部注射光敏剂的情况下对CCC进行可重复PDT,结果表明该支架在体外能维持至少2个月的PDT效应;此外,使用HCT-116肿瘤-异种移植小鼠模型的体内试验显示,激光照射后肿瘤细胞和移植瘤消退[80]。PDT可以通过单态氧破坏上皮层,从而提高非血管药物洗脱支架(drug-eluting stents,DESs)释放药物的组织穿透效率(penetration efficiency,PE%),这一过程被称为光化学组织穿透(photochemical tissue penetration,PTP)。Han等[80]将光敏剂二氢卟吩e6(chlorin e6)加入到吉西他滨(gemcitabine)洗脱的聚氨酯膜中,开发了一种PTP-DES。该支架的穿透效率是聚氨酯膜的2倍,并且在小鼠体内模型中有效地抑制了肿瘤的生长。该研究结果表明,PTP-DES系统在改善传统DES治疗效果方面有很大的潜力。
将PDT与分子靶向治疗相结合的纳米医学可增强抗癌治疗的效果,改善消化道恶性肿瘤患者的预后,同时降低毒性。最近,出现了一种新型的光活化抑制剂纳米脂质体(multi-inhibitor nanoliposome,PMIL),它由在脂质双分子层中掺杂了光敏剂苯卟啉衍生物(benzoporphyrin derivative)的纳米脂质体和封装了多激酶抑制剂的纳米颗粒组成[81]。这种新型纳米级药物不仅能引起肿瘤细胞和微血管的光动力损伤,还能启动卡博替尼胶囊(cabozantinib)在肿瘤内的释放。在PanCa小鼠模型中,PMIL可导致肿瘤的长期减少和转移抑制。这些结果为PDT在肿瘤选择性化疗中的应用奠定了基础。
3.2 PDT光源改进
为了提高PDT的临床应用,第二个关键点是提高激发光的组织靶向性。在PDT中,利用现有的光源可以很容易地照射表面组织,但是很难到达深部肿瘤组织。例如,蓝光(400~450 nm)仅可穿透约1.0 mm的组织,橙光(590~620 nm)可穿透约1.5 mm的组织,而红光(620~750 nm)穿透较远,可达3.0 mm[82]。较新的光源(如LED)正在被开发,以更有效地传递光。LED可以产生所需波长的高能量光,并能按照一定的几何形状和尺寸进行组装[83-84]。为了提高激发光到达肿瘤组织的效率,我们团队针对直肠的特殊结构,专门设计和研发了直肠栓剂试剂盒,包括ALA栓剂和LED栓剂试剂盒。ALA栓剂可于37℃在30 min内软化无硬心,直肠给药后靶向聚集在肿瘤部位。LED直肠栓光源的电功率为0.2 W,输出的光功率密度为20 mW/cm2,能实现长时间稳定输出。与常用的光纤耦合激光相比,LED直肠栓光源明显提高了PDT治疗直肠癌的效果[85]。Guyon等[86]研究了一种可以植入在腹腔内的光照射板,这种光照射板实现了对腹膜腔的均匀照射。使用腔镜光照射的腹腔内光弥散也是一种很有前途的照光新方法[87]。Sedat等[88]开发了由生物衍生或生物相容性和生物可降解聚合物制成的可植入式光传输装置,使用梳状平面波导,实现了猪皮肤全厚度(>10 mm)的伤口愈合。这一结果为光在深层组织中的应用指明了新的方向。但光在组织中的穿透深度总是有限的,仍需要考虑激发光敏剂的替代方法[89]。
最近出现了一种利用X射线辐射诱发PDT的新方法。由于组织对于X射线几乎是全透过的,这种方法可以非侵入地远距离激发光敏剂,并有可能在整个放射过程中持续(图4)。这种技术依赖于纳米粒子,其能实现电离辐射的下转换,如将X射线转换为可见光[90]。当与光敏剂结合时,纳米助摇器可以将用于放射治疗的X射线转换成可见光,继而激发光敏剂。这种X-PDT疗法在体外和体内都获得了令人鼓舞的结果,Hu等和Fan等分别对这些结果进行了综述[91-96]。
3.3 组织氧浓度
在PDT过程中,通过测量氧分压和缺氧标记物的水平来监测肿瘤组织的氧合情况,以便在光照过程中改善靶组织中单线态氧的分布。此外,通过控制光/暗周期来分割光照射可以促进组织氧再灌注,以补偿光化学反应引起的氧消耗[97-99]。
4 总结与展望
本文回顾了一些使用PDT治疗消化道恶性肿瘤的关键研究。PDT的缺点包括不理想的疗效、光毒性和高成本,这些都降低了人们对用该方法治疗消化道恶性肿瘤的最初热情。因为PDT是一种微创手术,所以它仍然可以起到缓解和挽救的作用。近年来,PDT的应用范围不断扩大,在早期诊断、局部失败的挽救性治疗、消化道癌变的缓解等方面取得的良好效果,为PDD和PDT的应用提供了新思路。随着各种关于光传递和高特异性光敏药物创新方法的发展,最具限制性的挑战可能得到解决。将PDT与分子成像、DES和纳米技术等现有技术相结合,有望使PDT成为治疗消化道肿瘤的理想选择。

图4 光致发光纳米材料介导的放射治疗激活PDT治疗腹膜癌的原理图[90]Fig. 4 Schematic overview of the use of radiotherapy-activated PDT for peritoneal carcinoma (PCAR) using radioluminescent nanomaterials[90]
此外,目前在PDT治疗消化道肿瘤的研究和临床治疗中所用的光源还是以激光为主,其过于依赖内窥镜导致价格昂贵、操作复杂,中小型医院很难开展。因此体积更小、重量更轻、更稳定、耐受性更高的光源将成为PDT光源研究的主要方向,如近年来备受青睐的LED光源。因此,在PDT治疗消化道肿瘤的发展中,从短期到中期,结合PDT和PDD引导下的肿瘤消融手术可能是很有前途的。长期来看,X光激活的PDT可能会突破治疗中肉眼难以发现的转移瘤的最终限制,这将进一步推动PDT治疗消化道肿瘤的临床应用。
