干出状态下坛紫菜叶状体表面水膜与失水对光合作用光化学特性的影响
2021-03-05蔡逸洵温嘉怡邹定辉
蔡逸洵, 温嘉怡, 邹定辉
华南理工大学环境与能源学院, 广东 广州 5100069
坛紫菜(Pyropia haitanensis)是我国南方海域最重要的一种栽培海藻种类, 具有极高的经济价值和生态价值。坛紫菜栽培常采用筏式吊养的方式, 随着潮汐涨落经历周期性的高潮浸没和低潮干出两种生活状态。低潮时, 坛紫菜的生活环境由水生转变为陆生, 暴露于空气中, 处于干出失水状态, 此时海藻的生长势必会面临许多不利因素如失水、高渗、强光等的胁迫 (Davison et al, 1996)。干出状态时, 藻体表面水分逐渐蒸发, 表面盐度显著增加, 并可能因此而遭遇高渗胁迫。此外, 浸没在淡水中的坛紫菜也会经历低渗的胁迫环境, 尤其是在夏天多雨的季节。
由于坛紫菜自身具有粘性和亲水性, 干出状态下海藻叶状体表面会覆盖一层水膜, 这层水膜因海面高湿度、海浪或叶状体相互重叠等因素而得到维持。但随着干出时间的延长, 水膜厚度会逐渐变薄, 直至消失, 随后藻体内部细胞开始失水。叶状体表面水膜在失水或处于其他外界环境过程中, 水膜海水的理化性质如 pH 值和盐度也将发生改变(Mercado et al, 2000; Zou et al, 2004b; Ji et al, 2016)。例如水膜失水变薄可能导致pH 值和盐度升高; 但如果在低潮干出状态下正好遇上下雨, 坛紫菜叶状体表面水膜的盐度则被稀释。
光合作用是潮间带大型海藻体内将光能转变成化学能的重要生理过程, 同时也是应对各种环境因子(如光、CO2、水分以及温度等)胁迫的重要机制(Pfannschmidt, 2003; Bräutigam et al, 2009)。与干出初始状态相比, 失水状态初期潮间带海藻表面的轻微脱水通常可增加光合速率, 然而随着藻体的进一步脱水, 光合速率转为下降(Madsen et al, 1990; Peña et al, 1999; Sampath-Wiley et al, 2008)。目前, 有关潮间带海藻在干出状态下的光合气体交换特性变化已经有很多的研究(Hodgson, 1981; Zou et al, 2002; Lü et al, 2011; Wang et al, 2018), 但关于坛紫菜在干出状态下的光合作用光化学特性还鲜有报道, 特别是叶状体表面水膜性质对光合作用的影响是一个值得探讨的问题。利用叶绿素荧光动力学技术可以测定海藻光合作用过程中光系统对光能的吸收、传递、耗散、分配等信息, 进而指示藻类光化学特性的变化(Schreiber, 2004)。因此, 本文通过测定叶绿素荧光动力学技术的相关指标(Fv/Fm、qP、NPQ、ETRm、α), 探讨坛紫菜叶状体表面不同理化性质的水膜在失水状态下对藻体光合作用的影响, 从而揭示坛紫菜在栽培生长过程中的光合特征。
1 实验方法
1.1 实验材料
本文实验材料采自广东省汕头市南澳岛深澳湾筏式吊养的坛紫菜。将采集的紫菜叶状体装在盛有少量海水的塑料袋中, 再置于5℃左右的低温箱中带回实验室。带回后, 首先将所采集的藻体样品用灭菌海水反复冲洗, 去除杂藻和有病害侵袭的藻体及其他附着物后, 暂养在培养箱内。实验室培养箱的温度为20℃, 光照强度为100µmol·m–2·s–1, 光暗周期比为12h:12h(每天光照时间为9:00—21:00); 培养液为过滤的自然海水, 每天24h 通气。暂养2d后的藻体样品将作为下一步实验的材料。
1.2 实验设计
1.2.1 藻体表面水膜理化特性处理
将培养后的健康藻体置于装有不同pH 值海水(pH 值分别为7.0、8.0、9.0)的锥形瓶内浸泡 2h, 其他条件与暂养时相同。取出浸泡后的藻体, 用吸水纸轻轻擦去表面水珠后平铺于干燥已灭菌的培养皿中, 于室温15℃、相对湿度约70%、光照强度约为20µmol·m–2·s–1的实验室内自然失水, 每隔1h 测定坛紫菜的重量和叶绿素荧光指数。每种pH 值处理的藻体重复3 次荧光指数测定。
同理, 将藻体置于装有不同盐度海水(盐度分别为0、25‰、33‰、50‰、75‰、100‰、125‰、150‰)的锥形瓶内浸泡2h。取出藻体并擦去水珠后, 进行与上述室内条件及步骤相同的干出处理和叶绿素荧光指数测定。每种盐度处理的藻体重复3 次荧光指数测定。
1.2.2 藻体叶绿素荧光指数测定及光合参数计算
坛紫菜叶绿素荧光动力学特性采用叶绿素荧光仪(Junior-PAM, 德国)测定。首先对经过上述不同方法处理后的坛紫菜进行15min 的暗处理, 打开测量光(约0.1µmol·m–2·s–1)测定各样品的最小荧光值Fo, 然后提供0.6s 约10000µmol·m–2·s–1的饱和脉冲光以测得该光化光强度下的最大荧光值Fm。之后每隔20s 照射一次饱和脉冲光, 为样品依次提供0~845µmol·m–2·s–1范围内共9 个不同梯度的光化光强度, 直到该光化光强度下的最大荧光值F'm达到稳定后, 得到叶绿素荧光诱导曲线(RLCs)。
各光合参数计算公式为: ①藻体的最大光化学效率Fv/Fm= (Fm-Fo)/Fm, 式中Fo 为最小荧光值, Fm 为最大荧光值; ②相对电子传递速率ETR=Y×PAR×0.5×0.84, 式中Y 是指实际量子产量, PAR 指光合有效辐射, 0.5 为光系统Ⅱ(PSⅡ)吸收的光量子所占比例(假设光系统吸收的光能平均分配于光系统Ⅰ和光系统Ⅱ之间), 0.84 为藻体的吸光系数, 即藻体光合色素吸收光量子的效率(Ralph et al, 2005); ③最大相对电子传递速率(ETRm)通过拟合公式ETR=ETRm×tanh(αI/ETRm )计算得出(Ralph et al, 2005), 式中α 为快速光响应曲线初始斜率, 反映了光合器官对光能的利用效率, I 为即时光强; ④光化学淬灭系数 qP=(F'm -Ft)/(F'm–F'o), 式中Ft 为实时荧光值; ⑤非光化学淬灭系数NPQ=(Fm-F'm)/F'm(Bilger et al,1990)。获得相关参数的光化光强度为95µmol·m–2·s–1(滕飞等, 2016)。
1.2.3 藻体表面水膜厚度和失水率计算
坛紫菜表面水膜厚度计算: 不同失水状态下的坛紫菜表面水膜厚度变化量Δh(单位: mm)可根据公式ΔW=ρSΔh 进行计算。公式中, ρ 为海水密度, 取1.025g·cm–3; S 为藻体表面积(单位: cm2); ΔW 为藻体湿重变化量(单位: g)。
藻体表面积S 采用扫描分析法测定: 取样后即用相机拍摄叶片, 同时用扫描仪扫描藻体以获得图像; 利用Photoshop 软件对获得的图像进行分析测算(姜真杰, 2017)。
藻体水分损失率(Percentage of water loss)的计算: 按公式WL(%)= (W0-Wt)/(W0-Wd)×100 计算。式中WL表示失水率(%), W0为初始湿重, Wt为经过一段失水时间后的质量; Wd为干重, 即完成水膜理化特性处理及荧光指数测定后于80℃烘箱中放置24h 后的质量。
1.3 统计与分析
实验所得数据采用SPSS 20.0 统计软件进行数据处理及统计分析, 并用One-way ANOVA 进行差异性分析(以P<0.05 为显著水平)。绘图使用的软件为Origin 8.0。
2 结果
2.1 坛紫菜表面水膜理化特性对光化学特性的影响
2.1.1 不同表面水膜pH 值对藻体光化学特性的影响
表面水膜pH 值由7.0 增加到9.0 的过程中, 坛紫菜的最大光化学效率Fv/Fm 和光化学淬灭系数qP 没有出现显著性变化(P>0.05)(图1a、1b); 非光化学淬灭系数NPQ 虽有上升趋势, 但未达到统计学意义上的显著性影响(P>0.05)。与表面水膜pH 值7.0相比, 表面水膜pH 值为8.0 和9.0 的坛紫菜的NPQ分别升高了19%和35%(图1c)。
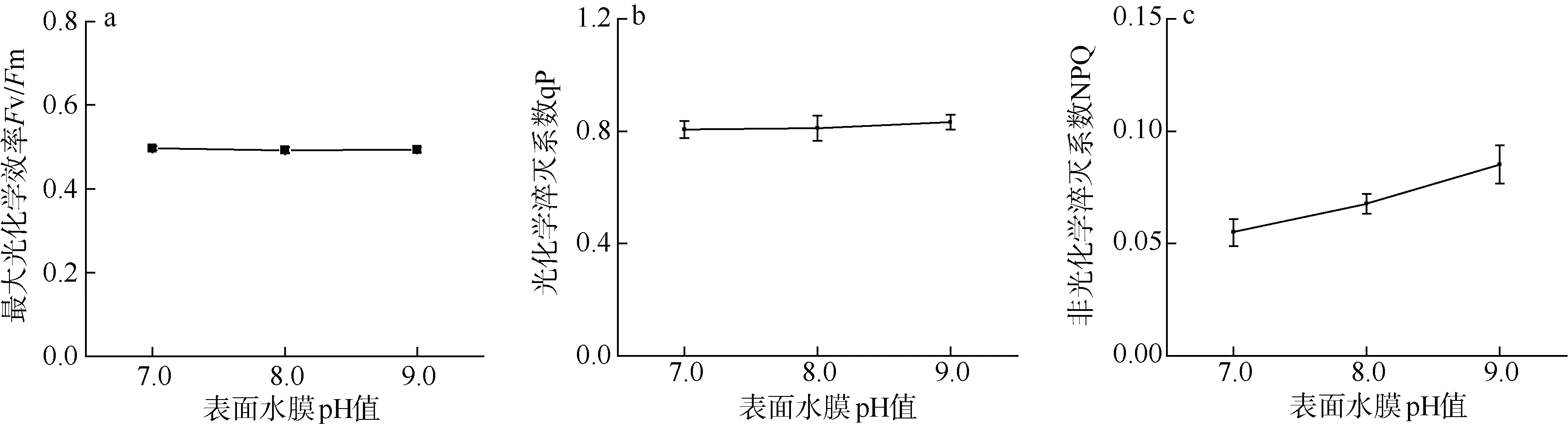
图1 不同表面水膜pH 值下坛紫菜最大光化学效率Fv/Fm (a)、光化学淬灭系数qP (b)和非光化学淬灭系数NPQ (c)的变化 Fig.1 Changes in the maximum quantum yield of Photosystem Ⅱ(a), photochemical quenching (b) and non-photochemical quenching (c) in different pH values of thallus surface water film under dehydration
根据图2 显示, 光能利用效率α 和最大相对电子传递速率ETRm 在坛紫菜表面水膜pH 值增加的情况下均未出现显著性差异(P>0.05)。其中, α 在表面水膜pH 值从7.0 增加到9.0 的过程中基本保持稳定(图2a); 与正常海水水膜相比, 表面水膜pH 值为9.0 的坛紫菜, 其ETRm 略微下降了13%(图2b)。
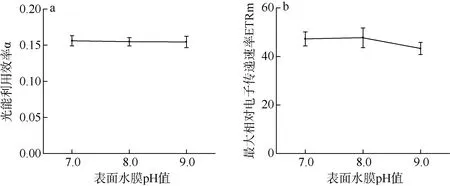
图2 不同表面水膜pH 值下坛紫菜光能利用率α(a)和最大相对电子传递速率ETRm(b)的变化 Fig.2 Changes in the rapid light curve-derived light use efficiency (a) and maximum relative electron transport rate (b) in different pH values of thallus surface water film
2.1.2 不同表面水膜盐度对藻体光化学特性的影响
由图3a 可知, 当坛紫菜表面水膜盐度不超过100‰时, Fv/Fm 随盐度的变化不明显(P>0.05); 但当盐度由100‰增加到150‰时, Fv/Fm 显著降低(P<0.05); 表面水膜盐度为125‰和150‰的坛紫菜, 其Fv/Fm 分别为0.33±0.07、0.15±0.07, 与水膜盐度为33‰时的Fv/Fm 相比, 分别下降了28%和66%。光化学淬灭系数qP 和非光化学淬灭系数NPQ 均随着水膜盐度的增加而逐步降低(P<0.05); 水膜盐度为150‰的坛紫菜, 其qP 和NPQ 分别是水膜盐度为33‰时的67%(图3b)和16%(图3c)。
坛紫菜光能利用率α 的变化与Fv/Fm 相似, 在水膜盐度高于100‰后开始大幅度下降(P<0.05); 水膜盐度为125‰和150‰的坛紫菜, 其光能利用率α分别为0.069±0.005 和0.039±0.004, 与水膜盐度为33‰的坛紫菜相比, 分别下降了46%和70%(图4a)。最大相对电子传递速率ETRm 在水膜盐度为0~50‰时无显著性差异, 之后随着盐度增加而开始显著降低(P<0.05); 水膜盐度为150‰的坛紫菜, 其ETRm降至水膜盐度为33‰时的40%(图4b)。
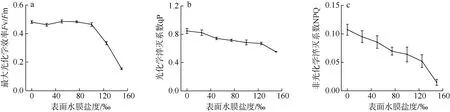
图3 不同表面水膜盐度下坛紫菜最大光化学效率Fv/Fm (a)、光化学淬灭系数qP (b)和非光化学淬灭系数NPQ (c)的变化 Fig.3 Changes in the maximum quantum yield of Photosystem Ⅱ(a), photochemical quenching (b) and non-photochemical quenching (c) in different salinity of thallus surface water film under dehydration
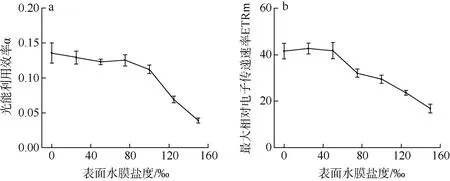
图4 不同表面水膜盐度下坛紫菜光能利用率α(a)和最大相对电子传递速率ETRm(b)的变化 Fig.4 Changes in the rapid light curve-derived light use efficiency (a) and maximum relative electron transport rate (b) in different salinity of thallus surface water film under dehydration
2.2 坛紫菜失水程度对光化学特性的影响
坛紫菜干出初期, 表面覆盖着一层水膜, 随着失水率的增加, 水膜的厚度近似地呈线性下降(R2=0.94, P=0.02)(图5)。
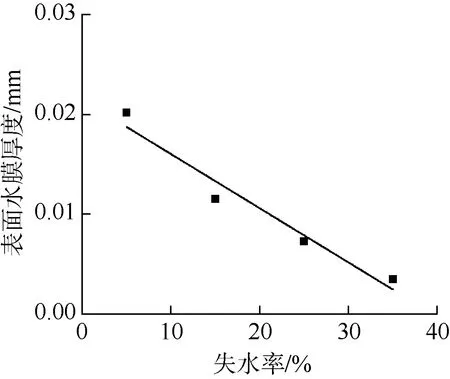
图5 干出状态下坛紫菜表面水膜厚度随失水率的变化 Fig.5 Changes of thallus surface water film thicknesses with percent water loss in Pyropia haitanensis under the emersed state
在表面水膜厚度减少(即失水)的整个过程中, Fv/Fm 基本保持稳定(图6a)。随着表面水膜的消失, qP 略有上升(图6b), NPQ 则在水膜厚度减少一半后开始下降。当水膜厚度接近于0 时, 与初始状态相比, NPQ 下降了60%(图6c), 而α 与ETRm 则略有上升趋势(图 7), 但未达到统计学上的显著水平(P>0.05)。
坛紫菜的干出失水过程可分为两个阶段: 表面水膜失水阶段和藻体内部失水阶段。由图8 可知, 在失水初期(失水率约为0~40%), Fv/Fm 基本保持稳定(P>0.05); 随失水率的增加, Fv/Fm 开始逐渐下降(P<0.05); 当失水率达到75%时, 与干出初始状态相比, Fv/Fm 下降了38%。在失水率为10%时, qP 与初始状态相比略微增加, 但未到达统计学上的显著水平(P>0.05); 在失水率由20%增加至40%期间, qP 逐渐下降, 之后保持稳定。NPQ 则随着失水率的增加而稳步下降, 当失水率达到75%时, 与干出初始状态相比, NPQ 下降了69%。
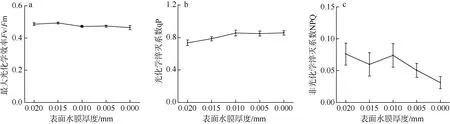
图6 不同水膜厚度下坛紫菜最大光化学效率Fv/Fm(a)、光化学淬灭系数qP(b)和非光化学淬灭系数NPQ(c)的变化 Fig.6 Changes in the maximum quantum yield of Photosystem Ⅱ(a), photochemical quenching (b) and non-photochemical quenching (c) in different thicknesses of thallus surface water film under dehydration
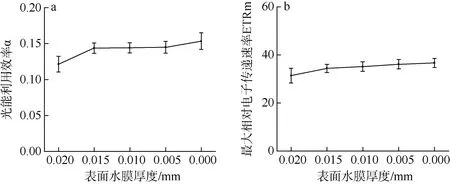
图7 不同水膜厚度下坛紫菜光能利用率α(a)和最大相对电子传递速率ETRm(b)的变化 Fig.7 Changes in the rapid light curve-derived light use efficiency (a) and maximum relative electron transport rate (b) in different thicknesses of thallus surface water film under dehydration.
根据图9 显示, 在初期的失水状态下, 坛紫菜的光能利用率α 变化不显著(P>0.05), 直到失水率超过60%时才开始逐渐下降(P<0.05)。当失水率达到75%时, 与干出初始状态相比, α 下降了41%(图9a)。ETRm 在失水率为10%时与初始状态相比略微增加 (P>0.05), 之后随着失水率的增加呈明显下降趋势(P<0.05); 当失水率达到75%时, 与干出初始状态相比, ETRm 下降了43%(图9b)。
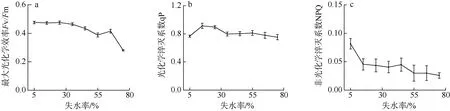
图8 不同失水率下坛紫菜最大光化学效率Fv/Fm(a)、光化学淬灭系数qP(b)和非光化学淬灭系数NPQ(c)的变化 Fig.8 Changes in the maximum quantum yield of Photosystem Ⅱ(a), photochemical quenching (b) and non-photochemical quenching (c) in thallus with increased water loss under dehydration
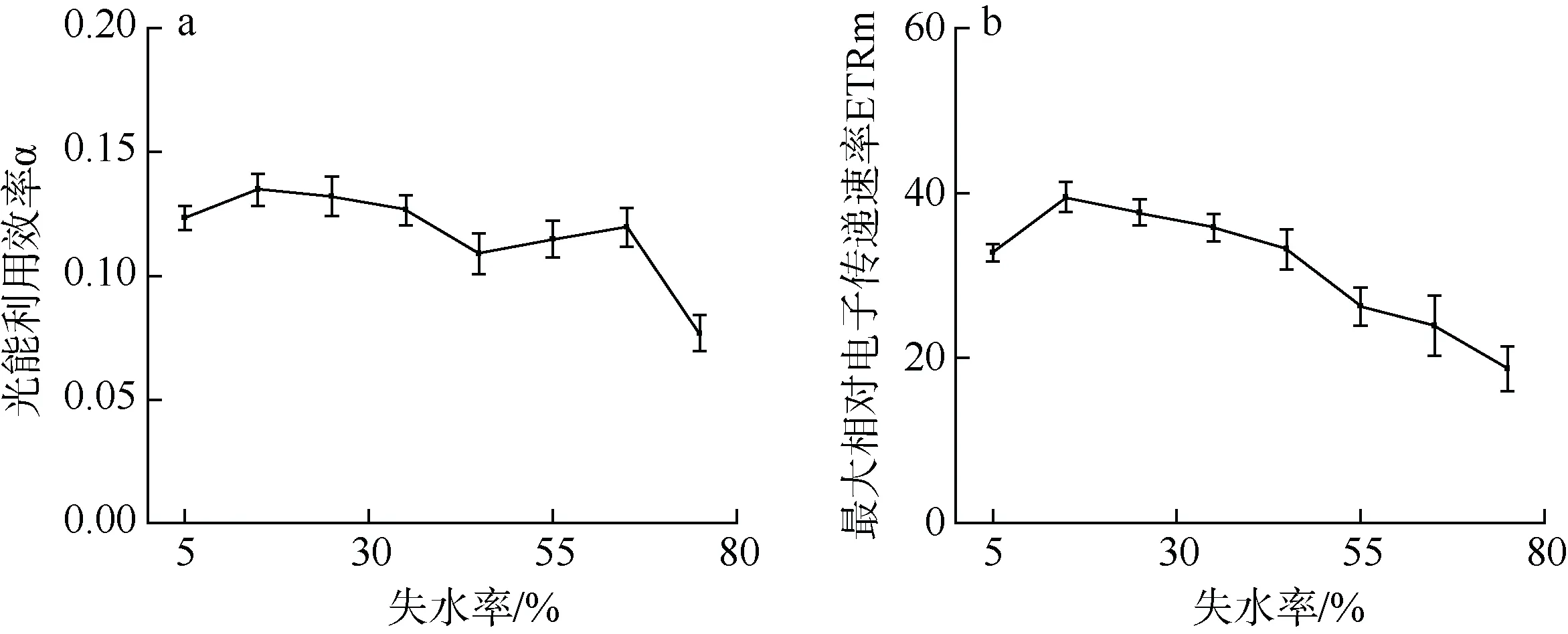
图9 不同失水率下坛紫菜光能利用率α(a)和最大相对电子传递速率ETRm(b)的变化 Fig.9 Changes in the rapid light curve-derived light use efficiency (a) and maximum relative electron transport rate (b) in thallus with increased water loss under dehydration
3 讨论与结论
植物发出的叶绿素荧光信号包含着丰富的光合信息, 这个特性非常容易受到外界环境条件的影响, 所以对荧光信号进行探测被认为是快速、灵敏和无损伤的研究植物光合作用的理想方式。坛紫菜由于其独特的潮间带生长环境, 经历着周期性的高低潮变化, 通过对环境的长期适应后, 藻体内已形成了各种响应机制来应对不同环境的变化, 包括对二氧化碳和光能的利用, 并形成相应的耐受性。
3.1 表面水膜pH 值对光合活性的影响
上述不同pH 值的藻体光化学特性测试结果表明, 干出初始状态下, 坛紫菜表面水膜pH 值变化并不会影响其光合活性。当叶状体表面水膜由中性变成碱性时, 光化学淬灭系数qP 和非光化学淬灭系数NPQ 略有上升(P>0.05), 其中NPQ 增加幅度较大; 光能利用效率α、最大光化学效率Fv/Fm 和最大相对电子传递速率ETRm 则保持稳定。干出状态下, 叶状体表面水膜中的高pH 值可促进空气中CO2在水膜上的溶解并转化为HCO3–, 提高藻体对CO2的吸收率(Haglund et al, 1992; Mercado et al, 2000; Zou et al, 2002; Zou and Gao, 2004a)。但藻体可能偏向于将光能分配于热耗散, 所以即使CO2吸收能力增加, 光合活性并没有随着表面水膜碱性的增加而有所提高。沉水状态下, 高pH 值的海水条件使得坛紫菜的光合作用和光保护活性受到抑制(Jiang et al, 2018), 这与干出状态所得结果不同, 说明不同环境状态下海水pH 值的变化对海藻的影响不同(Middelboe et al, 2007; Britton et al, 2016)。
3.2 表面水膜盐度对光合活性的影响
利用筏式吊养法进行人工栽培或是自然生长于潮间带的坛紫菜, 在低潮干出条件下, 藻叶状体表面水分逐渐蒸发, 甚至析出白色盐分, 表明盐度急剧升高, 藻体遭受高盐的渗透冲击; 若遇大雨, 则可能遭遇低盐胁迫。因此, 藻类通常可以通过合成或者运输有机渗透压调节物质(如多酚、脯氨酸和光合色素, 以及Na+/K+比等)来维持细胞内的水分和离子平衡, 以应对外界的盐度变化。
本文实验结果表明, 干出初始状态下坛紫菜叶状体表面水膜盐度的改变会对其光合活性产生一定的影响。在叶状体表面水膜盐度低于75‰时, 坛紫菜能维持正常的光合作用, 但表面水膜盐度超过75‰后, 它的光合活性开始显著下降, 体现为Fv/Fm、ETRm 和α 的下降; 同时, qP 和NPQ 随着表面水膜盐度的降低而下降的结果也表明藻体的热耗散和光能利用能力受到了影响。相较于正常海水盐度的水膜, 极高盐度的水膜对海藻光合作用的负面影响更大。这可能是由于极高盐度的海水水膜严重影响藻体的渗透压(Wang et al, 2019), 同时阻断QA到QB的电子传递, 形成较多的QB非还原性PSⅡ反应中心, 导致PSⅡ反应中心的放氧活性降低(Endo et al, 1995; Xia et al, 2004; Gong et al, 2008)。
3.3 表面水膜厚度及干出失水对光合活性的影响
由于海藻不像陆生高等植物那样具有可减小水分损失的气孔或蜡质角质层, 因此在干出状态下会出现失水的情况, 即水分从藻体表面水膜或细胞内散发到大气中(Kawamitsu et al, 2000)。随着裸露时间的增加, 失水程度会不断加剧。本文实验结果表明, 在干出轻微脱水状态(失水率低于40%)下, 坛紫菜的光合活性几乎不受影响, 这可能是由于轻微的脱水只涉及到藻体表面的水膜损失; 但随着失水的加剧, 脱水作用发生在藻体细胞内, 坛紫菜的光合活性受到了显著影响。这一实验结果与其他的潮间带海藻干出研究结果相似(Hodgson, 1981; Johnston et al, 1986; Lü et al, 2011; Wang et al, 2018)。轻微干出脱水阶段(失水率低于40%)为藻体表面水膜的失水阶段, 此时α 和ETRm 略有上升(P>0.05), 这可能是失水初始阶段较厚的表面水膜阻止了对大气中CO2的直接吸收利用; 而水膜变薄后则有利于空气中的CO2进入细胞, 提高PSⅡ的电子传递, 同时由于热耗散能力减弱, 光能更多地被分配于光合作用。适度的干出状态下, 坛紫菜叶状体表面水分的损失使得CO2扩散障碍减小, 提高了光合活性; 但是随着失水程度增加, 光合活性降低(Mercado et al, 2000; Zou et al, 2002)。红毛菜(Bangia fuscopurpurea)对干出的响应与坛紫菜相似, 随着干出时间的增加, 藻体的Fv/Fm和qP 先保持平稳后逐渐下降(Wang et al, 2018)。两者不同的是, 随着失水程度的增加, 红毛菜的NPQ 有所上升, 而坛紫菜的NPQ 却逐渐下降, 这表明坛紫菜的光保护能力对体内含水量更敏感。
坛紫菜各项荧光参数(Fv/Fm、qP、NPQ、ETRm和α)随表面水膜厚度减薄和体内细胞失水而显著下降的情况表明PSⅡ反应中心受到了胁迫, 对光能的 利用和分配能力产生作用, 从而影响坛紫菜在空气中的光合活性(张忠山 等, 2018)。当藻体严重失水时, 藻体细胞的内部结构会发生明显变化, 如细胞体积缩小和细胞壁增厚。细胞体积缩小可能是由于藻体自身含水量减少, 细胞壁增厚则是为了阻止藻体质膜的进一步外渗。严重失水可能还会导致藻体内部的部分细胞损坏失活, 引起藻体内酶活性下降以及电子在PSⅠ与PSⅡ间的传递, 进而影响光合能力(钱飞箭, 2014)。当藻体对光的收集和能量的利用与耗散不平衡时, 还会产生有毒的自由基, 造成氧化损伤。NPQ 下降的结果也表明, 随着失水的加剧, 藻体自身热耗散能力受到了影响, 无法消耗多余的光能, 从而引起藻体光损伤。
3.4 结论
综上所述, 干出初始状态下坛紫菜表面水膜pH值的改变不会影响其光合活性, 而高盐度表面水膜则会降低坛紫菜的光合活性。藻体的干出失水过程存在两个阶段, 初始阶段为藻体表面水膜厚度减薄阶段, 此时坛紫菜能维持正常的光合作用, 但随着失水的加剧, 光合活性受到影响。Fv/Fm 揭示了植物体对其生境光强密度长期适应的机制, 在极度胁迫时才会发生变化。本文实验结果也印证了这一点, 即坛紫菜在干出状态下对表面水膜特性的变化有较高的耐受性, 只有在极度胁迫下光合活性才会受到影响, 这也是其在经历长期干出后所形成的适应机制。
坛紫菜作为极具经济价值的大型海藻, 对潮间带的碳循环以及沿岸的生态环境均起着很大的作用, 因而也具有重要的生态意义。本文通过研究坛紫菜干出水膜特性及短期失水效应对其光合作用光化学特性的影响, 以了解潮间带海藻耐受干出脱水的保护和适应机制。但是, 对于藻体表面水膜在干出状态下所起的作用仍值得深入探讨, 下一步我们将探究不同水膜盐度或pH 值的坛紫菜随着干出时间的加剧, 其光合性能以及相关生化指标的变化, 从而增进对坛紫菜栽培生理生态学的认识。
