海水鱼蛭阿鲁加姆锡兰蛭(Zeylanicobdella arugamensis)的在体感染与生活史观察*
2021-03-05任宁欣史成银万晓媛谢国驷王仁宝王海波
任宁欣 史成银 万晓媛 谢国驷 王仁宝 王海波
海水鱼蛭阿鲁加姆锡兰蛭(Zeylanicobdella arugamensis)的在体感染与生活史观察*
任宁欣1,2史成银1①万晓媛1谢国驷1王仁宝1,2王海波1
(1. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071;2. 上海海洋大学水产与生命学院 上海 201306)
阿鲁加姆锡兰蛭()是重要的鱼类体外寄生虫,可感染30余种海水鱼类。阿鲁加姆锡兰蛭病在我国和东南亚多个国家的海水养殖鱼类中流行,严重时可导致鱼类大量死亡。为持续、稳定、足量地获得活体寄生虫,供防治鱼蛭病研究使用,本研究通过鱼蛭在体感染实验,建立了阿鲁加姆锡兰蛭的传代培养体系。研究结果证实,2种海水观赏鱼[棘颊雀鲷()和白条双锯鱼()]可作为宿主鱼,用于该鱼蛭的传代培养,且传9代后产生的子代仍具有很强的感染力。鱼蛭的生活史观察显示,该鱼蛭的生活史可分为卵茧孵化和幼蛭发育2个阶段。在水温为26℃、盐度为30的条件下,鱼蛭最短20 d即可完成其生活史。其中,卵茧孵化为幼蛭需要9 d,孵化率高达83.8%;幼蛭感染宿主、发育成熟并开始产卵茧最短需要11 d。本研究可为海水鱼蛭的生物学和鱼蛭病的防治研究提供技术支撑。
鱼蛭;在体感染;生活史;棘颊雀鲷;白条双锯鱼
鱼蛭是鱼类重要的体外寄生虫,通常寄生在鱼体表面,吸食鱼的血液,使宿主鱼营养不良、身体消瘦,产生体表创伤或溃疡,并造成继发感染(王永波等, 2018)。鱼蛭还可作为细菌、病毒、真菌和血液寄生虫的载体,传播鱼类疾病,具有较强的危害性(Cruz-Lacierda, 2000; Kua, 2009、2010; Hayes, 2006; Ahne, 1985; Mulcahy, 1990)。
海水鱼蛭阿鲁加姆锡兰蛭()隶属于环节动物门(Annelida)、蛭亚纲(Hirudinea)、蛭目(Hirudinida)、鱼蛭科(Piscicolidae)、锡兰蛭属(),最早由De Silva(1963)定种。阿鲁加姆锡兰蛭可感染多种海水鱼类,其引起的鱼蛭病在我国和东南亚的多个国家广泛流行并导致海水养殖鱼类的死亡。例如,2000年,在菲律宾养殖的点带石斑鱼()幼鱼和成鱼中,其流行率分别为83%和17%,且成鱼在感染3 d后死亡(Cruz-Lacierda, 2000)。2009年,在马来西亚某养殖场的尖吻鲈()幼鱼中,其流行率为100%,感染幼鱼的死亡率达60%(Kua, 2009)。2018~2019年,我们在中国、马来西亚和印度尼西亚养殖的豹纹鳃棘鲈()和红鳍笛鲷()鱼体上多次发现了阿鲁加姆锡兰蛭的感染和流行,危害较为严重。
国内外关于阿鲁加姆锡兰蛭的研究不多,主要集中在分类鉴定、宿主、生活史和药物防治等方面 (王永波等, 2018、2011; Cruz-Lacierda, 2000; Kua, 2010; Williams, 2006; Murwantoko, 2017; Ravi, 2017)。文献已报道的阿鲁加姆锡兰蛭宿主鱼类有33种,包括豹纹鳃棘鲈、斜带石斑鱼()、鞍带石斑鱼()、紫红笛鲷()、军曹鱼()等(王永波等, 2018; Kua, 2010; Nagasawa, 2012)。阿鲁加姆锡兰蛭属于专性寄生类型,幼蛭感染宿主鱼后,会一直留在鱼体上吸血,成熟后离开宿主鱼产卵茧,产卵茧后不再感染宿主鱼并衰老死亡。Kua等(2010)和Murwantoko等(2017)研究发现,阿鲁加姆锡兰蛭生活史比较简单,包含卵茧孵化和幼蛭发育2个阶段;在27℃和24℃~25℃时,阿鲁加姆锡兰蛭卵茧孵化分别需要7 d和12 d。国内对阿鲁加姆锡兰蛭的研究很少,仅有王永波等(2018)对阿鲁加姆锡兰蛭开展过种类鉴定、宿主和寄生偏好等研究,发现在常见的5种石斑鱼中,豹纹鳃棘鲈是该鱼蛭最喜好寄生的宿主。
棘颊雀鲷()和白条双锯鱼()是雀鲷科(Pomacentridae)常见的2种海水观赏鱼类,最适养殖水温为26℃,盐度为30。棘颊雀鲷俗称透红小丑鱼,体型小。白条双锯鱼俗称番茄小丑鱼,体型比棘颊雀鲷稍大(张薇等, 2018)。棘颊雀鲷和白条双锯鱼都具有体型小、容易在实验室内养殖,体色鲜艳、易于实验观察等优点。目前,尚未有阿鲁加姆锡兰蛭感染棘颊雀鲷和白条双锯鱼的报道。鉴于这2种观赏鱼与阿鲁加姆锡兰蛭生活的最适水温和盐度相近,本研究选择棘颊雀鲷和白条双锯鱼作为宿主鱼开展了阿鲁加姆锡兰蛭的在体感染和传代实验,并对传代培养鱼蛭的生活史进行了观察和分析,以期为海水鱼蛭病的病原、病理、致病机制、检测与防治研究提供生物材料和技术支撑。
1 材料与方法
1.1 实验材料
在患病的豹纹鳃棘鲈鳍条上采集数十尾活鱼蛭,带回实验室供研究使用。棘颊雀鲷(全长为40~45 mm,体重为2.0~2.5 g)和白条双锯鱼(全长为70~75 mm,体重为9.0~11.0 g),均由中国水产科学院黄海水产研究所提供。
1.2 实验方法
1.2.1 阿鲁加姆锡兰蛭的在体感染和传代培养 将棘颊雀鲷和白条双锯鱼分别养殖于不同的塑料水族箱(0.8 m × 0.6 m × 0.4 m)或2 L的玻璃烧杯中,水温为26℃,盐度为30。每天换1/3海水,投喂1次。将采集的成熟鱼蛭转移至12孔细胞培养板中,1条/孔,各孔中含2 ml无菌过滤海水,于26℃恒温培养箱中培养,每2 d换1/2海水。待鱼蛭产出卵茧后,计数卵茧数量,测量卵茧大小,观察其孵化情况。待卵茧孵出幼蛭后,在解剖镜下将幼蛭转移至水族箱或玻璃烧杯中,使其自然感染棘颊雀鲷和白条双锯鱼,并发育成熟。幼蛭成熟后,即体长>10 mm并从鱼体脱落时,将脱落的成熟鱼蛭转移到新的12孔细胞培养板中,26℃恒温培养。重复上述操作,建立鱼蛭阿鲁加姆锡兰蛭的在体感染和传代培养体系。
1.2.2 阿鲁加姆锡兰蛭卵茧的孵化 取从鱼体脱落的尚未产卵茧的成熟鱼蛭(静止时体长为11~14 mm),置于含2 ml无菌海水的12孔细胞培养板中,海水水温为26℃、盐度为30。待鱼蛭产出卵茧后,每隔2~ 24 h在倒置显微镜(Optec BDS 300PH)下观察、记录并拍照卵茧的发育情况,直至孵出幼蛭。
1.2.3 阿鲁加姆锡兰蛭幼蛭的发育 在含1.5 L无菌海水的2 L玻璃烧杯中,分别放入2尾健康的棘颊雀鲷或1尾白条双锯鱼,于26℃恒温培养箱中培养。将刚孵出的30条幼蛭转移至上述含棘颊雀鲷或白条双锯鱼的烧杯中,每个烧杯10尾。每天观察幼蛭的发育情况,记录并拍照。实验期间保持养殖海水水温为26℃、盐度为30。每天换1/3海水,投喂1次。
2 结果
2.1 阿鲁加姆锡兰蛭的在体感染和传代培养
在水温为26℃、盐度为30的条件下,12孔细胞培养板中的16条鱼蛭共产卵茧259个。随机测量了50枚卵茧,大小为0.53~0.77 mm,平均大小为(0.66±0.06) mm。每个卵茧内只有1个受精卵,可孵出1条幼蛭。9 d后,259个卵茧共孵出幼蛭217条,中途停止发育或不发育的卵茧42个,孵化率为83.8%。
从孵出的幼蛭中随机挑取30条,每10条为1组,共3组,放入饲养有2尾棘颊雀鲷的烧杯中,使其自然感染棘颊雀鲷。1 d后,3组幼蛭均成功感染,开始营寄生生活,并逐渐长大。感染11 d后,鱼蛭发育成熟、脱离鱼体,开始产卵茧。30条成熟鱼蛭,平均每条产卵茧14.1枚。鱼蛭产茧集中在脱离鱼体后的前4 d,之后一般不再产茧。目前,在实验室内已传代培养阿鲁加姆锡兰蛭9代,新产生的幼蛭仍具有很强的感染力,可长期、稳定地获得鱼蛭和卵茧。使用孵出的幼蛭感染白条双锯鱼,也取得了类似的结果。
2.2 阿鲁加姆锡兰蛭的生活史
2.2.1 鱼蛭卵茧的发育 刚刚产出的卵茧呈黄棕色,最外圈是黏液层,将卵茧牢牢地附着在细胞培养板底壁或侧壁上。阿鲁加姆锡兰蛭的卵茧为头盔状,一端稍尖,另一端钝圆,直径约为0.7 mm。卵茧底部由1个椭圆形平板封闭,其中稍尖端有1个小圆栓,钝圆端有1个大圆栓。受精卵位于2个圆栓之间,浮在蛋白营养液里。新生卵茧内部有很多黑色的长丝状结构,遮住了受精卵和圆栓(图1a)。2 h左右长丝状结构消失(图1b)。卵茧发育的前36 h胚胎体积增加较缓慢(图1c、图1d)。48 h时,胚胎体积急剧增大,可观察到明显的大幅度收缩和扩张(图1e),72 h时,胚胎几乎充满整个卵茧(图1f);96 h时,胚胎最外层出现神经索(图1g),120 h后出现长吻(图1h)。144 h时,继续变长,接近圆柱形,眼点等各部分器官逐渐发育完全,表面体环越来越均匀密集,体色不断加深,此时幼蛭非常活跃,等待脱茧而出(图1j、图1k)。幼蛭脱茧时,先用头部顶开大圆栓,然后,前吸盘带着身体钻出。由于后吸盘较大,会卡在圆栓开口位置。此时,卵茧仍然附着在细胞培养板壁上,幼蛭用前吸盘吸附在另一处壁上,轻松地将后吸盘拉出。216 h后,幼蛭完全脱离卵茧,仅剩下卵茧空壳(图1l)。在海水水温为26℃、盐度为30的条件下,鱼蛭卵茧正常发育为自由游动的幼蛭通常需要9 d。
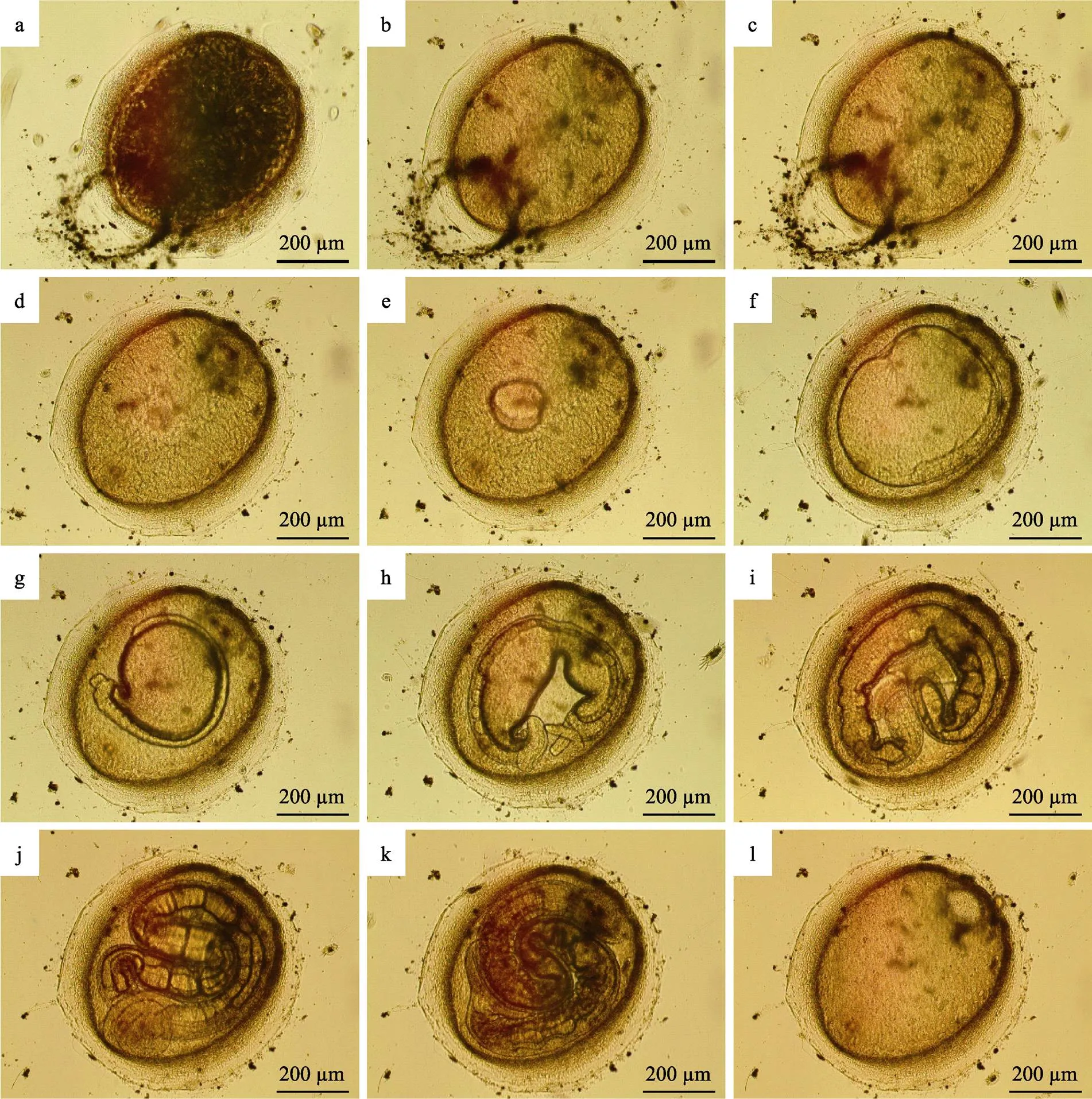
图1 阿鲁加姆锡兰蛭卵茧的发育
a: 0 h; b: 2 h; c: 12 h; d: 36 h; e: 48 h; f: 72 h; g: 96 h; h: 120 h; i: 144 h; j: 168 h; k: 192 h; l: 216 h
新生卵茧如果因各种原因无法固着,便会随水漂流。漂流的卵茧周围水环境条件不稳定,孵化率明显降低。少量的漂流卵茧虽然可孵化成幼蛭,但幼蛭脱茧时后吸盘常常被卡在卵茧中无法出来。此时,可见幼蛭将前吸盘吸附在壁上,用身体后部狂甩卵茧试图脱茧。但由于卵茧不固定,脱茧成功率通常不高。无法成功脱茧的幼蛭,运动和感染能力都受到很大影响,很快便会死亡。
初孵幼蛭身体呈半透明的圆柱状,有前后2个吸盘(图2a)。前吸盘背面有1对黑色的三角形眼点 (图2b),颈部有长吻(图2c)。经测量,初孵幼蛭静止时体长为(1.28±0.08) mm,宽度为(0.12±0.01) mm (=50)。幼蛭孵出后,如未能感染宿主鱼,则身体不会长大、且在5~8 d后死亡。
2.2.2 幼蛭的发育与成熟 阿鲁加姆锡兰蛭主要寄生在棘颊雀鲷的鳍基部和眼睛等部位。1 d后,幼蛭由于吸食宿主鱼的血液身体变为黑色,体长约为2.2 mm,身体变粗(图3a)。幼蛭成熟前以每天1 mm以上的速度迅速生长,11 d后,鱼蛭体长达13 mm并脱离鱼体开始产卵茧(图3b)。在水温为26℃、盐度为30的条件下,初孵幼蛭从感染宿主鱼到自然成熟产茧需要11 d。鱼蛭体长达10 mm为已发育成熟,但如果不脱离鱼体将不会产茧。此时,如果将鱼蛭自鱼体强行分离出来,置于细胞培养板中,在26℃、盐度30的条件下培养,鱼蛭会自然产茧。产过茧的鱼蛭不再感染宿主鱼,而进入衰老期,表现为鱼蛭体表花纹变得不清晰,身体慢慢缩短、膨胀,活力下降,运动能力变差。鱼蛭脱离鱼体9 d后,仅为原体长的1/2,且后吸盘边缘有缺口,身体出现坏死部位,轮廓模糊,10 d后死亡。

图2 阿鲁加姆锡兰蛭初孵幼蛭
a:幼蛭;b和c:前吸盘,眼点(实线箭头)和长吻(虚线箭头)
a: Juvenile; b and c: Anterior sucker, eyespot (solid arrow) and proboscis (dotted arrow)
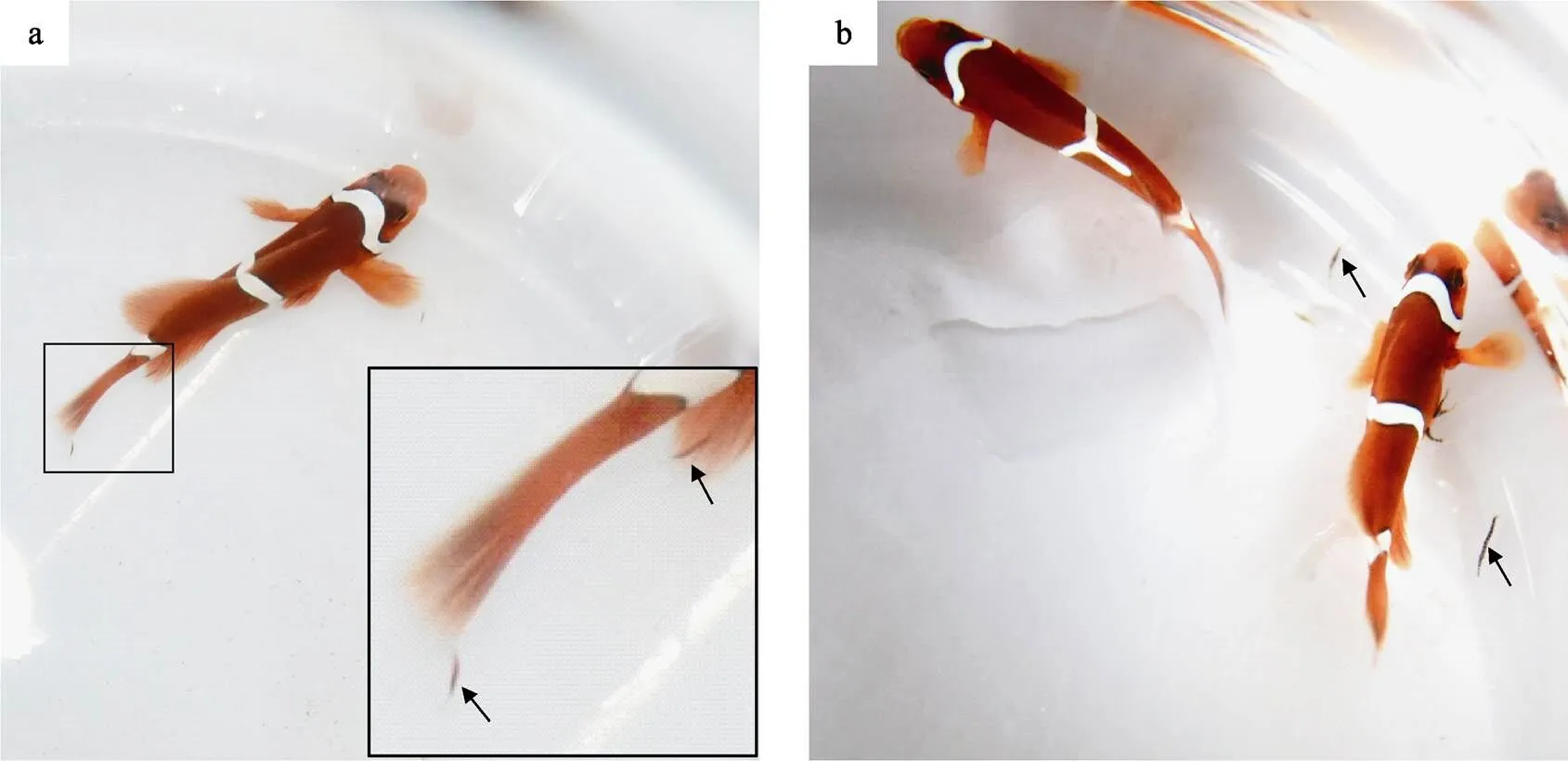
图3 阿鲁加姆锡兰蛭幼蛭感染棘颊雀鲷
a:感染1 d后;b:感染11 d后。箭头所示为鱼蛭
a: 1 day after infestation; b: 11 days after infestation. Arrows indicate
综上所述,在水温为26℃、盐度为30的条件下,使用棘颊雀鲷或白条双锯鱼在体感染和传代培养阿鲁加姆锡兰蛭,鱼蛭从卵茧孵化为幼蛭需9 d,幼蛭发育为成蛭并产卵茧最短需要11 d,即最短20 d即可得到新一代鱼蛭。阿鲁加姆锡兰蛭的生活史示意图见图4。

图4 阿鲁加姆锡兰蛭的生活史
3 讨论
阿鲁加姆锡兰蛭尚无正式的中文学名,不利于该病原的研究和交流。有学者将其种名和属名分别翻译为菲律宾蛭和石斑蛭属(王永波等, 2018),但其依据不明,本研究认为不妥。作者分析发现,该鱼蛭最早由De Silva(1963)发现并定种为。其属名由-和-连接而成。其中是荷兰语词根“锡兰的”;是拉丁语“水蛭”。因此,可以翻译为“锡兰蛭”。该鱼蛭的种加词由和拉丁语后缀-组成。其中是该鱼蛭的发现地点泻湖,其规范的中文名称为“阿鲁加姆”;拉丁语后缀-是地名后缀,即“某地的(蛭)”。因此,可以翻译为“阿鲁加姆(蛭)”。基于上述词源分析,作者建议将海水鱼蛭的中文属名定为“锡兰蛭属”,中文种名定为“阿鲁加姆锡兰蛭”(任宁欣, 2020)。
鱼类寄生虫的传代培养对于寄生虫的防治研究具有重要意义(Murwantoko, 2017; 王永波等, 2011; 刘婷婷等, 2015; 姚嘉赟等, 2019),目前尚未有阿鲁加姆锡兰蛭传代培养的报道。本研究建立了以棘颊雀鲷和白条双锯鱼为宿主鱼的阿鲁加姆锡兰蛭在体感染和传代培养体系,传了9代后产生的子代鱼蛭仍具有很强的感染力。鉴于棘颊雀鲷和白条双锯鱼易于在实验室内养殖和观察,本研究建立的阿鲁加姆锡兰蛭传代培养体系可长期、稳定地提供鱼蛭和卵茧供相关研究使用,具有较强的应用价值。
自然环境下,不同种类的鱼蛭喜好的产卵茧地点可能会不同,如鱼蛭将卵茧产在十足目甲壳动物和海蜘蛛的腿或甲壳上,以便传播散布(Khan, 1995、1976; Sloan, 1984)。调查显示,阿鲁加姆锡兰蛭通常将卵茧产在较硬的基质上面,比如水泥养殖池壁或水管壁上。本研究观察到阿鲁加姆锡兰蛭的卵茧表面有一层粘液层,与Kua等(2010)的报道一致。利用这个黏液层,阿鲁加姆锡兰蛭卵茧可牢固地附着在水族箱壁、烧杯壁或者细胞培养板壁上。本研究发现,这种牢固附着对阿鲁加姆锡兰蛭卵茧的孵化和幼蛭的顺利脱茧都十分重要。不能固着的漂流卵茧孵化率低,孵化出的幼蛭脱茧率低、死亡率高。这提示今后可通过深入研究阿鲁加姆锡兰蛭卵茧的附着机制,开发能有效降低卵茧附着率的技术和产品,从而控制虫口密度,防治鱼蛭病。
水温和盐度是影响阿鲁加姆锡兰蛭卵茧孵化和发育的关键因素(Kua, 2010, 2014; Murwantoko, 2017)。本研究发现,在水温为26℃、盐度为30的条件下,阿鲁加姆锡兰蛭的卵茧需要9 d孵出幼蛭;幼蛭感染棘颊雀鲷或白条双锯鱼后,需要11 d才能发育成熟、产下卵茧。即在上述条件下,阿鲁加姆锡兰蛭完成整个生活史需要20 d。这与此前的研究报道均有不同。Kua等(2010)报道,在27℃、盐度为28的条件下,以尖吻鲈为宿主鱼时,阿鲁加姆锡兰蛭卵茧孵化和幼蛭发育的时间分别为7 d和9~10 d,完成整个生活史需要16~17 d。Murwantoko等(2017)在25℃、盐度为34的条件下以杂交石斑鱼(sp.)为宿主鱼,卵茧孵化和幼蛭成熟分别需要12 d和9 d,共需要21 d。作者认为,上述阿鲁加姆锡兰蛭在卵茧孵化和幼蛭发育时长上的差异,主要与水温和盐度条件相关,与宿主鱼种类可能也有一定的关系。文献报道,在水温为26℃~27℃、盐度为28的实验室条件下,阿鲁加姆锡兰蛭的卵茧孵化率介于46.8%~88.1%之间,平均值为69.9%。卵茧孵化的最适水温为25℃~27℃,最适盐度为28~30。水温、盐度过高或过低,均会显著降低卵茧孵化率,并缩短幼蛭和成蛭的存活时间(Kua, 2014)。本研究在水温为26℃、盐度为30的条件下,得到阿鲁加姆锡兰蛭的卵茧孵化率为83.7%,与上述研究结果基本一致。当然,在鱼蛭卵茧孵化和幼蛭发育的影响因素方面还需要更深入的研究。
致谢:本研究用于鱼蛭在体感染的棘颊雀鲷和白条双锯鱼由中国水产科学研究院黄海水产研究所 马爱军和孙志宾老师惠赠,特此致谢。
Ahne W.L. andL. as mechanical vectors of spring viraemia of carp virus (SVCV). Journal of Fish Diseases, 1985, 8(2): 241–242
Cruz-Lacierda ER, Toledo JD, Tan-Fermin JD,Marine leech () infestation in cultured orange-spotted grouper,. Aquaculture, 2000, 185(3–4): 191–196
De Silva PHDH.gen.nov. and sp.nov. from Arugam Kalapu, Eastern Province, Ceylon. Spolia Zeylanica, 1963, 30: 47–53
Hayes PM, Smit NJ, Seddon AM,A new fish haemogregarine from South Africa and its suspected dual transmission with trypanosomes by a marine leech. Folia Parasitologica, 2006, 53(4): 241–248
Khan RA, Meyer MC. Taxonomy and biology of some Newfoundland marine leeches (Rhynchobdellae: Piscicolidae). Journal of the Fisheries Research Board of Canada, 1976, 33(8): 1699–1714
Khan RA, Paul AJ. Life cycle studies on arcto-boreal leeches (Hirudinea). Journal of the Helminthological Society of Washington, 1995, 62(2): 105–110
Kua BC, Azmi MA, Hamid NKA. Life cycle of the marine leech () isolated from sea bass () under laboratory conditions. Aquaculture, 2010, 302(3–4): 153–157
Kua BC, Choong FC, Leaw YY. Effect of salinity and temperature on marine leech,(De Silva) under laboratory conditions. Journal of Fish Diseases, 2014, 37(3): 201–207
Kua BC, Eugene MB, Oo MG. Morphology of haematophagous marine leech () isolated from body of sea bass () fingerlings. Malaysian Fisheries Journal, 2009, 8(1): 17–21
Liu TT, Tang XQ, Zhou L. The pesticidal effects of Chinese herbal medicine on the trophonts and the theronts of ciliateand the influence of temperature and salinity on the cyst rupture. Progress in Fishery Sciences, 2015, 36(6): 113–120 [刘婷婷, 唐小千, 周丽. 15种中草药对刺激隐核虫()的杀灭效果及包囊破裂的条件. 渔业科学进展, 2015, 36(6): 113–120]
Mulcahy D, Klaybor D, Batts WN. Isolation of infectious hematopoietic necrosis virus from a leech () and a copepod (sp), ectoparasites of sockeye salmon. Diseases of Aquatic Organisms, 1990, 8(1): 29–34
Murwantoko, Negoro SLC, Isnansetyo ALife cycle of marine leech from cultured “” hybrid grouper (sp) and their susceptibility against chemicals. Aquacultura Indonesiana, 2017, 18(2): 72–76
Nagasawa K, Shimadzu N, Ikeda Y. Four new host records for the fish leech(Hirudinida: Piscicolidae), with an updated host list (1963–2012). Biogeography, 2012, 14: 143–146
Ravi R, Yahaya ZS., the marine leech from cultured crimson snapper (), Jerejak Island, Penang, Malaysia. Asian Pacific Journal of Tropical Biomedicine, 2017, 7(5): 473–477
Ren NX. Study on biological characteristics and detection method of the marine leech. Master´s Thesis of Shanghai Ocean University, 2020 [任宁欣. 海水鱼蛭阿鲁加姆锡兰蛭()的生物学特性与检测技术研究. 上海海洋大学硕士研究生学位论文, 2020]
Sloan NA, Bower SM, Robinson SMC. Cocoon deposition on three crab species and fish parasitism by the leechfrom deep fjords in northern British Columbia. Marine Ecology Progress Series, 1984, 20(1–2): 51–58
Wang YB, Fu SY, Li BS,. Prevention and control of the leech from grouper in farm environment. Journal of South China University of Tropical Agriculture, 2011, 2(1): 59–62 [王永波, 符书源, 李丙顺, 等. 池塘养殖石斑鱼鱼蛭病防治实验. 热带生物学报, 2011, 2(1): 59–62]
Wang YB, Liu JY, Chen FX,. LeechParasitic of grouper culture in Hainan. Natural Science Journal of Hainan University, 2018, 36(3): 262–270 [王永波, 刘金叶, 陈傅晓, 等. 对海南地区石斑鱼养殖中鱼蛭病的初步研究. 海南大学学报(自然科学版), 2018, 36(3): 262–270]
Williams JI, Burreson EM. Phylogeny of the fish leeches (Oligochaeta, Hirudinida, Piscicolidae) based on nuclear and mitochondrial genes and morphology. Zoologica Scripta, 2006, 35(6): 627–639
Yao JY, Xu Y, Yuan XM,. Synthesis of 1-methyl-1,2,3,4- tetrahydroisoquinoline derivatives and its antiparasitic activity against. Progress in Fishery Sciences, 2019, 40(1): 141–146 [姚嘉赟, 徐洋, 袁雪梅, 等. 四氢异喹啉衍生物的合成及体外抗多子小瓜虫活性的研究. 渔业科学进展, 2019, 40(1): 141–146]
Zhang W, Sun ZB, Ma AJ,. Studies on comparative embryology and discussion of evolutiology in four varieties of amphiprion. Oceanologia et Limnologia Sinica, 2018, 49(3): 671–681 [张薇, 孙志宾, 马爱军, 等. 双锯鱼属()四种鱼种比较胚胎学研究和进化探讨. 海洋与湖沼, 2018, 49(3): 671–681]
Infestation and Life Cycle Observation of Marine Leech
REN Ningxin1,2, SHI Chengyin1①, WAN Xiaoyuan1, XIE Guosi1, WANG Renbao1,2, WANG Haibo1
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao); Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity, Qingdao 266071; 2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306)
is an important ectoparasitic leech that can infest more than 30 species of marine fish.Diseases associated withare prevalent in China and many countries of Southeast Asia, and frequently cause the death of cultured marine fishes. In order to continually and steadily provide sufficient live leeches and cocoons for the research of the prevention and treatment of, this study established a propagation method forthroughinfestation experiments, and proved that two ornamental fish species, spinecheek anemonefish () and tomato anemonefish (), were suitable for use as fish hosts. The parasite descendants generated by thepropagation method are still very transmittable after nine generations. This study also used micrography to observe cocoons and the life cycle of propagated fish leeches. The results showed that the average cocoon size ofwas (0.66±0.06) mm, and there was only one fertilized egg in each cocoon. The life cycle ofcan be divided into two stages: The cocoon hatching stage and the juvenile development stage. Under a seawater temperature of 26℃ and salinity of 30,can complete its life cycle in as short as 20 days. The cocoons ofdeveloped into juvenile leeches in nine days, with a hatching rate as high as 83.8%. The juvenile leeches subsequently infected the host fish, grew to mature adults, and produced new cocoons in 11 days. This article confirmed for the first time that.and.were both susceptible hosts for. This study not only established anpropagation method for, but also provided technical support for research on the pathogen, pathology, pathogenic mechanism, detection, and prevention of leech diseases related to.
Fish leech ();Infestation; Life cycle; Spinecheek anemonefish (); Tomato anemonefish ()
SHI Chengyin, E-mail: shicy@ysfri.ac.cn
S941.54
A
2095-9869(2021)02-0155-07
10.19663/j.issn2095-9869.20200115003
http://www.yykxjz.cn/
任宁欣, 史成银, 万晓媛, 谢国驷, 王仁宝, 王海波. 海水鱼蛭阿鲁加姆锡兰蛭()的在体感染与生活史观察. 渔业科学进展, 2021, 42(2): 155–161
Ren NX, Shi CY, Wan XY, Xie GS, Wang RB, Wang HB.infestation and life cycle observation of marine leech. Progress in Fishery Sciences, 2021, 42(2): 155–161
* 农业国际交流与合作项目和国家重点研发计划课题(2018YFD0900301)共同资助 [This work was supported by Projects of International Exchange and Cooperation in Agriculture, Ministry of Agriculture and Rural Affairs, and National Key R&D Program of China (2018YFD0900301)]. 任宁欣,E-mail: rnxqz7@163.com
史成银,研究员,E-mail: shicy@ysfri.ac.cn
2020-01-15,
2020-02-21
(编辑 马璀艳)
