转化糖电解质注射液中果糖与无水葡萄糖含量测定方法的研究
2021-03-05石妍
石 妍
(内蒙古科技大学包头医学院第一附属医院,内蒙古 包头 014000)
转化糖电解质注射液为含多种糖的糖电解质输液剂,具有提供能量迅速,血糖波动小,供能持续时间长的特点。同时,电解质与转化糖具有协同效应。含维持性电解质消除了转化糖被代谢后血浆渗透压过分下降的风险;含转化糖保证了电解质在输注后的细胞内外离子转运中需要的能量支持。可以全面补充电解质,既可补充细胞内液亦可补充细胞外液,所含缓冲盐很好地维持了人体的酸碱平衡,真正做到了调节人体代谢紊乱。
转化糖在人体内的代谢包括果糖代谢和葡萄糖代谢两部分。葡萄糖与果糖的混合物在人体内的代谢具有以下三大优势:1、迅速启动代谢通路。果糖入血后迅速启动肝脏代谢通路,在自身代谢的同时,也加快了葡萄糖代谢,而葡萄糖则直接进入细胞,两者相加, 使机体能量在短时间内得以提高。2、绕过胰岛素抵抗环节。葡萄糖大量、短时输注,使血中胰岛素急剧升高,而有些患者存在胰岛素抵抗,使葡萄糖不能有效代谢,反而造成血糖剧烈波动及高渗性的水、电解质丢失。果糖代谢通路不受胰岛素影响,绕过了胰岛素抵抗环节,从而有效提供能量。3、形成血糖缓释库。转化糖中的葡萄糖可迅速改善机体的血糖平衡,而果糖进入人体后,除提供能量外,还能转化为糖原储存,成为血糖缓释库,并以缓慢速度释放以保证血糖的稳定。
转化糖电解质注射液共两个规格。为500mL:果糖12.5g与葡萄糖12.5g与乳酸钠1.4008g与氯化钠0.7305g与氯化钾0.9319g与氯化镁0.1428g与磷酸二氢钠0.3750g与亚硫酸氢钠0.2602g。250mL:果糖6.25g与葡萄糖6.25g与乳酸钠0.7004g与氯化钠0.3652g与氯化钾0.4660g与氯化镁0.0714g与磷酸二氢钠0.1875g与亚硫酸氢钠0.1301g。
本品处方中果糖和无水葡萄糖作为能量补充剂,起到重要作用,需要对果糖和无水葡萄糖进行质量控制以确保本品用药的有效性。转化糖含量测定方法主要有氧化还原反应后称重法、旋光法等,本品为等量的果糖与无水葡萄糖及氯化钠、氯化钾、氯化镁、磷酸二氢钠与乳酸钠的灭菌水溶液,使用称重法和旋光法测定的专属性、灵敏度均较差。为了能准确测定果糖和无水葡萄糖含量,本研究选择专属性强、灵敏度高的高效液相色谱法直接对果糖和无水葡萄糖进行测定。
1 材料与方法
1.1 仪器与物料
仪器:LC-20AT型高效液相色谱仪,日本岛津公司。
对照品:D-无水葡萄糖对照品,中国食品药品检定研究所;果糖对照品,中国食品药品检定研究所。
供试品:转化糖电解质注射液(批号:20130101),北京京卫信康医药科技发展有限公司;转化糖电解质注射液(批号:130301~130303),内蒙古白医制药股份有限公司。
1.2 实验方法
1.2.1色谱条件选择
果糖和无水葡萄糖没有紫外吸收官能团,参考文献[1]采用示差折光检测器,对本品中果糖和无水葡萄糖同时进行测定。因果糖和无水葡萄糖均为小分子单糖,极性大,参考文献[1],以水为流动相,Xitmate Sugar-Ca柱即钙型阳离子交换柱为色谱柱(适用于单糖和双糖等低分子量糖的测定)。
色谱柱:磺酸基强阳离子交换树脂Ca型(Xtimate Sugar-Ca,7.8×300mm,5μm)
检测器:示差折光检测器
柱温:80℃
流动相:水
进样量:10μL
流速:0.3mL/min
运行时间:35分钟
1.2.2对照品溶液的配制
取果糖与无水葡萄糖对照品各约25mg,精密称定,置1mL量瓶中,加水溶解并稀释至刻度,摇匀,制成每1mL 中含果糖和无水葡萄糖分别为25mg 的溶液,即得。
1.2.3系统适用性试验溶液的配制
取果糖与无水葡萄糖各约25mg,精密称定,置1mL量瓶中,加水溶解并稀释至刻度,摇匀,作为系统适用性试验溶液。
1.2.4系统适用性试验
取系统适用性试验溶液10μL,注入液相色谱仪,出峰顺序依次为无水葡萄糖峰、果糖峰,无水葡萄糖峰与果糖峰的分离度应大于1.5。
1.2.5测定法
取转化糖电解质注射液作为供试品溶液,精密量取10μL注入液相色谱仪,记录色谱图;另取上述对照品溶液,照高效液相色谱法同法测定。按外标法以峰面积计算果糖和无水葡萄糖的含量。
1.3 方法学验证
1.3.1空白溶液的干扰试验
取空白溶液(不含无水葡萄糖和果糖)10μL注入液相色谱仪,记录色谱图;同时取供试品10μL注入液相色谱仪,记录色谱图,考察空白组份峰对两个主峰的干扰情况。
1.3.2系统适用性
分别取无水葡萄糖对照品和果糖对照品适量,加水溶解并稀释制成25mg/mL的溶液,作为无水葡萄糖溶液和果糖溶液;另取无水葡萄糖对照品和果糖对照品适量混合后加水溶解并稀释制成各含25mg/mL的混合对照品溶液;取转化糖电解质注射液20130101批作为供试品溶液。
在确定的液相色谱条件下,分别取空白溶液(不含无水葡萄糖和果糖)、无水葡萄糖溶液、果糖溶液、混合对照品溶液、供试品溶液各10μL注入液相色谱仪,记录色谱图,考察空白组份、无水葡萄糖和果糖的出峰情况及空白组份峰与主峰的分离情况。
1.3.3线性范围
取果糖和无水葡萄糖对照品各约250mg,精密称定,置5mL量瓶中,加水溶解并定量稀释制成每1mL约含无水葡萄糖和果糖均为50mg的溶液,作为贮备液;分别精密量取贮备液0.1mL、0.3mL、0.5mL、0.7mL置1mL量瓶中,加水稀释至刻度,摇匀,作为溶液①②③④,取贮备液作为溶液⑤,分别精密量取各溶液10μL注入液相色谱仪,记录色谱图,以峰面积与对应无水葡萄糖和果糖的浓度进行线性回归,绘制标准曲线。
1.3.4对照品溶液进样精密度
精密称取无水葡萄糖和果糖对照品各适量,加水溶解并定量稀释制成每1mL含无水葡萄糖和果糖均各约25mg的溶液作为对照品溶液,精密量取对照品溶液10μL,注入液相色谱仪,连续进针6次,记录色谱图。计算峰面积RSD值。
1.3.5对照品溶液稳定性
取“对照品溶液进样精密度”项下溶液,于室温下放置,分别于放置的第0、2、4、6、8、12、24小时取样检测,考察无水葡萄糖峰和果糖峰面积随放置时间的变化情况。
1.3.6溶液稳定性
取转化糖电解质注射液20130101批作为供试品溶液,于室温下放置,分别于放置的第0、2、4、6、8、12、24小时取样检测,考察无水葡萄糖峰和果糖峰面积随放置时间的变化情况。
1.3.7重复性
取转化糖电解质注射液20130101批照确定的方法进行测定,平行测定6份。6份测定值计算RSD值。
1.3.8中间精密度
取转化糖电解质注射液20130101批照确定的方法由两人分别进行测定,各平行测定6份。12份测定值计算RSD值。
1.3.9准确度
分别精密称取无水葡萄糖和果糖对照品约20mg、25mg、30mg各三份置1mL量瓶中,加入空白溶液溶解并稀释至刻度,摇匀,作为低(80%)、中(100%)、高(120%)检测浓度的供试品溶液。另分别精密称取无水葡萄糖和果糖对照品各约25mg,置1mL量瓶中,加水溶解并定量稀释至刻度,摇匀,作为对照品溶液。分别精密量取供试品溶液和对照品溶液各10μL注入液相色谱仪,记录色谱图,按外标法计算无水葡萄糖和果糖测得量,将测得量与加入量进行比较,计算无水葡萄糖和果糖的回收率。
1.3.10定量限
精密量取“线性与范围”项下的溶液① 1mL置10mL量瓶中,加水稀释至刻度,摇匀,精密量取1mL置50mL量瓶中,加水稀释至刻度,摇匀,精密量取10μL,注入液相色谱仪,记录色谱图。当信噪比为10∶1时注入仪器的量作为定量限。
2 结果与分析
2.1 空白溶液的干扰试验
空白溶液在18.999、20.682分钟出峰,本品主峰无水葡萄糖和果糖的保留时间分别为23.103、26.790分钟,空白溶液不干扰本品的检测。
2.2 系统适用性
无水葡萄糖峰和果糖峰的保留时间分别为23.103分钟和26.790分钟;混合对照品溶液中两峰的分离度为3.237,大于2.0;供试品溶液中,无水葡萄糖峰与相邻峰的分离度为2.136和3.169,大于2.0;果糖峰与相邻峰的分离度为3.169,大于2.0;无水葡萄糖峰和果糖峰拖尾因子分别为1.045和1.041,对称性好;理论板数分别为6918、7782,大于2500,故本方法对无水葡萄糖和果糖含量测定的系统适用性良好。见图1。

图1 系统适用性HPLC图的比较
2.3 线性与范围
结果表明,无水葡萄糖在4.9231~49.2306mg/mL浓度范围内,无水葡萄糖的浓度与峰面积线性关系良好,线性方程为Y=287569X+ 10201,相关系数r=0.9994。果糖在5.2019~52.0191mg/mL浓度范围内,无水葡萄糖的浓度与峰面积线性关系良好,线性方程为Y=271009X+ 8074.3,相关系数r=0.9994。以峰面积为纵坐标,以糖浓度为横坐标,绘制标准曲线(图2、图3)。

图2 无水葡萄糖含量测定线性关系图

图3 果糖含量测定线性关系图
2.4 对照品溶液进样精密度
对照品溶液连续进针6针,无水葡萄糖和果糖峰面积的RSD值均为0.45%,小于2.0%。结果表明,本方法进样精密度良好。结果见表1。

表1 对照品溶液进样精密度试验结果
2.5 对照品溶液稳定性
无水葡萄糖和果糖峰峰面积的RSD分别为0.90%和0.87%,小于2.0%。结果表明,对照品溶液在24小时内稳定性良好。结果见表2。

表2 对照品溶液稳定性试验结果
2.6 溶液稳定性
无水葡萄糖和果糖峰面积的RSD分别为0.14%和0.13%,小于2.0%。结果表明,供试品溶液在24小时内稳定性良好。结果见表3。
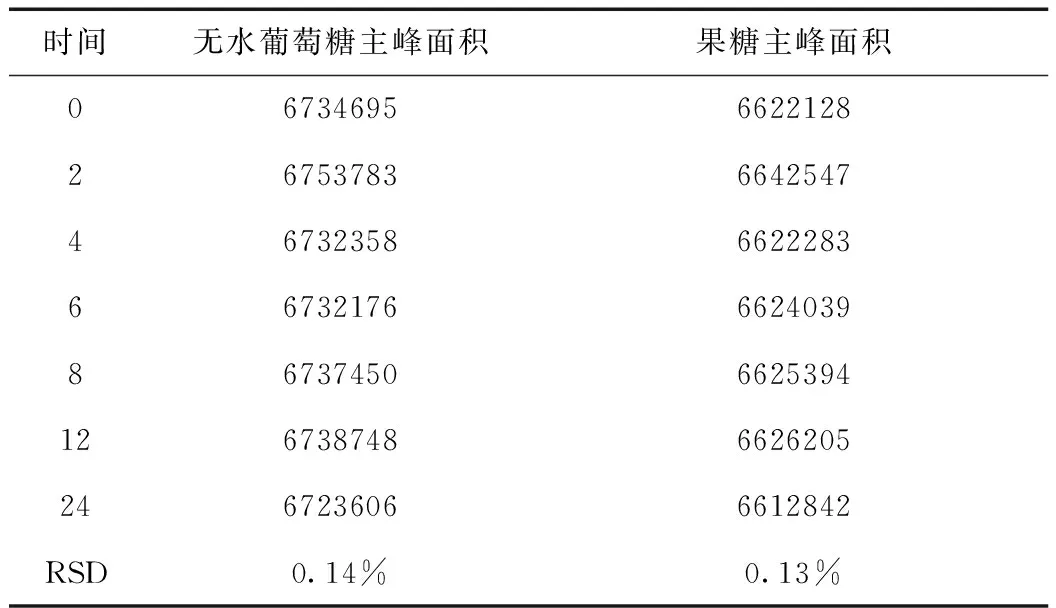
表3 供试品溶液稳定性试验结果
2.7 重复性
6份平行样品无水葡萄糖和果糖含量的RSD分别为0.09%和0.11%,小于2.0%。结果表明,本测定方法的重复性良好。结果见表4。
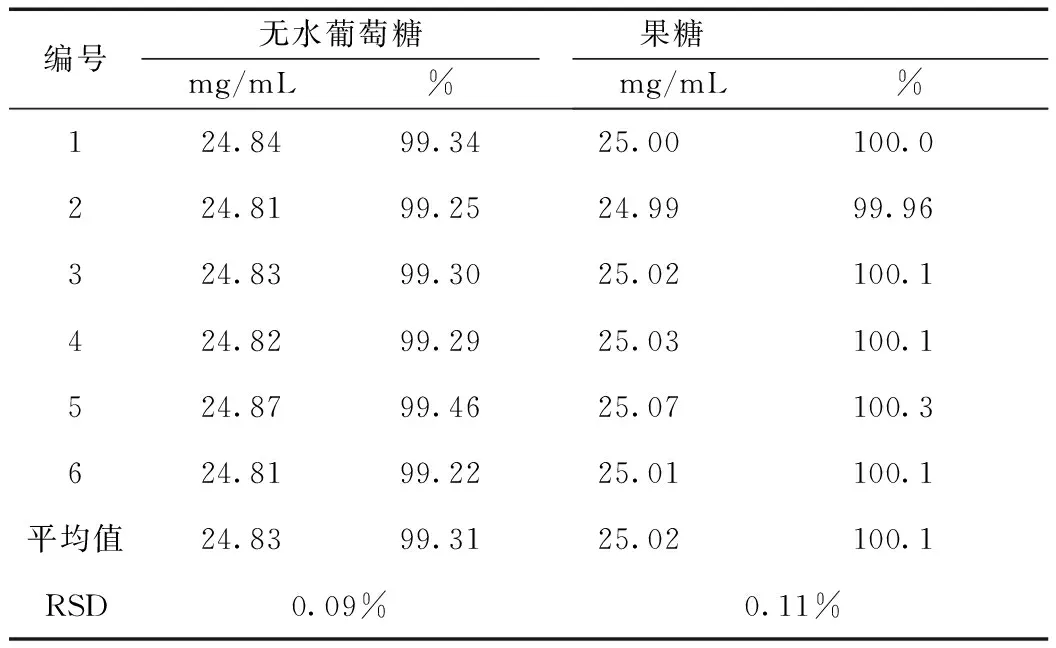
表4 无水葡萄糖和果糖含量考察的重复性试验结果
2.8 中间精密度
不同实验人员分别各平行测定6份,共12份样品,无水葡萄糖和果糖含量的RSD分别为0.35%、0.90%,小于2.0%。结果表明,本测定方法的中间精密度良好。结果见表5。
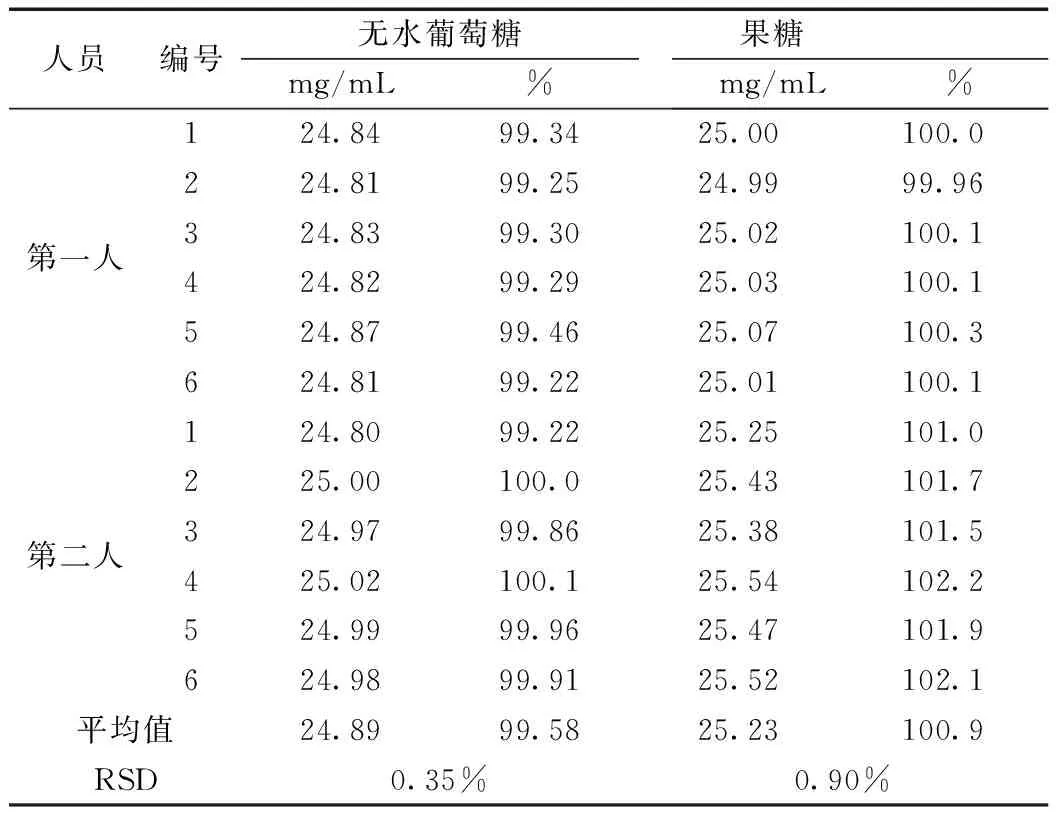
表5 无水葡萄糖和果糖含量考察的中间精密度试验结果
2.9 准确度
无水葡萄糖和果糖的回收率分别为100.7%~101.7%和100.6%~101.9%,平均值分别为101.2%和101.3%,RSD分别为0.32%和0.41%,小于2.0%。结果表明,本方法准确度良好,结果见表6、表7。

表6 无水葡萄糖含量考察的准确度试验结果

表7 果糖含量考察的准确度试验结果
2.10 定量限
结果表明,无水葡萄糖和果糖的定量限分别为98.46 ng和104.0ng,相当于主药标示量(25mg/mL)的0.04%,故检测方法的灵敏度较好。结果见图4。

图4 无水葡萄糖和果糖的定量限HPLC图
2.11 样品测定
根据已确定的测定方法,取转化糖电解质注射液6批,进行无水葡萄糖和果糖含量测定,含量测定结果稳定。结果见表8。

表8 无水葡萄糖和果糖的测定结果
3 结语
根据药物研究指导原则,建立了转化糖电解质注射液中无水葡萄糖和果糖含量检测方法,并进行了相关方法学验证。方法验证结果表明,该方法专属性强,灵敏度高,线性关系良好,具有较好的进样精密度和重复性,回收率较高。该方法能够准确可靠的应用于转化糖电解质注射液中无水葡萄糖和果糖含量检测。
