酰胺质子转移加权成像及脂肪定量测量技术评估子宫内膜癌Her-2基因表达
2021-03-05田士峰刘爱连任雪陈丽华王楠林良杰王家正张祎张婷
田士峰 ,刘爱连 *,任雪 ,陈丽华 ,王楠 ,林良杰 ,王家正 ,张祎 ,张婷
人表皮生长因子受体2(human epidermal growth factor receptor-2,Her-2)基因是位于17号染色体长臂的原癌基因,编码一种跨膜酪氨酸激酶受体,在乳腺癌、胃癌、卵巢癌、子宫内膜癌(endometrial carcinoma,EC)等恶性肿瘤中均存在过度表达,可引起细胞异常增殖进而导致恶性转化,并与肿瘤血管生成、肿瘤转移具有相关性[1-3]。对于Her-2基因阳性的EC患者,采用靶向药物治疗方式(如曲妥珠单抗、拉帕替尼等)有望提高无进展生存期[4-5],因此在治疗前评估EC Her-2基因表达情况具有重要意义。酰胺质子转移加权(amide proton transferweighted,APTw)成像本质上属于化学交换饱和转移(chemical exchange saturation transfer,CEST)成像,其定量参数APT值反映了酰胺质子的浓度和交换速率[6-7]。脂肪定量测量(mDIXON-Quant)技术通过脂肪7峰值建模及磁场不均性校正,可获横向弛豫率(R2*)、脂肪分数(fat fraction,FF)等多个定量参数,反映组织内顺磁性物质、脂肪含量[8-9]。本研究拟探讨APTw和mDixon‐Quant技术多定量参数评估EC Her-2基因表达情况的价值,以期为EC患者实施精准个体化治疗提供合理参考依据。
1 材料与方法
1.1 研究对象
回顾性分析2020年1月至2021年5月符合以下入组标准的患者资料:(1)经手术病理证实为EC,术后免疫组织化学分析指标包含Her-2,Her-2表达定位于细胞膜,当肿瘤细胞的细胞膜出现清晰的棕黄色颗粒,且着色强度高于非特异染色背景时判定为阳性,未见棕黄色颗粒判定为阴性。(2)术前2周内于我院行MR检查,扫描序列包括APTw和mDixon-Quant;(3)患者在MRI检查前未接受放化疗及活检、刮宫等其他处置;(4)图像质量良好,病灶显示清晰,病灶直径(厚度)在1.5 cm以上。分析时间段内共有58例EC患者,其中10例病灶较小显示不清,剩余48例患者中22例术后免疫组织化学分析指标未包含Her-2,最终有26例患者纳入研究,其中Her-2表达阳性组11例,Her-2表达阴性组15例。Her-2表达阳性组患者年龄36~75(58.5±10.9)岁;绝经前1例,绝经后10例;病理类型为子宫内膜样腺癌9例(中分化5例,低分化4例),未分化癌1例,癌肉瘤1例;分期为Ⅰa期7例,Ⅰb期1例,Ⅲ期2例,Ⅳ期1例。Her-2表达阴性组患者年龄39~70(54.5±8.1)岁,绝经前5例,绝经后10例;病理类型均为子宫内膜样腺癌,其中高分化7例,中分化6例,低分化2例;分期为Ⅰa期12例,Ⅲ期3例。本研究经过大连医科大学附属第一医院医学伦理委员会批准(批准文号:PJ-KS-KY-2021-10),免除受试者知情同意。
1.2 检查方法
采用飞利浦3.0 T磁共振扫描仪(IngeniaCX,Philips Healthcare,Best,the Netherlands),32 通道体部线圈。患者检查前准备包括排尿、禁食4~6 h,对于放置节育环的患者于检查前1 d取出。扫描序列及主要扫描参数见表1所示。
1.3 图像处理与数据测量
扫描完成后原始图像自动上传至飞利浦ISP 7.0工作站,经后处理生成APTw以及mDixon-Quant的R2*、FF伪彩图。由2名盆腔MR诊断经验6年和10年的放射科医师(观察者1,2),在不知晓具体Her-2基因表达情况的前提下分别进行数据测量。选择病灶最大径所在层面进行感兴趣区(region of interest,ROI)勾画,以常规扫描及增强扫描图像作为参考,避开囊变、出血及坏死区,采用多边形工具在肿瘤实质区域内手动勾画ROI(任意形状,覆盖范围尽可能大,并适度避开病灶边缘以避免容积效应的影响),并自动算出APT值、R2*值以及FF值。为了与轴位mDixon-Quant图像相对应,在测量APT值时,以轴位T2WI作为解剖参照图像,将矢状位APT伪彩图融合到T2WI图像上(图1,2),并尽量保证两序列各图像ROI勾画时层面、位置接近。
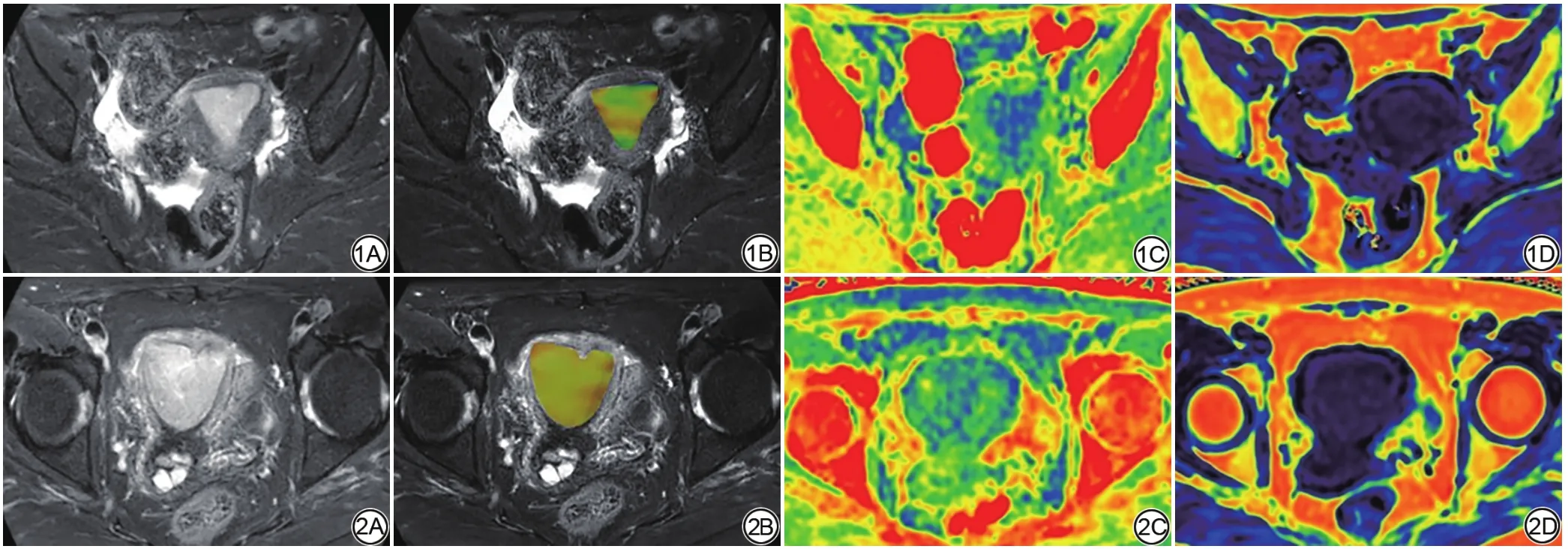
图1 57岁高分化子宫内膜样腺癌患者,人表皮生长因子受体2(Her-2)基因表达阴性。A为T2WI;B为酰胺质子转移(APT)伪彩图与T2WI的融合图像,APT值为2.400%;C、D分别为mDixon‑Quant序列的横向弛豫率(R2*)、脂肪分数(FF)伪彩图,其定量值分别为15.225 Hz、0.420 图2 为58岁子宫内膜未分化癌患者,Her-2基因表达阳性。A为T2WI;B为APT伪彩图与T2WI的融合图像,APT值为2.900%;C、D分别为mDixon‑Quant序列的R2*、FF伪彩图,其定量值分别为19.765 Hz、0.630
1.4 统计学分析
应用SPSS 26.0统计学软件进行分析:首先采用Kolmogorov-Smirnov进行数据正态性检验,符合正态分布时用±s表示,符合偏态分布时用中位数(P25,P75)表示;之后采用同类相关系数(intra-class correlation coefficients,ICC)检验2名观察者对两组病例各参数值测量结果的一致性(ICC<0.40为一致性差,0.40≤ICC<0.75为一致性中等,ICC≥0.75为一致性良好),取2名观察者测量结果均值进行后续分析;之后采用独立样本t检验(正态分布)或Mann-WhitneyU检验(偏态分布)比较两组各参数值之间的差异,P<0.05为差异具有统计学意义;之后采用ROC曲线分析评估差异有统计学意义的参数评估EC Her-2基因表达的效能,计算曲线下面积(area under the curve,AUC)及其95%可信区间,以及相对应的截断值、敏感度、特异度。
2 结果
2.1 观察者各序列参数测量结果的一致性分析
2名观察者对两组病例各序列参数测量一致性检验结果见表2,各组数据测量的一致性良好(ICC>0.75)。
表2 2名观察者各参数测量结果的一致性(±s)
注:APT:酰胺质子转移;R2*:横向弛豫率;FF:脂肪分数。
参数Her-2表达阳性组(11例)APT(%)images/BZ_77_261_1479_292_1510.pngR2*()FF(%)Her-2表达阴性组(15例)APT(%)images/BZ_77_261_1702_292_1733.pngR2*()FF(%)观察者1 2.655±0.398 17.567±2.860 1.487±1.088 2.273±0.417 14.784±2.070 1.466±1.130观察者2 2.764±0.388 16.637±2.001 1.771±1.128 2.353±0.436 15.480(15.230,16.350)1.486±1.194 ICC 0.883 0.881 0.960 0.944 0.889 0.944
2.2 两组病例各序列参数值比较结果
Her-2表达阳性组与Her-2表达阴性组组间各序列参数值及比较结果见表3,Her-2表达阳性组的APT、R2*值大于Her-2表达阴性组,差异具有统计学意义(P<0.05),两组之间的FF值差异无统计学意义(P>0.05)。
表3 组间各序列参数值及比较结果(±s)

表3 组间各序列参数值及比较结果(±s)
注:APT:酰胺质子转移;R2*:横向弛豫率;FF:脂肪分数;Her-2表达阳性组APT值不符合正态分布。
?
2.3 诊断效能评估
APT值、R2*值评估EC Her-2基因表达阳性与阴性的AUC、截断值、敏感度、特异度及曲线下面积见表4。

表4 诊断效能分析
3 讨论
3.1 APTw评估EC Her-2基因表达的价值
APTw通过APT值定量反映酰胺质子与水的交换率以及酰胺质子总量(通过对水质子与酰胺质子互换后产生的信号下降进行探测这一途径),APT值与组织细胞中游离蛋白质与多肽的含量呈正相关[10]。本研究探讨了APTw半定量评估ECHer-2基因表达的可行性,结果表明Her-2表达阳性组的APT值大于Her-2表达阴性组。Her-2基因编码分子量为185kD的跨膜糖蛋白[11],并通过诱导细胞周期蛋白D1过度表达、活化下游P13K/AKT通路等多种方式促进肿瘤细胞增殖[12-13],因此Her-2基因表达阳性EC细胞生长更为活跃,可产生相对多量的蛋白质、多肽类物质,导致APT值增高。此外,Her-2可通过激活血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白过度表达而促进肿瘤血管生成[14],而肿瘤内微血管密度增加而生成的不成熟毛细血管网和随之引起的血流灌注增高也可能是APT值升高的原因[15]。目前APTw技术已经初步应用于子宫恶性肿瘤病变中,主要集中在病理特征的评估方面,取得了一系列研究成果,包括术前预估子宫内膜样腺癌和宫颈鳞癌病理分级(高、中、低分化)、术前鉴别宫颈癌病理亚型(鳞癌与腺癌)等[16-19]。本研究将APTw技术在子宫肿瘤的应用范畴拓展到评估免疫组化指标方面,即利用APTw定量参数评估EC Her-2基因表达。
3.2 mDIXON-Quant评估EC Her-2基因表达的价值
mDIXON-Quant技术的R2*值是组织氧合水平的定量体现,与组织内顺磁性物质浓度呈正比[20]。本研究结果证实Her-2表达阳性EC的R2*值大于Her-2表达阴性者,这是由于Her-2基因表达阳性可促进肿瘤细胞增殖,进而引起单位体积内肿瘤细胞数量的增加和代谢水平的提升,增加耗氧而加重EC肿瘤组织乏氧,脱氧血红蛋白浓度相应增高,表现为R2*值的增高。此外,如前所述,Her-2阳性EC肿瘤组织中的新生血管数量增加,引起肿瘤组织微出血、血流淤积,造成脱氧血红蛋白、含铁血黄素等顺磁性物质浓度增高,也会引起R2*值增高。既往研究者报道了R2*值可评估EC增殖抗原Ki-67表达以及微卫星不稳定状态[21-22],提示R2*值在术前评价EC免疫组化指标方面具有重要潜在价值。同时,两组病例间的FF值无差异,提示两组病例含脂量相似。APTw和mDixon-Quant均为分子层面的成像技术,本研究首先应用此两种技术,从不同角度反映Her-2基因引起的EC细胞增殖差异信息,诊断效能中等,AUC分别为0.755、0.739。
3.3 局限性
首先,本研究包含病例数有限,且为单中心研究,有待于今后持续扩充病例并进行多中心外部验证;其次,APTw与mDIXON-Quant序列的扫描层厚不同,勾画ROI时不同序列图像之间未能做到完全匹配,可能会对部分结果造成偏差;再次,ROI的勾画采用常规方法,即仅限于EC实质区而非肿瘤全域,可能会丢失部分肿瘤异质性信息。
综上所述,APTw与mDIXON-Quant技术可以半定量评估EC Her-2基因表达情况,具有一定临床应用前景。
作者利益冲突声明:全体作者均声明无利益冲突。
